中国南黄海浒苔种群世代结构与生殖条件分析*
2012-10-16王浩东金月梅朱明壮
王浩东,姚 雪,池 姗,赵 翠,金月梅,刘 翠,朱明壮,刘 涛**
(中国海洋大学1.海洋生命学院;2.水产学院,山东 青岛266003)
浒苔(Ulva prolifera)属于绿藻门(Chlorophyta)、石莼目(Ulvales)、石莼科(Ulvaceae)、石莼属(Ulva),是世界范围内“绿潮”形成的主要种类之一。近年来这种因海水富营养化和气候异常等因素引起的灾难性现象引起了广泛的重视,产生了许多关于石莼属物种的生长发育条件的研究,包括适宜其生长的温度、盐度、光强等生态因子的范围[1-5],CO2、N、Fe、Mn、P等营养元素对其生长的影响[6-8],以及生活史的研究等[9-13]。
本实验首先研究了不同地区、不同季节浒苔样品的世代结构特征,探讨了温度、盐度和光强等生态因子对其配子和孢子放散速度及放散量的影响,以期为探明绿潮暴发的机制提供科学参考。
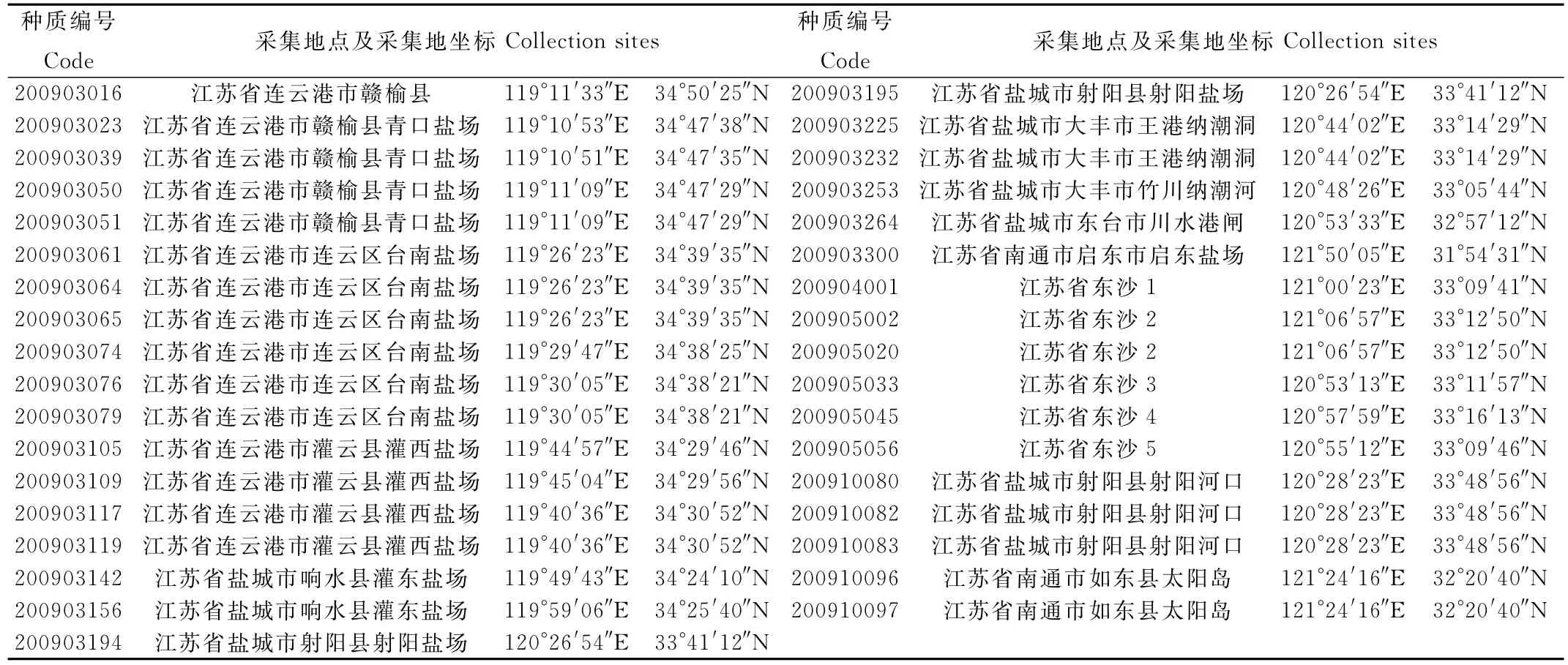
表1 实验材料的采集地信息Table 1 Collection details of Ulva prolifera used in this study
1 材料和方法
1.1 实验材料
本实验材料采集于2009年江苏省沿海,包括了11个站位的35份浒苔样品,保存于中国海洋大学大型海藻种质库(样品采集地分布见表1、图1)。

图1 实验材料的采集地Fig.1 Collection sites of Ulva proliferafrom the Yellow Sea,China
1.2 实验方法
1.2.1 材料预处理及群体放散测试 对表1中的群体样品,在浓度为1%的KI-I2溶液中漂洗3~5s以杀死原生动物和附生杂藻,然后用经煮沸的消毒海水冲洗2~3次,再放入500mL烧杯中,保鲜膜加盖置于温度18℃、光照强度3 000lx下保存3d,培养液为煮沸过的消毒海水。
在保存期间,对所有群体做放散测试,方法为:在每个群体中选择10株以上的藻体,用吸水纸吸干,置于4℃、黑暗条件下做低温干燥刺激放散,处理时间为5min。之后用一次性滴管在藻体中滴加常温海水,使生殖细胞放散。1min后吸取包含生殖细胞的海水,滴加在洁净的载玻片上,通以单侧光照后,置于OLYMPUS-CX21显微镜10倍目镜下观察趋光性。滴加约等倍体积的20%KI-I2染液,100倍目镜下观察生殖细胞的鞭毛数目,每个群体统计20个以上的生殖细胞鞭毛数目,若观察到的生殖细胞都为2鞭毛且具有正趋光性,则可认为是配子体群体;若观测到的生殖细胞都为4鞭毛且具有负趋光性,则可认为是孢子体群体[14];若2、4鞭毛相混杂且包含2种趋光性的生殖细胞,则认为是孢子体与配子体混合的群体。
1.2.2 实验设计 经初步鉴定为配子体世代/孢子体世代的材料,每个群体中随机挑选生长状态良好一致且在镜检中未发生放散的单株藻体,在温度25℃,盐度40,光照强度7 000lx的条件下,500mL烧杯保鲜膜加盖预培养2d。孢子体和配子体分隔培养。
采用三因素三水平完全随机实验方案,观察环境因子对浒苔配子体世代和孢子体世代生殖的影响。温度设置15、20和25℃3个梯度,盐度设置10、35、40 3个梯度,光照强度设置3 000、5 000和7 000lx 3个梯度、单侧光照,共27个温度-盐度-光强组合,配子体分别编号为G1~G27,孢子体分别编号为S1~S27。为防止同一群体内出现不同世代藻体的混杂,之前孢子体和配子体各预培养了2倍数量的藻体。
1.2.3 显微观察 培养当天,即可用显微镜进行观察。经连续观察,每株统计20个以上放散的生殖细胞的鞭毛数目,以确定不同采集地的样品所处世代是否相同。挑选放散时间相近的不同藻株的配子,将其调整到相当的密度后进行杂交实验。待生殖细胞充分放散后,对藻体不同部位进行显微观察,并用DP71显微镜数码成像系统拍照进行排空率的统计(视野中已经排空的细胞的数量占所有细胞的比例即为藻体的排空率),每株藻体取5个视野分别统计记录,少量出现异常数值的藻体,进行添加法补充实验。实验数据采用Excel 2003软件进行方差分析,再采用q测验分析试验结果均值的差异显著性。
1.2.4 DNA含量测定 参照方宗熙等的方法制备粒花冠小月螺粗酶液[15],并添加1.5%的纤维素酶和2mol/L葡萄糖制备为酶解液,在25℃黑暗条件下酶解3h,得到浒苔体细胞原生质体,1 500g离心收集后用-20℃预冷的乙醇溶液固定(终浓度为70%),稀释为(1~2)×105个/mL细胞悬液,4℃保存。采集浒苔放散的生殖细胞,用-20℃预冷的乙醇溶液固定(终浓度为70%),稀释为(1~2)×105个/mL细胞悬液,4℃保存。
选取鸡红细胞作为标准参照细胞(DNA含量为2.5pg),1 500g离心收集后加入1mL PBS缓冲液重悬,后加入1mg/mL碘化丙啶(PI)染料50μL染色30min,用Beckman Coulter公司的FC500MPL型流式细胞仪进行细胞DNA含量分析(根据叶绿素荧光强度设门,以排除淀粉酶颗粒等杂质干扰,再根据大小3~5μm设门进行细胞类群的划分)。
2 结果与分析
2.1 不同地区浒苔样品的世代鉴定
2.1.1 放散生殖细胞统计 选取12个采集地的28份浒苔样品的生殖细胞类型进行鉴定(见表2),发现均存在处于孢子体和配子体世代的藻体。春季10个采集地的24份样品中,13份为配子体世代,11份为孢子体世代。秋季2个采集地的4份样品,其中2份为孢子体世代,另外2份为孢子体和配子体混杂样品。
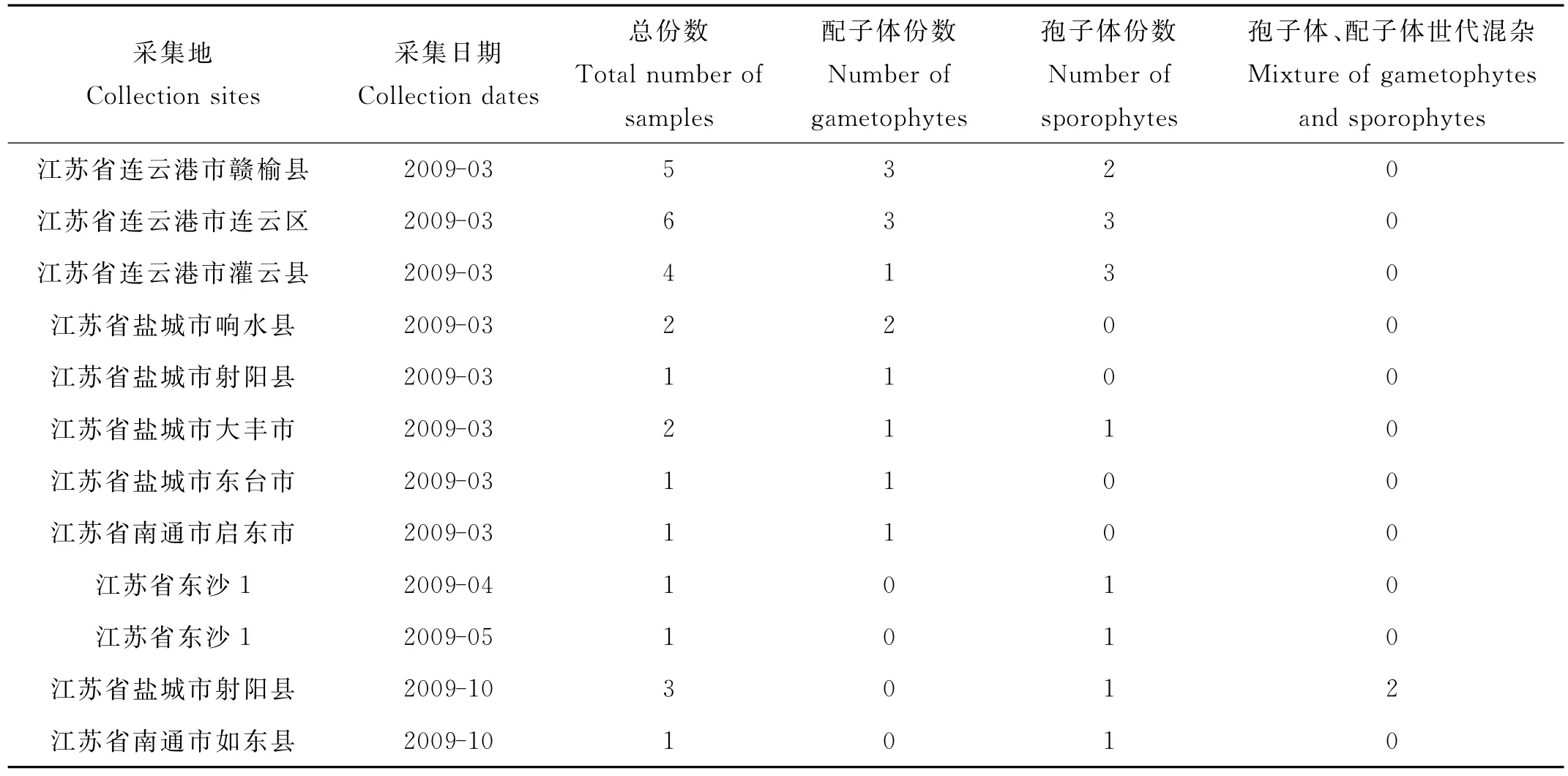
表2 不同地区浒苔样品放散生殖细胞鞭毛数目的统计及生活史世代的推测Table 2 Number of thallus releasing each type of zoids of Ulva prolifera and presumed generation of life history for each collection site
2.1.2 体细胞及生殖细胞DNA含量测定结果 在研究的12份样品中,9份鉴定为配子体(配子),2份为孢子体(见表3)。配子(n)及配子体细胞(n)DNA含量在0.118~0.287pg之间(见图2),孢子体(2n)DNA含量为0.542pg。其中200910096样品DNA含量为0.349pg,在所测配子体体细胞DNA含量和孢子体体细胞DNA含量之间,因此推测此群体为孢子体和配子体世代混杂群体。根据孢子体和配子体细胞不同DNA含量可以进行浒苔不同世代的快速鉴定(见图3)。
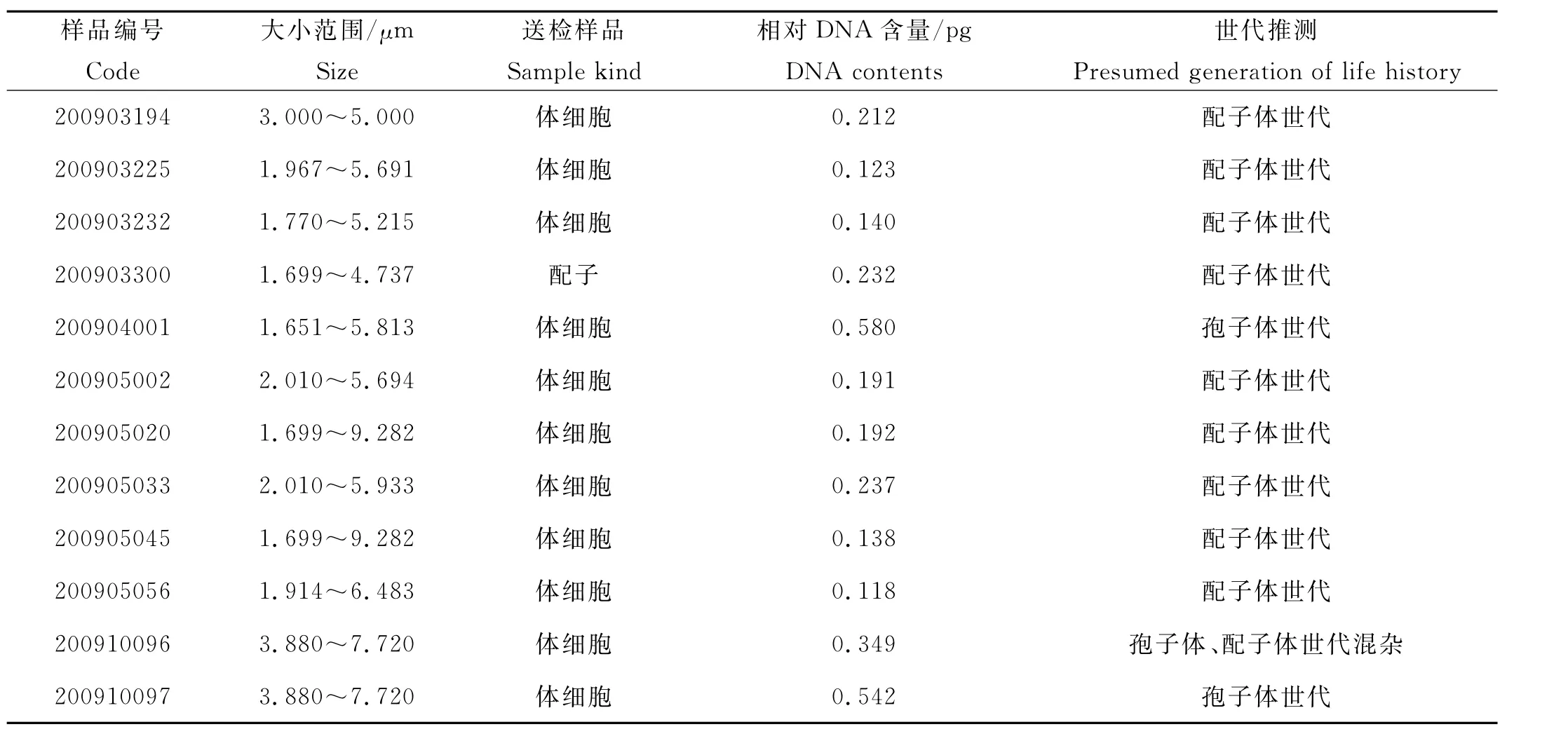
表3 浒苔体细胞及生殖细胞样品DNA含量流式测定结果及生活史世代的推测Table 3 DNA contents for gamete and vegetative cells of Ulva prolifera detected by flow cytometry and presumed generation of life history

图2 浒苔配子样品流式图Fig.2Histograms of fluorescence intensity in nuclei isolated from gametes of Ulva prolifera
2.2 环境因子对浒苔不同世代生殖发育的影响
2.2.1 不同环境因子对浒苔配子体世代生殖发育的影响 在27个温度-盐度-光强组合中(见表4),温度25℃、盐度40和光照7 000lx处理下培养48h后最早开始放散,其余处理组最晚放散时间为培养96h后。生殖放散首先从藻体的顶端开始,放散后藻体发白,随着放散继续进行,慢慢地整个藻体都变为白色。放散出的配子在水面上聚集在一起,培养液表层呈明显的绿色,轻轻晃动烧杯后聚集的配子散开,静置1h后重新在靠近光源一侧聚集,具有正趋光性;同时,经染色后在显微镜检其具有2根顶生鞭毛。挑选采自同一地区的,配子同步放散的处理组,进行了5组杂交实验,配子存在配对现象,但最终均未融合。连续培养一周后藻体基本放散完毕,但部分藻体内配子未完全排空,统计藻体平均排空率在0.192~0.999之间。
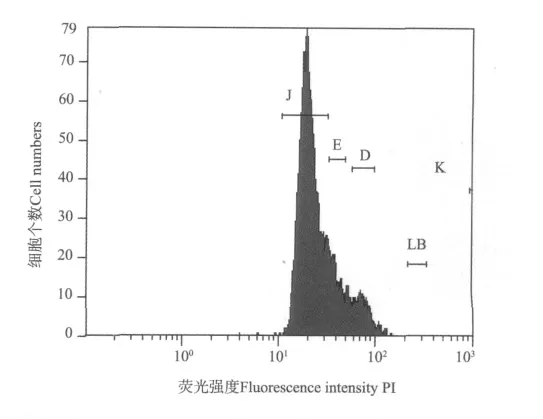
图3 浒苔孢子体体细胞样品流式图Fig.3Histograms of fluorescence intensity in nuclei isolated from protoplasts of Ulva prolifera

表4 温度、盐度和光强3个环境因子对浒苔配子体生殖的影响Table 4 Effects of temperature,salinity and light intensity on the reproduction of gametophytes of Ulva prolifera
生态因子对浒苔配子放散实验结果表明,温度、盐度对浒苔配子的放散都有极显著影响,且盐度的影响大于温度,而光照强度对浒苔配子的放散没有显著影响(见表5)。3种生态因子中,不仅任意2个生态因子间的交互效应都极显著,而且3个生态因子之间的交互效应也极显著。之后对各因素的不同水平进行q测验以分析其差异显著性,结果显示较高温度(25℃)处理相对于稍低温度(20℃)处理组对配子释放量有极显著影响;较低盐度(10)处理相对于海水平均盐度(35)和较高盐度(40)处理对配子释放量也有极显著影响;在光强上,不同强度的光照处理(3 000、5 000和7 000lx)对配子释放量的影响没有显著差别。
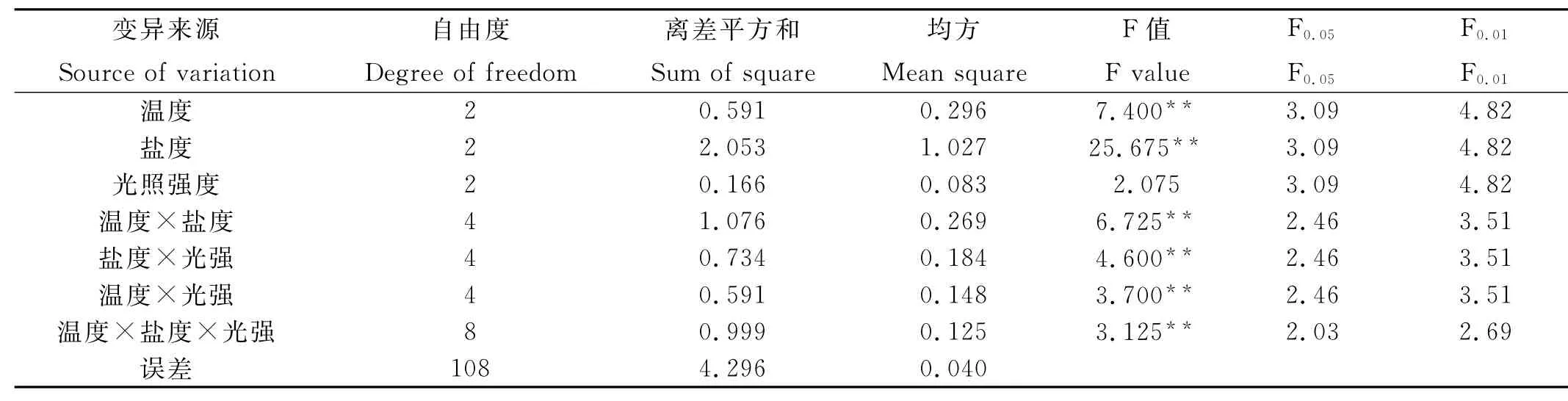
表5 温度、盐度和光强3个因子对浒苔配子体生殖影响的方差分析Table 5 Variance analysis of effects of temperature,salinity and light intensity on the reproduction of gametophyte of Ulva prolifera
2.2.2 环境因子对浒苔孢子体世代生殖发育的影响
在27个温度-盐度-光强组合中(见表6),温度25℃、盐度40和光照7 000lx条件下培养24h后最早开始放散,其余处理组最晚放散时间为培养120h后。孢子放散首先从藻体的顶端开始,放散后藻体发白,随着放散继续进行,慢慢地整个藻体都变为白色。孢子未在培养液表层聚集,为负趋光性;同时,经染色后在显微镜镜检发现其具有4根顶生鞭毛,且无融合现象。连续培养一周后孢子基本放散完毕,但部分藻体内孢子未完全排空,统计藻体平均排空率在0.022~0.992之间。

表6 温度、盐度和光强3个环境因子对浒苔孢子体生殖的影响Table 6 Effects of temperature,salinity and light intensity on the reproduction of sporophytes of Ulva prolifera
生态因子对浒苔孢子体排放孢子的影响结果(见表7)表明,温度、盐度对浒苔孢子的放散都有极显著影响,且温度的影响大于盐度,而光照强度对浒苔孢子的放散没有显著影响。3种生态因子中,除温度与光强的交互效应为显著外,其他任意2个生态因子间的交互效应都极显著,并且3个生态因子之间的交互效应也极显著。对各因素的不同水平进行q测验以分析其差异显著性,结果显示25和20℃处理组相对低温(15℃)处理对孢子释放量有极显著影响;高盐度(40)处理相对于较低盐度(10)处理、海水平均盐度(35)处理对孢子释放量有显著影响;不同光照强度处理(3 000、5 000和7 000lx)对孢子释放量的影响没有显著差别。

表7 温度、盐度和光强3个因子对浒苔孢子体生殖影响的方差分析Table 5 Variance analysis of effects of temperature,salinity and light intensity on the reproduction of sporophyte of Ulva prolifera
3 讨论
3.1 浒苔群体世代结构
浒苔样品放散生殖细胞的鞭毛数和细胞DNA含量测定的结果均证实了在同一时间、同一地理区域,有不同世代的浒苔并存的现象,这在浒苔自然群体中尚属于首次发现。Seibin等报道了在缘管浒苔(U.linza)中同一群体内存在的孢子体与配子体混杂的情况[9]。而在本实验中,对同一采集地不同株藻体放散的配子进行了融合实验,均未获得合子,推测其原因,可能是该样品的各个藻株均是同一亲本单性生殖的后代,从而造成自交不亲和。这进一步显示出浒苔生殖特性对于其世代混杂的贡献,即在配子生殖过程中同时存在着配子单性生殖和配子融合生殖2个途径,从而在群体的一次生殖过程中出现了配子体(n)和孢子体(2n)2种后代。
3.2 浒苔流式细胞法的世代鉴定
目前为止,在石莼科海藻世代鉴定方面,多数研究主要依靠生殖细胞鞭毛数量和趋光性来探讨其所处世代。但在浒苔、缘管浒苔生长发育特性研究中,均发现了其未放散生殖细胞直接在藻体中发育或附生于原藻体表面生长的现象[16-17],这对于浒苔世代鉴定存在较大的干扰。比较准确地方法是进行染色体制片,观察其染色体数目,但这种方法存在着操作复杂、检测效率低等问题。利用荧光染色进行藻体细胞DNA含量检测是一种比较简便和快捷的世代鉴定方法。Kapraun等使用显微分光光度法(染料为DAPI)测定了浒苔和缘管浒苔的单细胞DNA含量,前者约为1.10pg,后者约为0.6pg[18]。Gall等使用流式细胞法(染料为EB)测定了扁浒苔(U.compressa)原生质体的DNA含量,大约为0.26pg[19],Kagami等使用激光扫描细胞仪(染料为PI)测得的扁浒苔配子体DNA含量为0.28pg,并认为使用配子测量得到的数据比使用从配子体提取的细胞核测量结果更加稳定[20]。本实验使用流式细胞法(染料为PI)测得的浒苔配子体DNA含量为0.23pg,孢子体DNA含量为0.54pg。不同研究结果显示出基因组DNA含量差异可能主要来自于检测方法,显微分光光度法分析中易受到细胞质中色素体遮挡,干扰了荧光激发强度。利用细胞DNA含量进行世代鉴定需保证供测试样品的单细胞的完整性以及其活力。本实验结果显示,在保证没有附生藻体的情况下,进行单株藻体生殖细胞观察可以准确地进行其世代的鉴定,染色体制片较细胞DNA含量测定而言仍是世代鉴定最为可靠的方法;同时,利用流式细胞仪进行微小个体检测中,也可获得较为可靠的研究结果。
3.3 环境因子对浒苔不同世代生殖发育的影响
刘峰等认为低盐度(18)和提高温度(15和18℃)都有利于黄海绿潮构成种生殖细胞的形成,而低温会抑制其生殖细胞的形成[7]。本实验研究显示,浒苔孢子体和配子体的生殖发育对温度、盐度存在着不同的反应机制,盐度对配子体发育的影响大于温度,且较高温度(25℃)处理和较低盐度(10)处理对配子的放散有更大的促进作用;温度对孢子体发育的影响大于盐度,且较高温度(25℃)处理和较高盐度(40)处理对孢子的放散有更大的促进作用。而不同强度的光照处理(3 000、5 000和7 000lx)对配子和孢子的释放量的影响没有显著差别。部分已报道的研究结果显示高光强对孢子释放的促进作用明显[1-3],与本文研究结果不同,可能是与选取的实验材料生长阶段有关,且没有考虑到不同生态因子之间的交互作用。
温度、盐度对浒苔的配子体、孢子体的生殖发育都有极显著的影响,同时又与光照强度对浒苔配子体、孢子体放散的影响存在交互效应。本研究显示,在2009年春季在江苏省近海采样的样品中大部分是配子体,受温度升高和降水增多的影响,促使其进入有性生殖过程,这与夏初降雨后池塘发生浒苔增多的现象相一致。而在秋冬季节,春夏季萌发的孢子体随着降水减少将促使其无性生殖进入配子体世代。但在浒苔世代交替中,配子体世代同时存在配子融合生殖和配子单性生殖2种途径,形成了孢子体和配子体世代并存的现象,其生殖条件适宜范围扩大,在同时受到温度、降水和光照强度的交互影响下,将潜在地存在“机会窗”(The window of opportunity)事件[21],在短时间内集中生殖扩散,导致其种群规模的爆发性增长,最终形成绿潮灾害。
[1] Dan A,Hiraoka M,Ohno M,et al.Observations on the effect of salinity and photon fluence rate on the induction of sporulation and rhizoid formation in the green algaEnteromorpha prolifera(Müller)J.Agardh(Chlorophyta,Ulvales)[J].Fisheries Science,2002,68:1182-1188.
[2] Choi C G,Takeuchi Y,Terawaki T,et al.Ecology of seaweed beds on two types of artificial reef[J].Journal of Applied Phycology,2002,14:343-349.
[3] 王建伟,阎斌伦,林阿朋,等.浒苔(Enteromorpha prolifera)生长及孢子释放的生态因子研究 [J].海洋通报,2007,26(2):60-65.
[4] Sousa A I,Martins I,LillebA I,et al.Influence of salinity,nutrients and light on the germination and growth of Enteromorpha sp.spores[J].Journal of Experimental Marine Biology and Ecology,2007,341:142-150.
[5] 刘峰.黄海绿潮的成因以及绿潮浒苔的生理生态学和分子系统学研究 [D].青岛:海洋研究所,2010:60-61.
[6] 邹定辉,陈雄文.高浓度CO2对条浒苔(Enteromorpha clathrata)生长和一些生理生化特征的影响 [J].海洋通报,2002,21(5):39-45.
[7] 李瑞香,吴晓文,韦钦胜,等.不同营养盐条件下浒苔的生长[J].海洋科学进展,2009,2:211-216.
[8] 李俭平,赵卫红,付敏,等.氮磷营养盐对浒苔生长影响的初步探讨 [J].海洋科学,2010,34(4):45-48.
[9] Seibin A,Ikuko S.Variablity of morphological structure and mode of reproduction in Enteromorpha linza [J].Jap Journ Bot,1959,17(1):92-100.
[10] Van Den Hoek C,Mann D G.Algae an introduction to phycology[M].Cambridge:Cambridge University Press,1996.
[11] Bliding C.A critical survey of Europaen taxa in Ulvales.Part I.Capspsiphon,Percursaria,Blidingia,Enteromorpha[J].Opera Botanica,1963,8:1-160.
[12] Koeman R P T,Van Den Hoek C.The taxonomy of Enteromorpha Link,1820,(Chlorophyceae)in the Natherlands.I.The section Enteromorpha[J].Algological studies,1982,32:279-330.
[13] Hiraoka M,Dan A,Shimada S,et al.Different life histories of Enteromorpha prolifera(Ulvales,Chlorophyta)from four rivers on Shikoku Island,Japan[J].Phycologia,2003,42(3):275-284
[14] 叶乃好,张晓雯,毛玉泽,等.黄海绿潮浒苔 (Enteromorpha prolifera)生活史的初步研究[J].中国水产科学,2008,15(5):853-857.
[15] 方宗熙,唐延林.用酶法分离紫菜营养细胞和原生质体获得成功[J].海洋通报,1982,5:94-96.
[16] 丁怀宇,马家海,王晓坤,等.缘管浒苔的单性生殖[J].2006,15(4):494-496
[17] 王晓坤,马家海,叶道才,等.浒苔(Enteromorpha prolifera)生活史的初步研究[J].海洋通报.2007,26(5):112-116
[18] Kapraun D F,Bailey J C.Karyology and cytophotometric estimation of nuclear DNA variation in seven species of Ulvales(Chlorophyta)[J].Japanese Journal of Phycology,1992,40:13-24.
[19] Y Le Gall,S Brown,Dominique Marie,et al.Quantification of nuclear DNA and G-C content in marine macroalgae by flow cytometry of isolated nuclei[J].Protoplasma,1993,173:123-132.
[20] Yayoi Kagami,Mariko Fujishita,Kazuyo Matsuyama-Serisawa,et al.DNA content of Ulva compressa (Ulvales,Chlorophyta)nuclei determined with laser scanning cytometry[J].Phycological Research,2005,53(1):77-83.
[21] Serrao E A,Brawley S H,Hedman J,et al.Reproductive success of Fucus vesiculosus (Phaeophyceae)in the Baltic Sea[J].J Phycol,1999,35:254-269.
