草鱼混养系统细菌数量变动和群落功能多样性研究*
2012-10-16田相利郑瑶瑶柳炳俊董双林
田相利,郑瑶瑶,柳炳俊,王 芳,董双林
(中国海洋大学海水养殖教育部重点实验室,山东 青岛,266003)
在水产养殖集约化或半集约化的养殖过程中,养殖池塘中的残存的饵料、排泄物、生物残体等有机物的积累越来越多,往往超过了池塘的自净能力,最终可能导致养殖水体理化环境和生态环境不断恶化,严重影响养殖动物的生长和生存[1]。众所周知,细菌既是分解者,又可作为水生生物的间接或直接饵料,与此同时,水体中细菌对腐质碳的矿化作用在水体碳循环中也起着重要作用[2]。鉴于微生物在生态系统中的重要作用,深入研究不同养殖模式下环境中微生物数量和功能,对于进一步理解微生物在人工生态系统中的作用及其机制具有十分重要的意义[3]。
多种类混养是我国传统养殖方式之一,它是提高物质的利用率,提高产量、减污防病的重要措施[4]。目前多种类混养研究集中于混养对水质的调控作用、环境效应、经济效益和生态效益的等多个方面[5-8]。草鱼(Ctenopharyngodon idellus)是我国淡水经济鱼类最负盛名的“四大家鱼”之一,因其食性简单、饵料来源广泛、产量高等特点常被放养于池塘、湖泊、水库中,在我国淡水养殖中占有重要地位[9]。不同种类混养则是草鱼池塘养殖的传统养殖方式之一,然而迄今关于草鱼混养生态系统的结构和功能却仍缺少的系统的理论解析。从现有研究看,从微生物生态学的角度研究草鱼不同养殖模式对微生物群落多样性影响的研究还少见报道。Biolog微平板分析法是通过测定微生物对不同碳源利用能力及其代谢差异,进而用以表征微生物功能多样性的一种方法,其能够有效地评价环境中的微生物群落功能的差异[10-12]。本研究利用平板菌落计数法和吖啶橙直接镜检计数法(AODC)2种不同的方法对养殖环境细菌数量变动情况进行了监测,同时,应用Biolog微平板技术研究了不同养殖系统细菌的碳代谢功能的差异,以期为草鱼混养系统的结构优化提供理论支撑。
1 材料与方法
1.1 实验围隔与混养模式设计
草鱼混养的实验研究于2010年6~10月在山东省淡水水产研究所进行。养殖实验于设置在池塘中的陆基实验围隔中进行。围隔面积为64m2(8m×8m),建于面积为0.3hm2、平均水深为1.5m左右的池塘内,围隔具体结构参见文献[13]。设计了3个不同的草鱼养殖模式,即草鱼单养模式(G)、草鱼与鲢鱼混养模式(GS)和草鱼、鲢鱼(Hypophythalmichthys molitrix)和鲤鱼(Cyprinus carpio)混养模式(GSC),每个模式3个重复,共使用了9个围隔。混养鱼类的具体放养情况见表1。

表1 不同模式组草鱼放养规格和收获规格Table 1 Different models of grass carp stocking size and harvest Specifications
按3%草鱼体重的日投喂量,每天分4次投喂“海大”牌草鱼膨化配合饲料(福建海大饲料有限公司,漳州)。坚持“四定”和“四看”的投喂原则,同时根据草鱼的生长情况适当调整投喂量。每天19:00打开增氧机,到次日日出关闭增氧机。整个实验期间不换水,仅根据水深适当补充渗漏和蒸发水,保持水深在1.5m左右。
1.2 微生物样品采集
水样采集:用采水器在每个围隔的中心和四周分别采集等量水样,然后将同一围隔样品混合在一起。之后取适量的混合水样装于无菌的玻璃瓶中。所有样品低温保存迅速带回实验室,于4℃下保存待分析。
泥样采集:用采泥器在每个围隔的中心和四周分别采集表层底泥,然后将同一围隔样品混合在一起。所有样品低温保存迅速带回实验室,再将所取泥样在无菌的研钵中混匀,于4℃下保存待分析。
1.3 微生物计数
1.3.1 水体异养菌总数的测定 取1mL水样加入到9mL生理盐水(0.85%w/v NaCl)进行梯度稀释,稀释度为10-1~10-5,选3个合适稀释度吸取0.1mL进行平板涂布,每个稀释度做3个平行。将涂布的营养琼脂平板在28℃下培养48h,对单克隆总数在30~300的平板进行有效计数,并以计数平板上的单克隆总数作为0.1mL稀释样品中的异养菌总数。
1.3.2 底泥异养菌总数的测定 取10g混合泥样加入到90mL的生理盐水进行梯度稀释,加入1%吐温,置于摇床中振荡30min后进行10倍稀释涂布,方法同1.3.1。
1.3.3 吖啶橙直接镜检计数(AODC) 称取10g泥样,置于盛有含90mL1%Tween-80无颗粒水(经0.2 μm滤膜过滤)250mL的锥形瓶内,摇床振荡30min,再静置20min之后用无菌吸液器吸取定量10mL上清液。
取出10mL水样和底泥上清加入0.5mL36%的甲醛固定样品,取1mL的固定样滴加0.1%的吖啶橙0.1 mL,染色3min。将染色后的样品用孔径为0.2μm的whatman核孔滤膜过滤待镜检[14]。将滤膜置于载玻片上,滴一滴显微镜油,加盖玻片在荧光显微镜下计视野中发橙色或绿色荧光的菌体。一般取10个视野,每个视野30个左右为宜。根据视野面积和膜有效面积换算出样品中所含的细菌量[15]。
1.4 BIOLOG ECO微板反应
1.4.1 Biolog反应 Biolog生态板是一种多底物的96孔ELISA反应平板。除去3个对照孔外,共含有31中不同的单一碳源(分属6大类)和四唑染料,并设有3个重复。在进行ELISA反应时,各孔中的细菌利用碳底物而发生氧化还原作用。而孔中一旦有电子转移这种四唑染料就会变为紫色,细菌对不同碳底物的利用情况可用反应孔中的颜色变化来表示。通过对孔中颜色变化的光吸收值的测量,可获得较精确的信息[16]。
1.4.2 数据处理 Biolog微孔板的单孔颜色平均值(Average well color development,AWCD)计算采用Classen等[17]的方法。即将单孔在590和750nm的光密度值分别减去对照孔光密度值,然后再用每个对应孔590nm得值减去750nm的值,即为单孔实际颜色反应而测得的光密度值。其中数值小于0.06时按0处理[17-18]。
单孔平均光密度值计算按照Garland和Mills的方法[11,19],即 AWCD=∑(C590-750)/31,其中31 为Biolog微孔板上供试碳源的种类数。选取培养时间72 h的试验结果计算香侬多样性指数(H)和利用的底物碳源数(S)。Pi为单孔的相对光密度值,即Pi=(C590-750)/∑(C590-750);S为微生物群落利用的底物碳源数。经过转换计算后得到的单孔相对光密度值Pi用于主成分分析(PCA)。
1.4.3 细菌功能多样性分析 参考杨永华等[19]公式,利用Shannon指数、Shannon均度、Simpson指数、McIntosh指数和McIntosh均度对细菌多样性进行评价。具体计算如下:


其 中:Pi为 单 孔 相 对 光 密 度 值;Pi=C590-750/;ni是第i 孔相对吸光值;N 为吸光值总和[20]。
1.5 数据分析
利用SPSS13.0进行数据的统计分析和作图。所有数据用单因子方差分析(ANOVA)及Duncan多重比较进行分析处理,以P<0.05作为差异显著性水平。
2 结果
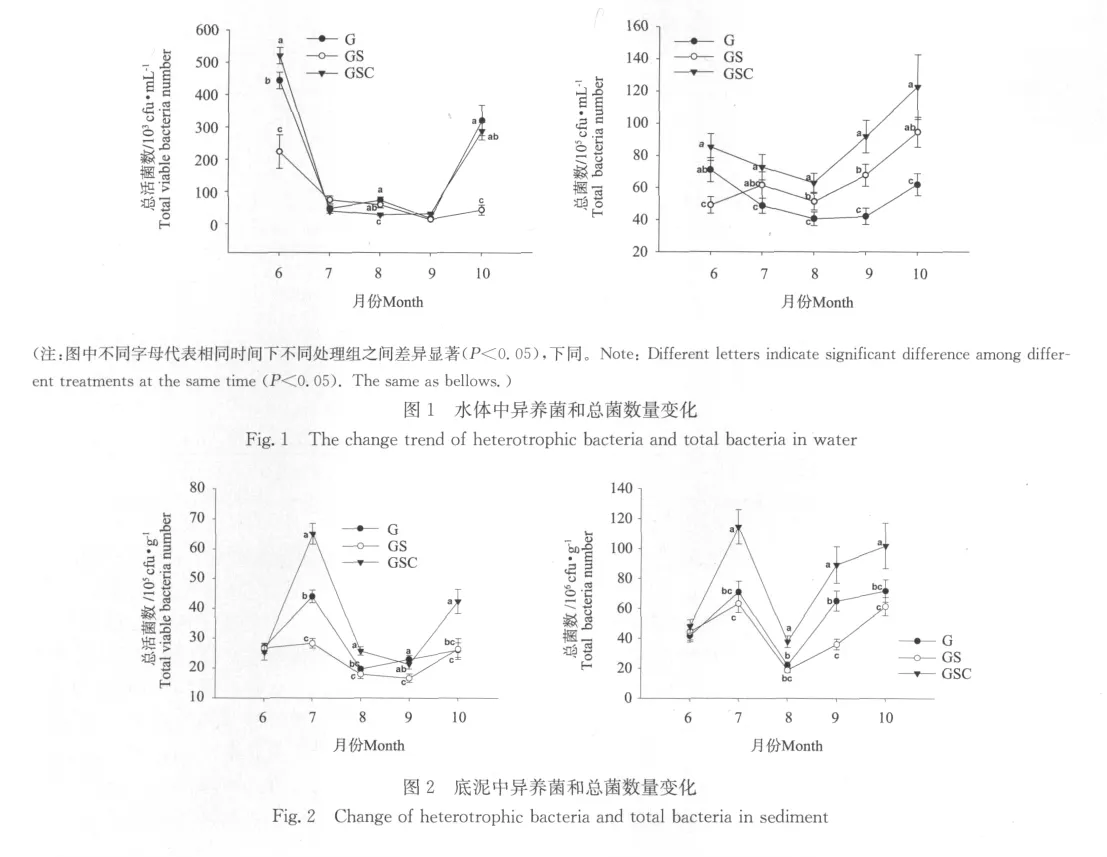
2.1 水体和底泥中异养菌和总菌数量变动
从图1可以看出,各模式的水体中异养菌和总菌数量在实验期间随时间变化呈现出相似的变化趋势,即总体上为先下降后上升。总体上,异养菌总数以6月为较高,而总菌数不同,表现为10月份较高,而7~9月则相对较低。其中,异养菌总数变动在(1.43±0.13)×104~(5.20±0.25)×105cfu/mL 之 间,总 菌 数 则变动 于(4.07±0.45)×106~(1.23±0.20)×107ind·mL-1之间。从整个养殖期间看,草鱼单养组(G)和草鱼-鲤鱼-鲢鱼三元混养组(GSC)异养菌总数差异不大(P>0.05),显著高于草鱼-鲤鱼二元混养组(GS)(P<0.05);总菌数则以三元混养模式(GSC)最高(P<0.05)。
总体上看,各模式底泥异养菌和总菌数变化趋势相似,二者均随时间变化在7月达到第一个峰值,之后在10月有所上升(见图2)。不过,底泥中异养菌总数在8和9月仍处于较低水平,而总菌数则从9月即开始回升。其中,异养菌总数变动于(1.67±0.14)×106~(6.50±0.35)×106cfu/g之间,其峰值时间与水体相比有所滞后,且变动幅度小于水体;底泥中总菌数变动于(1.87±0.15)×107~(1.15±1.24)×108cfu/g之间。总体上比较,在整个养殖期间,三元混养模式异养菌总数和总菌数均显著高于其它模式(P<0.05),平均为(3.95±0.26)×105cfu/g和(7.82±0.96)×107ind·g-1。可以看出,底泥中总菌数高于异养菌总数2个数量级。
2.2 水体和底泥中异养菌总数与理化因子相关性
实验期间,水体温度在20.50~28.50℃之间,底泥温度则变动于19.00~27.5之间总体上与不同季节的温度变化有关。水体中溶解氧在4.58~7.90mg/L之间,不同月份之间没有显著差异(P>0.05)。水体中无机氮变化于1.52~6.46mg/L之间,以6月份为最高(P<0.05),其余时间没有显著差异(P>0.05);底泥间隙水中无机氮则在4.42~5.88mg/L之间,不同月份之间没有显著差异(P>0.05)。水体和底泥间隙水磷酸盐分别变化于0.22~0.45和0.28~0.47μg/L之间,不同月份之间显著不差异(P>0.05)。水体变动于 2.74~6.77mg/L 之 间,以 6 月 份 为 最 高(P<0.05),底泥间隙水总有机碳则变动于2.49~6.55mg/L之间,以7月份为最高(P<0.05)。详见表2和3。
对不同月份水体和底泥异养菌总数变动与相关的理化因子变化进行了相关性分析,结果表明,水体中异养菌总数的变动与水体中磷酸盐和总有机碳的浓度相关显著(P<0.05),与水体中无机氮(DIN)浓度相关极显著(P<0.01),但与溶氧水平以及水温相关不显著(P>0.05);底泥中异养菌总数的变动也与底泥中磷酸盐和总有机碳(TOC)的浓度相关显著(P<0.05),与底泥中无机氮浓度则相关极显著(P<0.01),而与水温相关不显著(P>0.05)。

表2 水体中异养菌数量变化与理化因子相关性Table 2 Correlation coefficient between the number of total heterotrophic bacteria in water and physicochemical parameters

表3 底泥中异养菌数量变化与理化因子相关性Table 3 Correlation coefficient between the number of total heterotrophic bacteria in sediment and physicochemical parameters
2.3 不同模式细菌功能多样性
2.3.1 平均色度值变化(AWCD) 不同模式下的水体和底泥中细菌群落AWCD值在整个养殖期间呈现动态变化,总体变化趋势大体一致(见图4和5)。但不同模式之间随时间变化趋势有所差异。其中,6月份细菌群落AWCD值以单养模式(G)最高(P<0.05),其它2组差异不大(P>0.05);而8月份三元混养模式(GSC)AWCD值超过二元混养模式(GS),在10月份则显著高于其它2个模式(P<0.05)。AWCD值的大小代表了不同模式细菌对底物碳源利用能力上的差异,值越大表示代谢活力越强。从本研究结果可以看出,尽管实验起始时三元混养模式(GSC)细菌代谢活力较单养模式(G)差,但随着养殖时间的推移,三元混养模式(GSC)细菌代谢活力处于不断增加的趋势,养殖后期呈现出较高的代谢活力。二元混养模式(GS)变化与三元混养模式(GSC)有所不同。其水体中细菌群落AWCD值在前期与单养模式(G)差异不大(P>0.05),但后期要显著高于单养模式(G)(P<0.05),而底泥中细菌群落AWCD值在前期与三元混养模式(GSC)差异不大(P>0.05),在后期则显著低于其它2个处理(P<0.05)。

2.3.2 总体碳源利用情况 总体上看,各模式水体中细菌群落对碳源利用随月份变动不大,而底泥中细菌群落对碳源利用随月份呈现上升趋势(见图6)。不同模式之间比较,不论水体还是底泥中,单养模式(G)细菌群落在养殖前期碳源利用率最高(P<0.05),随着养殖时间的推移,三元混养模式(GSC)10月份细菌群落碳源利用率显著高于单养模式(P<0.05),这一动态趋势与AWCD值变化一致。

图6 水体和底泥细菌群落对碳源随月份利用情况Fig.6 The utilization of carbon source from water and sediment over month
2.3.3 对单类碳源利用情况 Biolog生态板所包含的31种单一碳源分属于6类碳源,即聚合物、糖类、羧酸类、酚类、胺类和氨基酸类。总体来说,各模式水体和底泥中细菌群落对碳源种类利用有选择性偏好,这种偏好随时间推移发生变化,但是水体细菌群落对碳源种类利用较底泥均匀。
水体中菌群在6月份倾向利用聚合物、酚类和氨基酸类碳源,而胺类利用较其它少,不同模式利用碳源种类比较,除羧酸外其余无显著差异;8月份对胺类和氨基酸类利用较多,3种模式只有利用糖类有差异(P<0.05);10月份倾向利用聚合物,3个模式在羧酸类、酚类和氨基酸类利用产生差异(P<0.05)。总体上,随着养殖时间的推移,3个模式细菌群落在碳源种 类利用差异越来越显著(见图7)。

图7 水体中细菌群落对六类碳源利用情况Fig.7 The utilization of six kinds of carbon source from water in Jun,Aug and Oct
底泥中细菌群落在6和8月偏好聚合物类,10月对各类碳源较上2个月均衡。同水体一样,随着时间推移3个模式利用碳源种类差异越来越显著(见图8)。
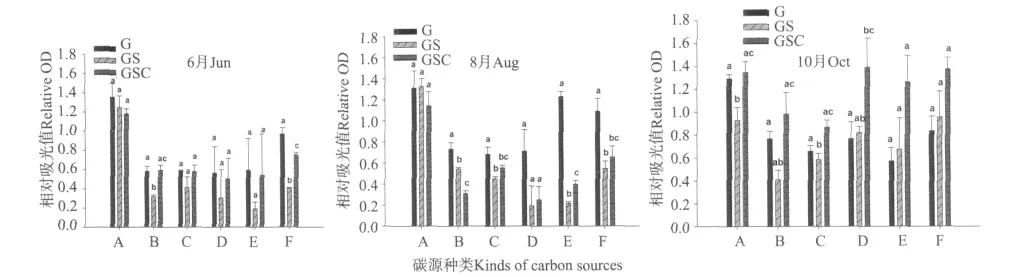
图8 底泥中细菌群落对六类碳源利用情况Fig.8 The utilization of six kinds of carbon source from sediment in Jun,Aug and Oct
2.3.4 环境细菌群落功能多样性分析 对水体中细菌群落不同模式间细菌群落功能多样性比较表明,实验起始时G模式Shannon指数显著高于其它模式(P<0.05),McIntosh 指数与 GS 模式有显著差异(P<0.05),与 GSC模式差异不大(P>0.05),Simpson指数三者之间无显著差异(P>0.05);实验结束时,GSC模式Shannon指数和McIntosh指数均高于其它组(P<0.05),而Simpson指数显著低于其它2个模式(P<0.05)(见表4)。
不同模式之间底泥中细菌群落的比较,起始时各模式3种指数均无明显差异(P>0.05),实验后期结果则与水体相似。可以看出,随养殖时间推移,GSC模式的细菌群落丰富度和多样性不断增加最终达到最高,而常见种的优势度较低(见表5)。

表4 实验起止水体的细菌群落功能多样性指标比较Table 4 Comparison of bacterial functional diversity between beginning and ending

表5 实验起止底泥的细菌群落功能多样性指标比较Table 5 Comparison of bacterial functional diversity between beginning and ending
2.3.5 主成分分析 对水体和底泥中细菌群落利用31种碳源情况进行了主成分分析(见图9和10)。可以看出,6月份水体中3个模式均在第4象限,且点离散程度较大;在8月份,G模式分布于第4象限,GS模式分布于第2象限,GSC模式在第1象限;在10月份,G模式与GS模式点分布彼此对调,GSC仍在第1象限。这一结果表明,实验初期3个模式水体细菌群落功能基本相似,实验中期之后功能产生了差异,并一直持续到养殖结束。
底泥中细菌群落功能分析表明,6月份G和GSC模式均在第2象限,GS模式在第1象限;在8月份,GS和GSC模式处于第2象限,G模式分布于第3象限;在10月份,G模式与GS模式点分布彼此对调,GSC仍在第1象限。可见,在实验初期,G和GSC模式细菌功能相似,实验中期GSC和GS模式相似,而实验后期三者之间差异均较大。

3 讨论
3.1 水体和底泥中异养菌和总菌数量变动
本研究表明,不同模式水体和底泥中异养菌和总菌数随养殖时间的延长均发生了不同程度的变动。总体比较,各个模式水体中异养菌和总菌数量变化趋势相似,异养菌总数以6月为较高,而总菌数不同,表现为10月较高,而7~9月则相对较低。底泥中异养菌和总菌数变动也呈现相似趋势,但其峰值变化从时间上要滞后于水体,具体表现为在7月出现峰值后迅速下降,其后变化趋势与水体异养菌和总菌趋势相一致。同时可以看出,水体中异养菌数量的波动要较底泥大,可能表明水体中异养菌数量对理化因子波动更为敏感,而水体中的总菌数变动幅度则要较异养菌小。养殖模式对环境中异养菌影响较大,3种模式环境中异养菌总数的水平有所差异。可以看出,三元混养模式水体中总菌数以及底泥中异养菌和总菌数,均要显著高于其它模式,这可能与该模式中3种鱼类生态习性互补所致的互利作用使得水体和底泥中有机质丰富且均匀,从而更有利于细菌的生长繁殖有关。
理化因子对于水体和底泥中异养菌和总菌数量具有重要的影响。黄凤莲在对滩涂海水种植-养殖系统微生物组成和数量变动的研究中发现,异养菌数与环境中DIN和磷酸盐浓度呈正相关[21],而刘国才等则发现,对虾围隔生态系浮游细菌和底泥细菌数量除了与有机碳浓度呈现显著相关性外,与温度也相关显著[22-23]。本研究与黄凤莲[21]研究结果相似,但与刘国才等[22-23]研究存在一定差异,即尽管环境中 DIN、TOC和磷酸盐浓度均显著影响异养菌数量,但与温度相关并不显著。分析其中原因,可能与两方面因素有关,一是研究期间水温处于草鱼养殖的适宜温度范围,温度可能不成为细菌群落生长繁殖的限制因子;二是与草鱼养殖生产的特点有关。众所周知,在以投喂配合饲料为主的草鱼集约化养殖生产中,随着鱼体的生长和饵料的大量投入,残饵和粪便在系统中逐渐积累,导致水体中营养盐水平以及积累的有机物浓度均不断增加,而环境中有机物和营养盐水平正是影响异养菌繁殖和生长的重要因素,从而导致有机物和营养盐水平对细菌群落的影响可能在一定程度上掩盖了温度作用。
3.2 不同模式细菌群落功能多样性对比
本研究以Biolog生态微板作为主要手段,对不同模式环境中的细菌群落功能多样性进行3个月的研究。总体来说,在整个养殖其间养殖环境细菌群落代谢功能呈现动态变化趋势,不同模式对底物碳源的利用数量和利用强度也是变化的。
平均色度值(AWCD值)可以代表细菌群落对底物碳源的平均代谢活力。从本研究结果看,实验起始时草鱼单养模式(G)水体和底泥细菌群落AWCD值要显著高于其它模式(P<0.05),而GS和GSC模式差别不大(P>0.05);实验中期三元模式(GSC)菌群代谢活力显著高于GS(P<0.05),略低于G模式;实验后期GSC模式菌群代谢活力则要显著高于G模式(P<0.05)。这可能由于实验起始时人工构建的由多种不同习性鱼类组成混养生态系统的还不够稳定,导致整个系统细菌群落的代谢活力也保持较低水平。而随着草鱼混养生态系统的逐渐成熟和稳定,三元混养系统的细菌群落代谢活力逐渐升高,并在后期显著高于单养和二元混养系统。
通过不同模式菌群对6类碳源的利用率情况以及Biolog生态微板上31种单一碳源利用的主成分分析(PCA)分析,可以看出,不论水体还是底泥细菌群落,对碳源利用均存在选择性偏好,而且这种偏好也随养殖时间和环境因子的变化而发生变化。从中可以推测,养殖期间细菌群落的主要类群一直处于不断演替和变化之中,而这些差异可能是由混养生态系统物质循环与生物群落间相互作用引起的。
通过Shannon指数、Simpson指数和McIntosh指数对不同模式中环境菌群代谢功能多样性差异进行了分析。其中,Shannon指数主要用来评价评价群落丰富度和均度,Simpson指数用来说明最常见种的优势度,而McIntosh指数则是基于群落多维空间上的多样性指数。水体中,实验起始时草鱼和鲢鱼混养模式的Shannon指数和McIntosh指数显著低于其它2组(P<0.05),而Simpson指数在不同模式下差异不显著(P>0.05)。但在实验结束时,GSC模式的Shannon指数和McIntosh指数明显高于其它2组(P<0.05),而Simpson指数则为最低(P<0.05)。这说明随着养殖时间的延长,GSC模式细菌群落丰富度和空间多样性不断升高。而养殖后期单养模式的Simpson指数最高(P<0.05),则表明常见种优势度随养殖时间的延长而不断增强,但菌群多样性并不高。分析其中原因,可能是由于草鱼、鲢鱼和鲤鱼混养在一起,不仅在生态位上可以互补,也充分利用了水体空间资源,从而对整个生态系统中细菌群落的组成与分布产生了较大的影响。
总体而言,将草鱼、鲤鱼和鲢鱼3种不同习性的鱼类按一定比例混养在一起,使其生态位上可以互补,也充分利用了水体空间资源。三元混养不仅显著提高了养殖系统的产量,降低了饲料系数,并提高了系统氮、磷利用率,获得较高的经济效益和生态效益[24],而且也使得系统中微生物的结构和功能得到优化,细菌群落的组成与代谢功能更趋于丰富化和多样化。这样,从微生物生态角度也表明了草鱼、鲢鱼和鲤鱼合理混养在理论上的合理性和实践上的优越性。
[1] 杨莺莺,李卓佳,梁晓华,等.芽胞杆菌对鱼池微生物群落代谢功能的影响 [J].微生物学杂志,2009,29(3):11-17.
[2] 刘国才,刘振奇.池塘底泥中细菌的初步研究 [J].水生生物学报,1992,16(3):285-286.
[3] Hagstorm A,Azam F,Anderson A,et al.Microbial loop in an oligtrophic pelagic marine ecosystem [J].Mar Ecol Prog Ser,1988,49:171-178.
[4] 杨红生,李德尚,董双林,等.中国对虾与罗非鱼施肥混养的基础研究 [J].中国水产科学,1998,5(2):35-39.
[5] 吴乃薇,边文翼,姚宏禄.主养青鱼池塘生态系统能量转换率的研究 [J].应用生态学报,1992,3(4):333-338.
[6] 申玉春,熊邦喜,王辉,等.虾-鱼-贝-藻养殖结构优化实验研究[J].水生生物学,2007,31(1):30-38.
[7] 田相利,李德尚,阎希翥,等.对虾池封闭式三元综合养殖的实验研究 [J].中国水产科学,1999,6(4):49-54.
[8] 张振东,王芳,董双林,等.草鱼、鲢鱼和凡纳滨对虾多元化养殖系统结构优化的研究 [J].中国海洋大学学报:自然科学版,2011,41(7/8):60-66.
[9] 张扬宗,谭玉君,欧阳海,等.中国池塘养鱼学 [M].北京:科学出版社,1986:13-15.
[10] Garland J L,Mills A L.Classification and characterization of heterotrophic microbial com-munities on the basis of patterns of community-level sole carbon source utilization[J].Appl Environ Microbial,1991,57:2351-2359.
[11] Choi K H,Dobbs F C .Comparison of two kinds of biolog microplates(GN and ECO)in their ability to distinguish among aquatic microbial communities[J].Journal of Microbiological Methods,1999,36(3):203-213.
[12] 袁翠霖,李卓佳,杨莺莺,等.芽孢杆菌制剂对养殖前期罗非鱼池塘微生物群落代谢功能的影响 [J].生态学杂志,2010,29(12):2464-2470.
[13] 李德尚,杨红生,王吉桥,等.一种池塘陆基实验围隔 [J].青岛海洋大学学报,1998,28(2):199-204.
[14] 张晓华.海洋微生物学 [M].青岛:中国海洋大学出版社,2007:294-296.
[15] Hobbie JE,Daley R J,Jasper S.Use of nuclepore filters for counting bacteria by fluorescence microscopy[J].Appl Environ Microbial,1977,33:1225-1228.
[16] 席劲瑛,胡洪营,钱易.B iolog方法在环境微生物群落研究中的应用 [J].微生物学报,2003,43(1):138-1411.
[17] Classen A T,Boyle S I,NaskinsK E,et al.Community-level physiological profiles of bacteria and fungi plate type and incubation temperature influences on contrasting soils[J].FEMS Microbial Ecol,2003,44:319-328.
[18] 王光华,刘俊杰,齐晓宁,等.Biolog和PCR-DGGE技术解析施肥对德黑土细菌群落结构和功能的影响 [J].生态学报,2008,28(1):220-226.
[19] 杨永华,姚健,华晓梅.农药污染对土壤微生物群落功能多样性的影响 [J].微生物学杂志,2000,20(2):23-25.
[20] Magurrar A E.Ecologcal diversity and its measurement[M].Princeton:Princeton University Press,1988.
[21] 黄凤莲.滩涂海水种植-养殖系统微生物修复研究 [D]:广州:中山大学,2005.
[22] 刘国才.对虾养殖围隔生态系浮游细菌的数量动态 [J].中国水产科学,1999,6(2):74-78.
[23] 刘国才.对虾综合养殖生态系底泥细菌的数量动态 [J].应用生态学报,2000,11(1):138-140.
[24] 宋颀,田相利,王芳,等.不同草鱼池塘混养系统结构优化的实验研究 [J].水生生物学报,2012,36(4):704-714.
