基于萘环仲胺类过渡金属配合物的制备及与DNA相互作用的光谱学研究
2012-10-13贾春满张春燕
贾春满,胡 琴,陈 达,张春燕,郭 肖,张 岐
(海南大学 材料与化工学院,海南 海口 570228;海南省精细化工重点实验室(海南大学))
基于萘环仲胺类过渡金属配合物的制备及与DNA相互作用的光谱学研究
贾春满,胡 琴,陈 达,张春燕,郭 肖,张 岐
(海南大学 材料与化工学院,海南 海口 570228;海南省精细化工重点实验室(海南大学))
合成了新型仲胺类配体L(N,N'-二萘基-1,2-乙二胺)及其四种过渡金属的硝酸盐配合物,利用红外、元素分析、摩尔电导、1H NMR等对其结构进行了表征,其结构式为[ML2NO3]NO3(M=CuII,CoII,NiII,ZnII),通过紫外、荧光光谱研究了该四种金属配合物与小牛胸腺DNA的相互作用,Cu-L,Co-L,Ni-L,Zn-L与 DNA的结合常数分别为:3.77×104,1.41×104,2.14×104和 1.30×104M-1,表明配合物与DNA的作用方式插入结合.
DNA;相互作用;配合物;过渡金属
过渡金属配合物因其具备性能优良的抗肿瘤药物的潜力,近年来作为DNA靶向化合物得到了较广泛研究[1-2].其中,希夫碱类过渡金属配合物在此领域研究最为深入[3-4].然而希夫碱在酸或碱性条件时稳定性较差,为了克服此类化合物的自身缺点,我们报道了将席夫碱还原为仲胺类并合成相应过渡金属配合物的方法,并研究其与DNA之间的相互作用及机理.此类配合物C-N之间单键可自由旋转,分子柔性得到提高,并且所形成的配合物在弱酸碱性条件下均比较稳定.
我们仲胺类过渡金属配合物的相关研究表明,此类配合物与DNA存在明显相互作用.例如我们前期制备的N,N’-二苯基-1,2-乙二胺配体[5]及其配合物,发现此类配体具备苯环的刚性平面的重要性,为了更进一步研究该刚性平面结构的配体及其配合物对DNA相互作用的影响,我们尝试增大该配体的刚性平面,制备配体(N,N′-二萘基-1,2-乙二胺)及它的过渡金属配合物,并初步研究这些配合物与DNA的相互作用.
1 实验部分
1.1 仪器与试剂
RF—540荧光分光光度计(上海精密科学仪器有限公司),UV—3400紫外分光光度计 (上海精密科学仪器有限公司),320-S pH计(梅特勒仪器有限公司),DDS-307精密型电导率仪(贵阳学通仪器仪表有限公司).小牛胸腺DNA(上海华美生物工程公司),三(羟甲基)氨基甲烷(Tris)(上海华美生物工程公司),溴化乙锭EB(上海国药集团化学试剂有限公司)
1.2 N,N′-二萘基-1,2-二胺(L)的合成及其配合物制备
向10mmol 1-萘甲醛甲醛的甲醇溶液中滴加10mmol乙二胺溶于10mL无水甲醇,室温条件下搅拌4小时,TLC监测反应完全后,硼氢化钾(40mmol)分多次加入到反应液中,60°C回流反应3小时,得到黄色液体.加蒸馏水洗涤2次,氯仿萃取3次,无水NaSO4干燥,旋转蒸发除去溶剂后,最终得到白色粉末(N,N′-二萘基-1,2-乙二胺)(L),δH(CDCl3):8.09-7.24(14H,m,Ar-H),4.26(4H,s,Ar-CH2),2.90(4H,s,N-CH2),1.71(2H,s,NH-),见图 1.Cu(II),Co(II),Ni(II)和 Zn(II)硝酸盐 (0.2mmol)溶于10mL甲醇,逐滴加入到N,N′-二萘基-1,2-乙二胺(0.1mmol)的甲醇(20mL)溶液中,室温下混合搅拌3小时.旋蒸出溶剂后得到固体,分别用无水乙醇抽滤洗涤三次,真空干燥过夜,产率:78—83%.

图1 N,N′-二萘基-1,2-乙二胺(L1)合成
2 结果与讨论
2.1 配合物的结构表征
四种配合物的IR峰相似,表明其可能有相似的结构.对于配合物的而言,NO3-分别出现特征吸收 峰 1510cm-1(ν1),1050cm-1(ν2)和 1310cm-1(ν4),最大吸收峰之差(|ν1-ν4|)大约为 190-210cm-1,表明硝酸根可能以双齿方式配位[6].另外,在1380cm-1(ν0)存在的游离硝酸根的特征吸收,与摩尔电导的测定结果相一致.Cu-L,Co-L,Ni-L,Zn-L四种配合物的FT-IR主要峰 (cm-1):3443,3424,3433,3434(νN-H);1511,1511,1494,1515(δN-H);1625,1625,1624,1628(νC-N);1131,1130,1130,1131(νC-N);1510,1508,1509,1510(ν1NO3);1301,1308,1302,1317(ν4NO3).Cu-L,Co-L,Ni-L,Zn-L元素分析,C%测定值:66.70,66.48,67.01,66.31;H%测定值:5.48,5.49,5.60,5.49;N%测定值9.62,9.68,9.60,9.64.
在298℃下,在DMSO中测得配合物Cu-L,Co-L,Ni-L,Zn-L摩尔电导数据为:92.3,86.2,88.5,83.6(Scm2mol-1),均在 83-92·S?cm2·mol-1范围内,表明四种金属配合物均为1:1电荷比[7],一个硝酸根参与配位在分子内界,另一硝酸根在配合物分子外界,与上述红外数据相一致.通过以上红外、核磁、元素分析可知,其分子式为[ML2NO3]NO3,该配合物的可能结构式如图2所示.
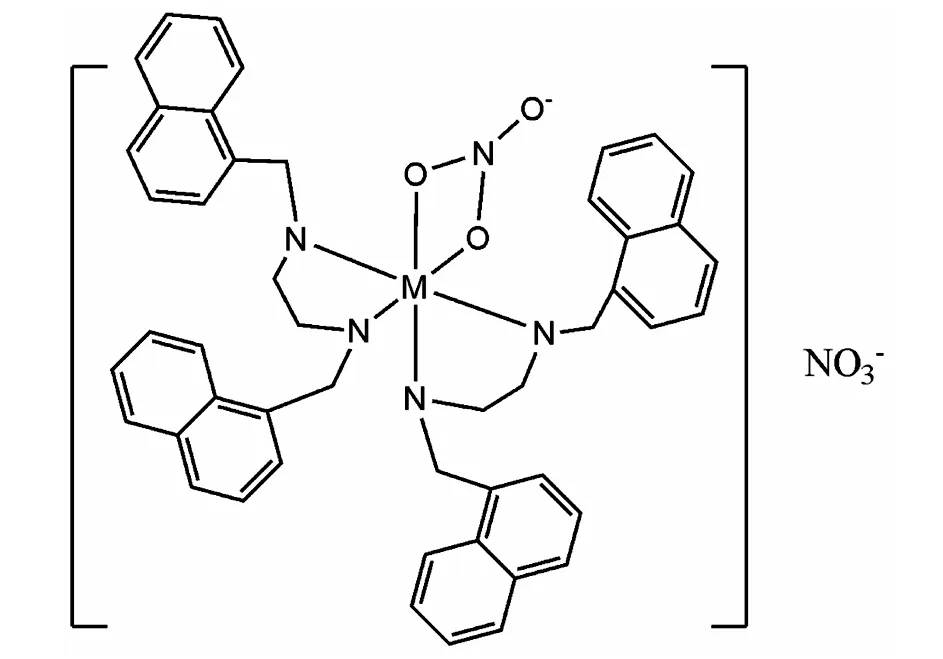
图2 配合物结构式(M为金属离子)
2.2 配合物与DNA相互作用的紫外光谱分析
如果配合物插入方式与DNA相互作用,则主要通过插入基团与碱基之间强烈的π-π堆积作用,因而可能使配合物在其吸收峰出现明显的减色效应[8].由图3可以看出,随着DNA浓度的增加,231nm左右的吸光度值呈现减色效应,对应CuL,CoL,NiL和ZnL分别减小23.3%,12.8%,12.2%,14.9%,对应282nm左右的吸光度值也呈现减小的趋势,分别减小32.3%,21.5%,22.2%,19.3%,这是因为可能这些配合物影响了DNA构象与结构的稳定,并与DNA采取插入的方式.

图3 DNA对配合物紫外光谱吸收影响(CDNA:a,0; b,2; c,4;d,6;e,8;f,10×10-6mol/L)
2.3 配合物与DNA相互作用的荧光光谱分析
利用荧光光谱法对金属配合物与EB进行了竞争性结合实验[9],从而更进一步明确配合物与DNA的结合模式.图4为配合物对DNA-EB体系荧光光谱的影响.随着金属配合物的加入,DNA-EB体系的相对荧光强度 (λex=540nm,λem=600nm)降低,这是因为配合物使EB从DNA中游离出来从而取代了DNA-EB体系中EB分子.根据经典Stern-Volmer方程,F0/F=1+K[M],[M]为猝灭剂的浓度,F0/F为(不存在猝灭剂)/(存在猝灭剂)时EB-DNA体系的荧光强度,由F0/F对[M]作图得到四条线性回归直线(见图4),表明配合物对DNA猝灭有只有一种方式,配合物的键合常数K值(Cu-L,Co-L,Ni-L和Zn-L)分别为3.77×104,1.41×104,2.14×104和1.30×104M-1.该类配合物的键合常数高于我们前期报道相似配合物的论文数据[5],表明萘环的插入作用能力可能比苯环更强.
3 结论
通过合成且表征了N,N'-二萘基-1,2-乙二胺(L)和它的 Cu(II),Ni(II),Zn(II),Co(II)配合物.利用紫外、荧光光谱研究配合物与DNA的相互作用,结果表明金属配合物与DNA结合且可以淬灭DNA-EB系统的荧光强度,与DNA相互作用方式为插入模式.萘环的插入作用能力比苯环更强,其原因可能是由于配合物插入平面的面积与插入强度成正比,并且萘环相对于苯环的增大的面积仍在同一平面内而使配合物与DNA的作用得到增强.
〔1〕DENG W G,ZHU Y,MONTERO A,et al.Quantitative analysis of binding of transcription factor complex to biotinylated DNA probe by a streptavidin-agarose pulldown assay [J].Anal Biochem,2003,323(1):12-8.
〔2〕MARUYAMA K,MISHIMA Y,MINAGAWA K,et al.DNA sensor with a dipyridophenazine complex of osmium(lI)as an electrochemical probe[J].Anal Chem,2002,74(15):3698-703.
〔3〕BARTON J K,BASILE L A,DANISHEFSKY A,et al.Chiral Probes for the Handedness of DNA Helices-Enantiomers of Tris(4,7-Diphenylphenanthroline)Ruthenium(Ii)[J].P Natl Acad Sci-Biol,1984,81(7):1961-5.
〔4〕HASTINGS A F,OTTING G,FOLMER R H,et al.Interaction of the replication terminator protein of Bacillus subtilis with DNA probed by NMR spectroscopy [J].Biochem Biophys Res Commun,2005,335(2):361-6.
〔5〕WU S S,YUAN W B,WANG H Y,et al.Synthesis,crystal structure and interaction with DNA and HSA of(N,N'-dibenzylethane-1,2-diamine)transition metal complexes[J].J Inorg Biochem,2008,102(11):2026-34.
〔6〕NAKAMOTO K.Infrared and Raman Spectra ofInorganic and Coordination Compounds[M].New York:Wiley,1986.
〔7〕GEARY W J.THE USE OF CONDUCTIVITY MEASUREMENTS IN ORGANIC SOLVENTS FOR THE CHARACTERISATION OF COORDINATION COMPOUNDS[J].Coordinntion Chemistry Reviews,1971,7(7):81-122.
〔8〕TAN L F,LIU X H,CHAO H,et al.Synthesis,DNA-binding and photocleavage studies of ruthenium (II)complex with 2-(3'-phenoxyphenyl)imidazo [4,5-f][1,10]phenanthroline[J].J Inorg Biochem,2007,101(1):56-63.
〔9〕CHEN W,TURRO N J,TOMALIA D A.Using ethidium bromide to probe the interactions between DNA and dendrimers [J].Langmuir,2000,16(1):15-9.
O64;Q523
A
1673-260X(2012)02-0015-03
