不带电荷极性氨基酸对兔肝中碱性磷酸酶活性的影响
2012-10-10张艳英关学敏
张艳英,关学敏
(河北科技师范学院动物科技学院,河北省预防兽医学重点实验室,河北秦皇岛,066600)
碱性磷酸酶(alkalinity phosphoric简称AP)是一种能催化多种磷酸脂类化合物并能水解释放无机磷的酶,广泛存在于动物血液和各种器官内,在骨骼形成以及脂肪合成过程中起重要作用,己作为动物生理活动和疾病诊断的一项重要指标[1],如当鸡发生佝偻症时血清的碱性磷酸酶活性异常升高[2]。它还是一种底物专一性较低的磷酸单脂酶,在生物体内直接参与了磷酸基团的转移和代谢过程,维持体内适宜的钙磷比例,并且在脊椎动物的骨化过程中发挥了重要作用[3,4]。为了满足生产实践上的需要,国内以鸡组织为材料来分离纯化AP并对其性质进行分析的研究工作即已有很多[5,6],笔者在此基础上进一步研究几种不带电荷极性氨基酸对兔肝中AP活性的影响。
1 材料与方法
1.1 试验材料及试剂
1.1.1 试验器材 冷冻离心机(型号GL-20G-Ⅱ,购自上海安亭科学仪器厂),722分光光度计(型号ST-20606010601,购自上海精密仪器有限公司)。
1.1.2 试验试剂及其配制 新鲜兔肝(河北科技师范学院动物科技学院试验室提供),0.5 mol/L醋酸镁溶液,0.1 mol/L 醋酸钠溶液,0.01 mol/L 醋酸镁-0.01 mol/L 醋酸钠溶液,Tris-HCl pH 8.8 缓冲液,酚标准溶液,40 mmol/L底物溶液,酶液:D管稀释5倍,0.5 mol/L氢氧化钠溶液,质量浓度为3 g/L的4-氨基安替比林(AAP)溶液,质量浓度为5 g/L的铁氰化钾溶液,Folin-酚试剂甲,Folin-酚试剂乙,10 mmol/L的甘氨酸、苏氨酸、半胱氨酸、天冬酰胺和丝氨酸。
标准蛋白质溶液:取结晶牛血清白蛋白溶于蒸馏水,质量浓度为250 mg/L。
1.2 试验方法
1.2.1 AP的分离纯化 按照生物化学中的有机溶剂分级沉淀法进行。以下操作均在4~10℃进行。
①称取新鲜兔肝(清除结缔组织)2 g,剪碎后,置于玻璃匀浆器中,加入2.0 mL 0.01 mol/L醋酸镁-0.01 mol/L醋酸钠溶液,充分磨成匀浆后,将匀浆液转移到离心管中,用4.0 mL上述溶液分2次冲洗匀浆管,并倒入离心管中,混匀,加2.0 mL正丁醇,用玻璃棒充分搅拌约2 min,然后在室内放置20 min后,滤纸过滤,滤液置离心管中,于滤液中加入等体积冷丙酮,立即混匀后离心5 min(2 000 r/min),弃上清液,向沉淀中加入4.0 mL 0.5 mol/L醋酸镁溶液,用玻璃棒充分搅拌使其溶解。
②量悬液体积,并计算使乙醇终体积分数至0.30需要加入的体积分数为0.95冰乙醇的量。按计算量加入乙醇,混匀,立即离心5 min(2 000 r/min),量取上清液体积,倒入另一离心管中,弃去沉淀。向上清液中加入体积分数为0.95的冰乙醇,使乙醇终体积分数达0.60,混匀后立即离心5 min(2 500 r/min),弃上清液。向沉淀中加入4.0 mL 0.01 mol/L醋酸镁-0.01 mol/L醋酸钠溶液,充分搅拌,使其溶解。
③重复②操作,向悬浮液中加入冷乙醇(体积分数为0.95),使乙醇终体积分数达0.30,混匀后立即离心5 min(2 000 r/min),计算上清液体积,倒入另一离心管中,弃去沉淀,向上清液中加入体积分数为0.95的冷乙醇,使乙醇终体积分数达0.60,混匀后立即离心5 min(2 500 r/min),弃上清液,沉淀用3.0 mL 0.5 mol/L醋酸镁充分溶解,记录体积,此为C1液。吸取C1液0.2 mL置于编号为C1的试管中,加入3.8 mL Tris缓冲液(pH 8.8),供测酶活性用。
④向上述剩余悬浮液中逐滴加入冷丙酮,使丙酮终体积分数达0.33,混匀后离心5 min(2 000 r/min),弃去沉淀。量取上清液体积后转移至另一离心管中,再缓缓加入冷丙酮,使丙酮终体积分数达到0.50,混匀后立即离心5 min(4 000 r/min)弃上清液,沉淀为部分纯化的AP。像此沉淀中加入4.0 mL Tris pH 8.8缓冲液使沉淀溶解,再离心5 min(2 000 r/min)将上清液倒入试管中,记录体积,弃去沉淀。上清液即为部分纯化的酶液,此为D1液。吸取0.2 mL D1液置于编号为D1的试管中,加入0.8 mL Tris缓冲液(pH 8.8),供测酶活性用。
⑤再称取另一只兔的新鲜兔肝2 g,进行以上①~④的步骤,得到C2,D2液,供测酶活性用。
1.2.2 AP的活性测定 按照金氏法进行,并做适当改进。
取6支试管,按表1进行。
充分摇匀,室温放置10 min,于波长510 nm处比色测定。以下式计算每毫升酶液的酶活性单位数。
酶活性单位数=(样品OD510/对照OD510)×酚标准溶液的质量浓度×1/(0.1×稀释倍数)
其中,酶活性单位数的单位:mL;酚标准溶液的质量浓度的单位:g/L。
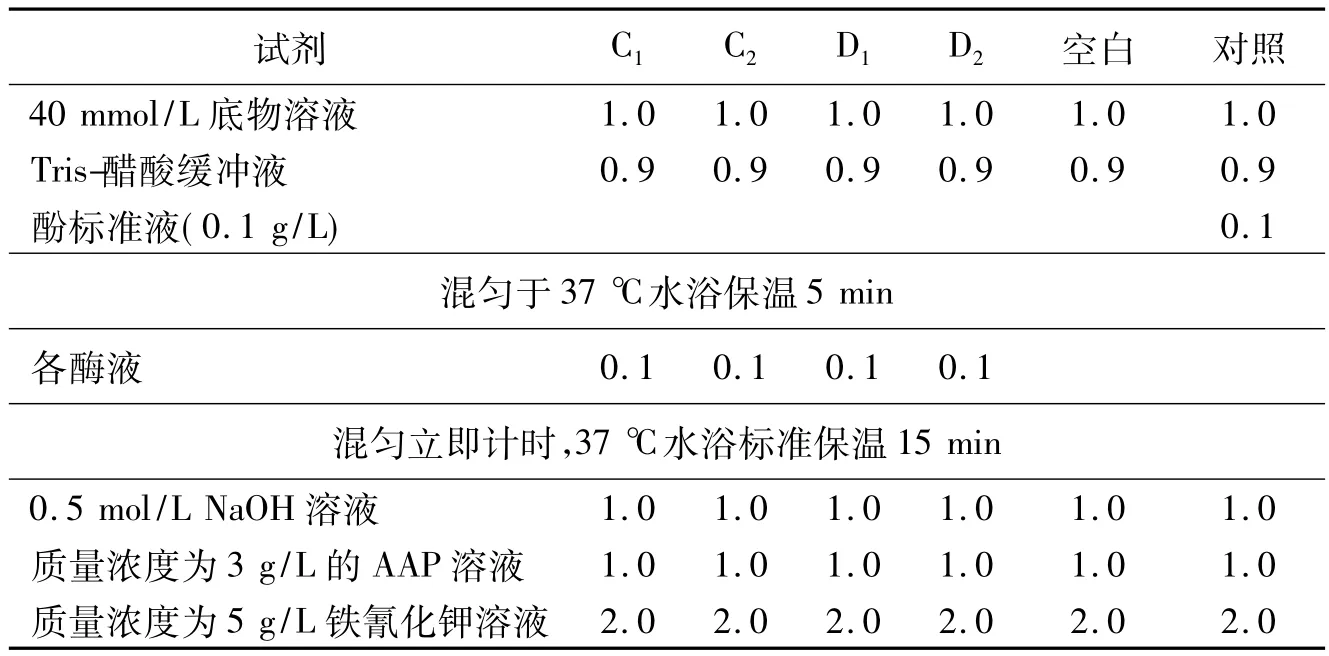
表1 AP的活性测定 mL
1.2.3 AP的含量测定及比活性计算 按Folin-酚法进行,并做适当的改进。
①标准曲线的绘制 当加入Folin-酚试剂乙时,边加边摇,迅速混匀,室温下放置30 min,以1号管为空白对照(表2),于650 nm处比色。记录数据,以标准蛋白含量为横坐标,光密度为纵坐标,绘制标准曲线。
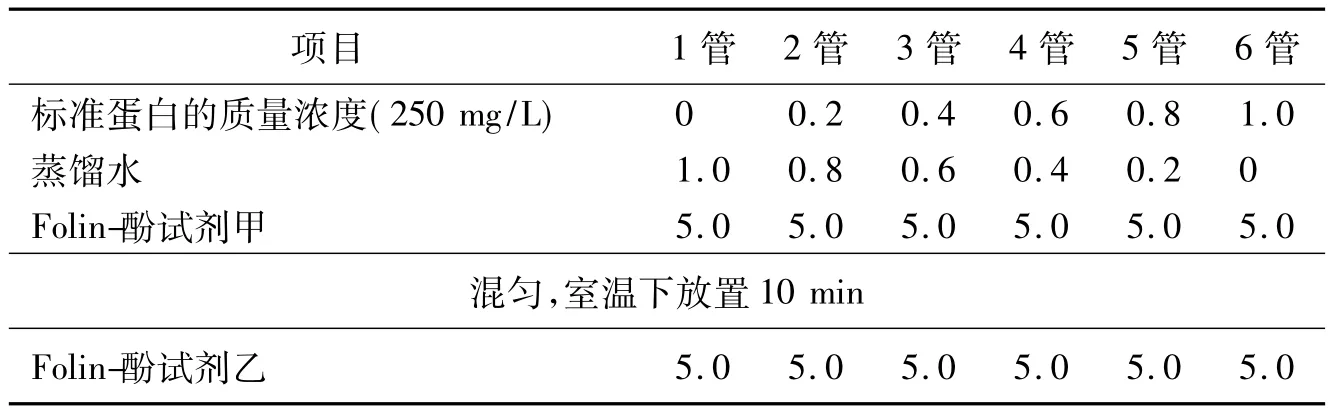
表2 标准曲线的绘制
②样品测定 于2支洁净干燥的试管中,分别加入待测样品各1 mL,加试剂甲、乙及比色操作步骤与①方法相同。
由待测样品所得OD值,查标准曲线,求得AP含量,再乘以稀释倍数,即可获得样品的AP含量。
③比活性计算
AP的比活性=每毫升样品AP活性单位数/每毫升样品蛋白质质量(mg)
1.2.4 AP的最适温度的测定 调节恒温水浴锅,设置不同温度,按上述方法测定酶活力后求出最适温度。
1.2.5 AP的最适pH值的测定 在最适温度(上一步已测出)条件下,在Tris-醋酸缓冲液的不同pH值下,按上述方法测定酶活力及比活力后求出最适pH值。
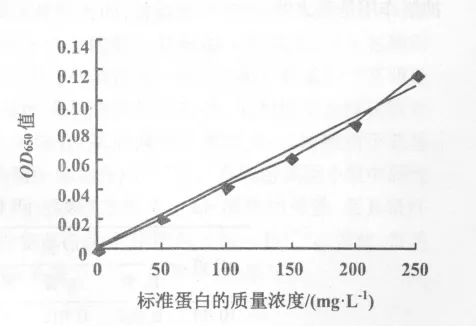
图1 标准蛋白与OD值的标准曲线
1.2.6 不带电荷极性氨基酸对AP活性的影响 在反应体系中分别测定相同浓度(10 mmol/L)下甘氨酸、丝氨酸、苏氨酸、半胱氨酸、天冬酰胺对AP的影响,按上述酶活性的测定方法分别测定其活性。
2 试验结果
2.1 AP 的含量
2.1.1 蛋白浓度标准曲线 由表2数据根据试验方法1.2.3部分中的表2和1.2.3部分中的步骤②计算得出数据并绘图(图1)。
2.1.2 样品中AP含量的测定 根据图1所得蛋白的质量浓度标准曲线计算得出样品蛋白的质量浓度(表3)。

表3 样品蛋白的质量浓度
2.2 AP的最适温度
根据试验方法中 1.2.2 和 1.2.3 的步骤③,得到各个温度下的AP活力及比活力(表4)。由表4作图2。
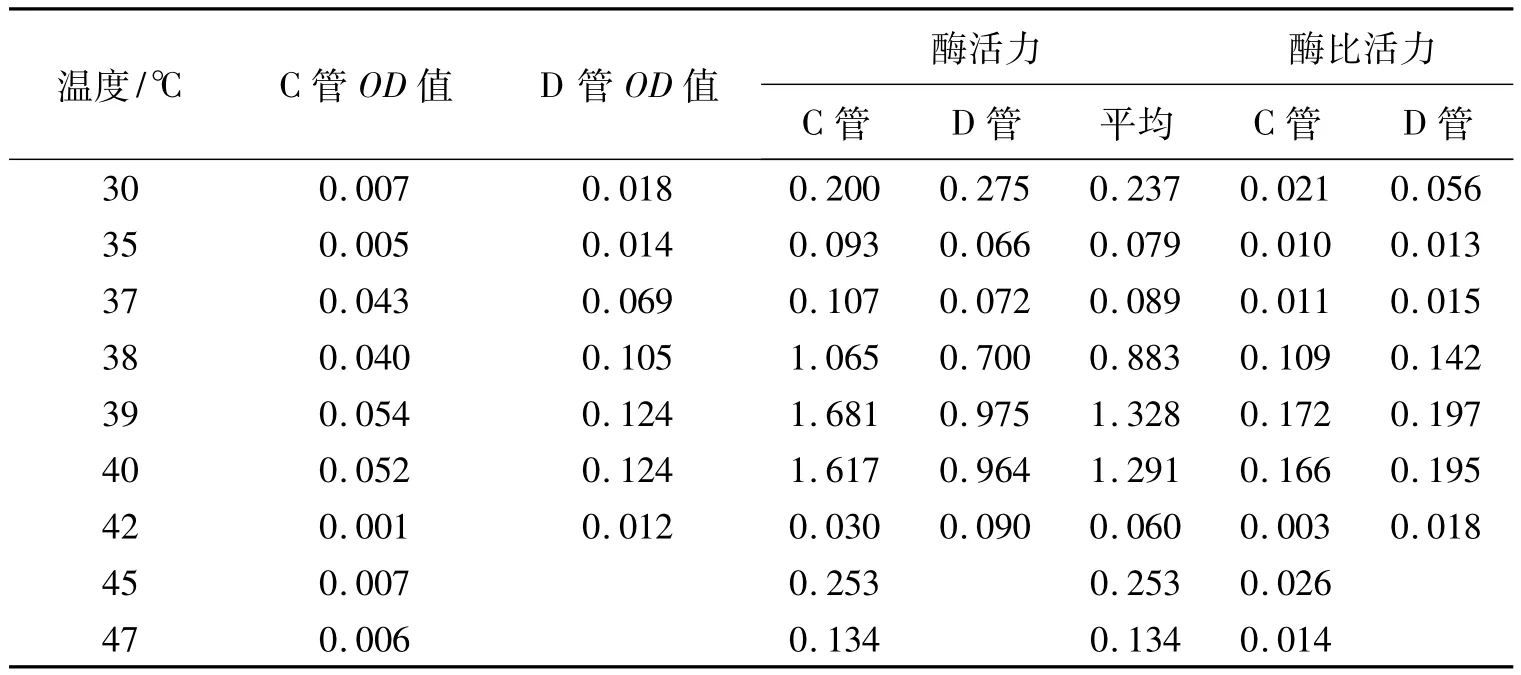
表4 温度与酶活力的关系
从图表中可以看出,当温度升高或降低时酶的活性也随之变化,AP的最适温度是39℃,而兔子的正常体温在38.5~39.5℃之间,试验结果也在其范围之内。但是试验中存在一定误差,所以图像不是规则的抛物线。
2.3 AP的最适pH值
在最适温度下根据试验方法1.2.5和1.2.3的步骤③,得到各个pH值下的AP活力及比活力(表5)。
由表5作pH值与酶活力的关系曲线(图3)。从图中可以看出,当pH值升高或降低时酶的活性也随之变化,碱性磷酸酶的最适pH值是9.84。
2.4 测定不带电荷极性氨基酸对AP活性的影响
根据试验方法1.2.6得到表6数据,由处理数据绘制图4。通过测定相同浓度下不同氨基酸对AP的抑制作用,可见天冬氨酸和半胱酰胺的抑制作用是最大的。

图2 温度与平均酶活力的曲线关系
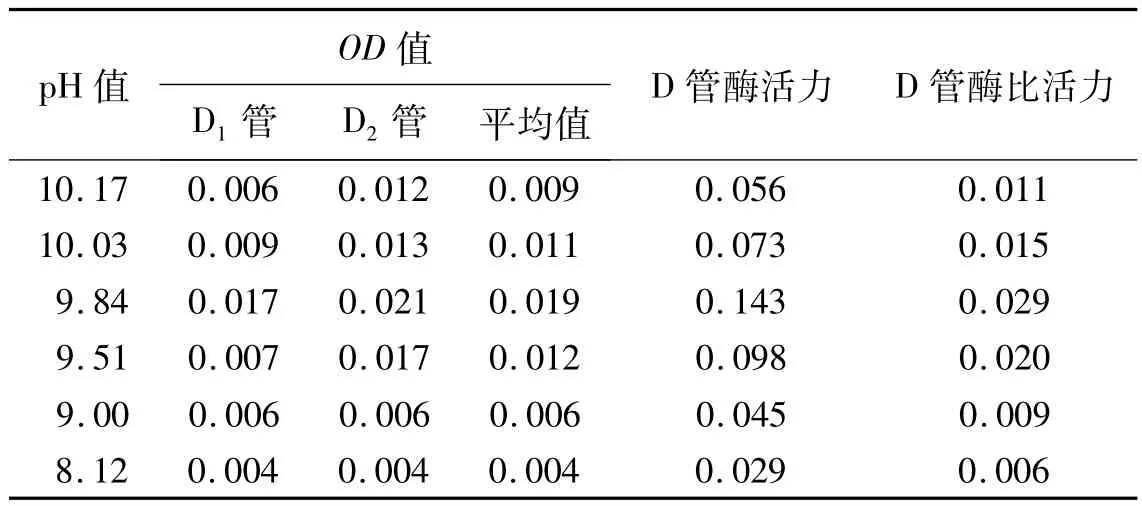
表5 pH值与酶活力的关系
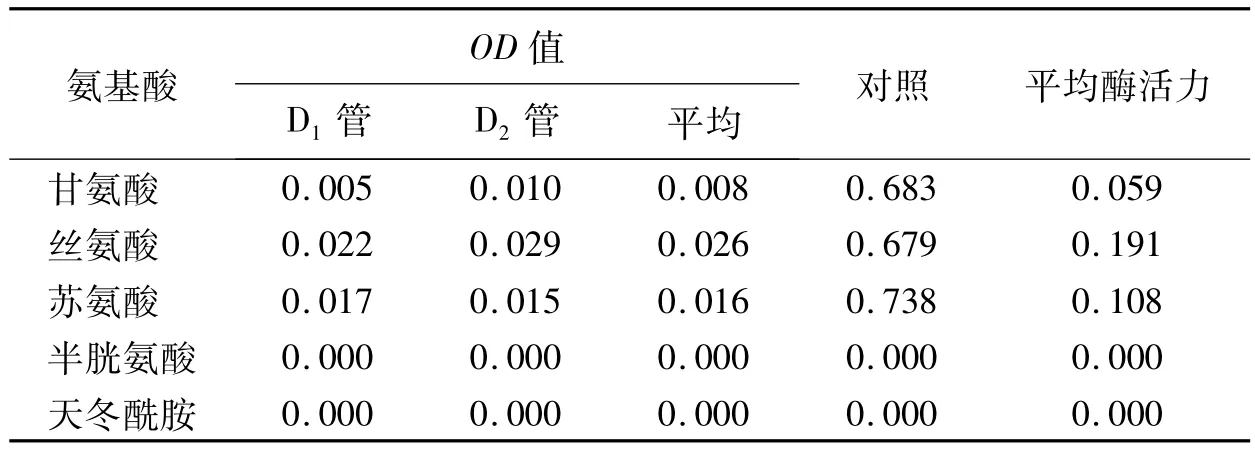
表6 不带电荷极性氨基酸与酶活性的关系
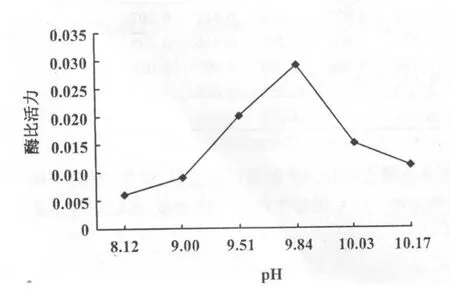
图3 酶活力与pH值曲线

图4 不带电荷极性氨基酸与酶活力的关系
3 讨 论
从AP含量试验和AP最适温度、最适pH值试验中可见已经分离纯化到较为纯净的AP。
AP的酶学特性因动物种属不同而异,本次试验结果表明,兔肝中AP的最适温度和最适pH值分别为39℃和9.84。与其他动物来源的AP有一些差异,白蜡虫(雌成虫)37℃,8.5[7];三黄鸡(肝)40℃,10.5[8];黑眉锦蛇(小肠)36 ℃,9.5[9]。
在最适温度和最适pH条件下,相同浓度的甘氨酸、丝氨酸、苏氨酸、半胱氨酸、天冬酰胺对AP活性的影响试验中可知,半胱氨酸和天冬酰胺对AP的抑制作用是最大的,甘氨酸的抑制作用相对较小,苏氨酸的抑制作用最小,其具体的抑制作用表现为:半胱氨酸>天冬酰胺>甘氨酸>苏氨酸,而丝氨酸则表现有略微的激活作用。一般说来,氨基酸对AP的抑制具有立体异构专一性,只有L-氨基酸才有明显的抑制作用[10,11]。在测活体系的pH为10的条件下,氨基酸羧基解离带负电荷,可与酶活性部位附近的带正电荷的基团可逆结合,而阻碍了底物与酶活性中心的结合,从而抑制了酶活力;也可能由于氨基酸的侧链基团与酶的结合,导致酶分子构象的变化而影响酶的催化作用[11~13]。在同组试验小组中研究不同结构的氨基酸对于AP有不同的抑制作用,表明非极性疏水氨基酸中L-Iie的作用最强,而具极性的中性氨基酸作用最大的是L-Cys,而L-His是酸性和碱性氨基酸抑制作用最大的一种[14]。因此,氨基酸对AP抑制作用不仅与其侧链的理化性质有关,还与特殊的基团有关,如苯环、巯基等。
[1]唐海东,路兴中.猪血清碱性磷酸酶(Akp)多态型的研究初报[J].上海农学院学报,1990,8(3):183-186.
[2]何谓霞,张晓雷,刘梵梵,等.试验性佝偻症对鸡血清、肠、肝、肾、骨中碱性磷酸酶活性的影响[J].畜牧兽医学报,1987,18(2):99-103.
[3]耿芳宋,修波,王秀丽,等.小牛肠碱性磷酸酶激活与抑制的动力学观察[J].青岛医学院学报,1995,31(3):191-194.
[4]陈定福.长吻鮠碱性磷酸酶的动力学研究[J].水生生物学报,1995,19(4):338-343.
[5]欧阳红生,汪玉松.鸡骨、肝和肠硷性磷酸酶的提纯和性质[J].兽医大学学报,1988,8(2):157-162.
[6]高士争,汪玉松,崔仲才,等.蛋鸡输卵管碱性磷酸酶的提纯和性质[J].兽医大学学报,1990,10(3):264-268.
[7]赵欣平,张久源,杨守忠,等.白蜡虫碱性磷酸酶功能基团的研究[J].昆虫学报,2001,44(3):257-262.
[8]赵赣,钱芳,孙永学,等.鸡肝碱性磷酸酶的分离纯化及其部分性质的研究[J].上海交大学学报:农业科学版,2003,21(3):194-198.
[9]刘晓雯,刘克武,闵丽娥,等.黑眉锦蛇小肠碱性磷酸酶的分离纯化及其部分性质研究[J].四川大学学报:自然科学版,2001,38(5):732-737.
[10]CHEN Q X,ZHANG W,ZHENG W Z,et al.Kinetics of inhibition of alkaline Phosphatase from green crab(Scylla serrata)by Bromosuccinimide[J].Protein Chem,1996,15(4):345-350.
[11]HOYLAERTS M F,MANES T,MILLAN J L.Molecular mechanism of uncompetitive inhibition of human placental andgerm cell alkaline phosphatase[J].Biochem,1992,286:23-28.
[12]FISHMAN W H.On the importance of being stereo specific[J].Clinica Chimica Acta,1989,186(2):129-135.
[13]耿芳宋,修波,王秀丽,等.小牛肠碱性磷酸酶激活与抑制的动力学观察[J].青岛医学院学报,1995,31(3):191-194.
[14]林丽蓉,廖金花,陈清西.氨基酸对鲍鱼碱性磷酸酶活力的影响[J].厦门大学学报:自然科学版,2004,43(增刊):8-11.
