脑恶性胶质瘤术后适形放疗联合不同形式化疗的临床观察
2012-10-08王跃伟刘建波李会荣步星耀
王跃伟,刘建波#,李会荣,步星耀
1)河南省人民医院放疗科 郑州 450003
2)河南省人民医院神经外科 郑州 450003
恶性胶质瘤因其生物学行为呈浸润性生长,手术难以达到根治性切除,且生长迅速,常侵犯脑的重要解剖和功能区域,故预后极差[1]。目前其治疗多采用显微手术切除、术后辅以放疗或化疗的方法。近年来,术后同步放化疗常用于恶性胶质瘤的治疗,但有关不同化疗形式疗效及安全性的研究较少。作者收集了河南省人民医院2003年2月至2006年10月术后病理证实为恶性胶质瘤的有完整病历资料的68例患者的病历,分析脑恶性胶质瘤术后同步放化疗的效果,现总结报道如下。
1 对象与方法
1.1 研究对象 病例入选标准:①年龄≥20岁。②脑肿瘤明确诊断后即行显微镜下肿瘤全切手术,术后组织病理学证实为胶质瘤。③心、肺、肝、肾等重要脏器功能基本正常,HGB≥100 g/L,WBC≥4×109L-1,PLT≥100 ×109L-1。④术后无严重手术并发症,包括术后颅内血肿、严重颅内感染等。⑤非妊娠期或哺乳期妇女,Karnofsky生活质量评分(karnofsky performance scale,KPS)≥60。⑥在该院神经外科接受手术治疗,有完整的病案记录和随访结果。共收集68例患者,其中男32例,女36例,年龄21~65岁,中位年龄41岁。肿瘤位于额叶21例,颞叶25例,顶叶13例,枕叶9例。所有患者均为首次就诊,显微镜下全切肿瘤,且尽量保持瘤腔的圆锥形态及可靠的瘤腔封闭。术后病理示WHOⅢ级(间变性星型细胞瘤)47例,Ⅳ级(多形性胶质母细胞瘤)21例。
1.2 病例分组和治疗方案
依据患者及家属的要求、在知情同意的情况下,分为术后单纯放疗(radiotherapy,RT)21例,术后尼莫司汀(nimustine,ACNU)间质化疗联合放疗(ACNU+RT)24例,术后替莫唑胺(temozolomide,TMZ)化疗同步放疗(TMZ+RT)23例。3组性别(χ2=0.621,P=0.731)、年龄(χ2=0.843,P=0.467)和肿瘤病理分级(χ2=2.131,P=0.386)间比较差异无统计学意义。
RT组:在手术伤口愈合、血象正常时开始选用6MV-X线进行三维适形放疗。靶区的确定参考术前及术后MRI(平扫+增强),临床靶区(clinical tumor volume,CTV) 为肉眼肿瘤区(cross tumor volume,GTV)+周围水肿区 +外放2.0~3.0 cm,计划靶区(planning tumor volume,PTV)为 CTV+外放0.3 ~0.5 cm。主要考虑摆位的误差及患者的移动等。照射剂量为(50~60)Gy/(25~30)次,5~6周。
ACNU+RT组:患者术中安置化疗泵,将Ommaya囊的输出端埋入瘤腔中,Ommaya囊埋植于皮下。于术后伤口愈合开始应用ACNU化疗,并应用200 g/L甘露醇125 mL加地塞米松5 mg以开放血脑屏障和减轻化放疗反应。化疗囊内缓慢注入2 mL(5 mg)ACNU,严密观察有无不良反应,连用3 d。术后第2、6、10、14周分别化疗1个疗程,化疗的同时给予RT。
TMZ+RT组:RT期间同步TMZ[75 mg/(m2·d)]口服化疗;RT后2周开始序贯巩固性辅助化疗,给予 TMZ 150~200 mg/(m2·d),睡前口服,连用5 d,每28 d为一疗程,维持4~6个周期化疗。
1.3 疗效评价和不良反应观察 各组患者均自术后1周内复查头颅CT或MRI及血常规,以了解患者手术后恢复及肿瘤复发情况。以后每周进行一次血常规检查,每隔4周检查肝、肾功能及常规体检,以评价药物毒性和患者耐受性,进行临床评价,以便调整用药,直至给药结束为止。每4~6周复查头颅CT或者增强MRI检查以判定肿瘤生长情况。不良反应以主观症状和客观体征评价为主,按WHO标准分为0~Ⅳ度。
1.4 统计学处理 采用SPSS 17.0进行分析,中位存活时间以M(P25~P75)表示。采用Kaplan-Meier方法绘制生存曲线,采用Log-rank检验对3组生存曲线进行检验,检验水准α=0.05。
2 结果
2.1 3组患者疗效比较 3组存活率及中位生存时间见表1,生存曲线见图1。RT组与TMZ+RT组和ACNU+RT组相比的生存曲线比较,差异有统计学意义(=8.313 和 8.825,P=0.003 和 0.012),后2组生存曲线差异无统计学(=0.047,P=0.915);ACNU+RT组和TMZ+RT组的中位生存时间长于RT组。
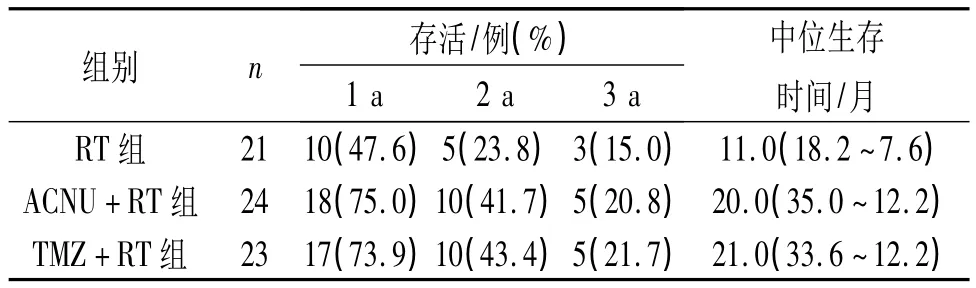
表1 3组患者疗效比较

图1 3组患者生存曲线图
2.2 不良反应 全部患者手术后无严重并发症,治疗期间未发现严重不良反应,无因不良反应而死亡的病例,亦无因不能耐受而中途退出治疗者。3组最常见的并发症均为头痛、发热、呕吐等,经采用脱水剂、止吐药物及其他对症治疗后症状迅速缓解。3组患者治疗期间多数出现不同程度的白细胞减少,RT、ACNU+RT和TMZ+RT组Ⅲ和Ⅳ度骨髓抑制发生率分别为 17.4%(4 例)、16.7%(4 例)、23.8%(5 例),差异无统计学意义 (χ2=0.186,P=0.876),经应用升白剂治疗后白细胞均在短期内恢复正常,继续完成治疗。
3 讨论
肿瘤细胞的残存是脑恶性胶质瘤复发的根本原因。放、化疗联合同步进行可抑制残存肿瘤细胞的放射性亚致死损伤及潜在致死损伤的修复,具有内在的放疗增敏作用[2-3]。对术后单纯放疗复发再手术的肿瘤组织观察发现,肿瘤组织多为灰白色,质韧,血管减少,水肿明显,故对放疗后患者实行化疗将影响药物到达肿瘤组织内的量和浓度,减弱治疗效果。直接手术后患者CT、MRI示瘤腔周围强化明显,新生毛细血管丰富,残留细胞增殖活跃,此时给予化疗,可充分发挥药物的作用。该研究中术后接受同步放化疗患者的疗效显著好于术后单纯放疗组,且不良副反应并未显著增加。证明恶性胶质瘤术后宜给予同步放化疗。
由于脑胶质瘤一般仅在原发部位生长或复发,间质内化疗避开了血脑屏障,局部化疗药物直接与肿瘤细胞接触,药物浓度较高,作用更佳。Bodell等[4]证实间质化疗时,脑组织局部药物浓度可达到静脉给药时的13倍以上,药物在局部组织渗透可达2.5 cm。该研究采用的间质化疗药物ACNU,是一种较强的抗细胞有丝分裂剂,主要作用于肿瘤细胞的G1期和S期,对增殖和非增殖群均有效,而放疗对S期细胞不敏感,两者同步联合进行具有协同效应。Jenkinson等[5]应用 CT、MRI、SPECT 等技术观察到恶性胶质瘤ACNU间质化疗后肿瘤内平均血流速度、血容量及葡萄糖利用量均显著减少,证实了间质化疗对恶性胶质瘤的生理代谢有明显的抑制作用。Hart等[6]分析了 CENTRAL、MEDLINE、EMBASE及Science Citation Index等权威发布的近20年恶性胶质瘤术后瘤腔间质化疗数据,结果显示对于初治恶性胶质瘤患者,术后放疗加瘤腔卡莫司丁(BCNU)间质化疗较单纯术后放疗生存率明显提高(风险比为0.65,95%CI 0.48 ~0.86,P=0.003)。ACNU与BCNU一样同为亚硝脲类药物,该研究结果显示ACNU+RT组患者疗效优于RT组,且均未出现不耐受,均完成了治疗。
TMZ是一种新的咪唑嗪类口服抗肿瘤药物,其细胞毒性主要表现为DNA甲基化作用,甲基化主要作用于鸟嘌呤的 O6和 N7位[7]。口服 TMZ吸收快,可以通过血脑屏障,中枢神经系统的药物浓度为血浆浓度的 30% ~40%[8]。研究[9]证实,TMZ 具有放疗增敏作用。该研究中TMZ+RT组患者疗效优于RT组,与ACNU+RT组相比无明显差异。Seiz等[10]报道长期应用TMZ安全有效,且无明显的药物累积毒性作用。该研究中TMZ+RT组患者不良反应轻微,出现白细胞下降后经减量或暂停治疗后迅速恢复,具有良好的耐受性。
综上所述,脑恶性胶质瘤术后ACNU+RT及TMZ+RT均有较好疗效,而ACNU的治疗费用明显低于TMZ,值得临床进一步实践观察。
[1]Park DM,Rich JN.Biology of glioma cancer stem cells[J].Mol Cells,2009,28(1):7
[2]常萍,刘孜,王娟,等.顺铂对Hela细胞辐射增敏的体外实验观察[J].西安交通大学学报:医学版,2011,32(4):462
[3]纪文元,梁平.儿童髓母细胞瘤术后放疗、化疗的治疗进展[J].实用儿科临床杂志,2011,26(11):884
[4]Bodell WJ,Bodell AP,Giannini DD,et al.Levels and distribution of BCNU in GBM tumors following intratumoral injection of DTI-015(BCNU-ethanol)[J].Neuro Oncol,2007,9(1):12
[5]Jenkinson MD,Smith TS,Haylock B,et al.PhaseⅡtrial of intratumoral BCNU injection and radiotherapy on untreatedadult malignant glioma[J].J Neurooncol,2010,99(1):103
[6]Hart MG,Grant R,Garside R,et al.Chemotherapy wafers for high grade glioma[J].Cochrane Database of Syst Rev,2011,3(16):CD007294
[7]Mason WP,Cairncross JG.Drug insight:temozolomide as a treatment for malignant glioma:impact of a recent trial[J].Nat Clin Pract Neurol,2005,1(2):88
[8]Ostermann S,Csajka C,Buclin T,et al.Plasma and cerebrospinal fluid population pharmacokinetics of temozolomide in malignant glioma patients[J].Clin Cancer Res,2004,10(11):3728
[9]Fehlauer F,Muench M,Richter E,et al.The inhibition of proliferation and migration of glioma spheroids exposed to temozolomide is less than additive if combined with irradiation[J].Oncol Rep,2007,17(4):941
[10]Seiz M,Krafft U,Freyschlag CF,et al.Long-term adjuvant administration of temozolomide in patients with glioblastoma multiforme:experience of a single institution[J].J Cancer Res Clin Oncol,2010,136(11):1691
