鹅细小病毒SS/10株VP3蛋白的原核表达及鉴定
2012-09-26胡自立刘海玲张光明高瑞娟罗开健
胡自立,刘海玲,张光明,张 凯,高瑞娟,罗开健
(华南农业大学兽医学院 农业部兽用疫苗创制重点实验室,广东广州510642)
小鹅瘟(Gosling plague)是由鹅细小病毒(Goose parvovirus,GPV)引起的一种严重侵害雏鹅和雏番鸭的高度接触性、败血性传染病,尤其以雏鹅的急性肠炎以及肝、肾、心等实质脏器炎症为主要特征,致病性强,病死率高[1]。该病自1956年首次被报道至今,在许多国家都有该病的报道[1-3],目前仍然是危害水禽养殖的重大传染病之一,极大地影响着集约化养鹅业的发展。
GPV为单股线性DNA病毒[4],基因组全长5106 bp,含有2个主要开放阅读框(ORF),左侧ORF主要编码2个非结构蛋白NS1和NS2,右侧ORF编码3个结构蛋白 VP1、VP2、VP3[5-6]。VP3蛋白是GPV主要的衣壳蛋白,约占衣壳蛋白总含量的80%,是GPV的主要免疫保护性抗原,能诱导机体产生具有中和作用的抗体。因此,对VP3基因的研究逐渐成为国内外研究GPV的重点和热点。本试验通过克隆GPV野毒株SS/10的VP3基因,并进行原核表达,旨在进一步研究VP3蛋白的理化特性和生物学活性以及为建立GPV抗体的间接ELISA方法奠定基础。
1 材料与方法
1.1 材料
1.1.1 毒株和抗体 毒株为2010年佛山分离株;一抗为自制的兔抗GPV阳性血清;FITC标记的鼠抗兔二抗由华南农业大学兽医学院农业部兽用疫苗创制重点实验室提供。
1.1.2 载体 原核表达载体PET-32a和表达菌BL21由华南农业大学兽医学院农业部兽用疫苗创制重点实验室保存。
1.1.3 试剂和主要仪器 高保真酶Pfx,Enhance buffer,Pfx Amplification buffer,MgSO4,d NTPs购自Invitrogen公司;限制性核酸内切酶Hin dⅢ和Bam HI购自GE公司;病毒DNA抽提试剂盒购自上海生物工程技术服务有限公司;质粒抽提试剂盒,胶回收试剂盒购自OMEGA公司;BIO-RAD半干电转仪,Odyssey双色红外激光成像系统等仪器由华南农业大学兽医学院农业部兽用疫苗创制重点实验室提供。
1.2 方法
1.2.1 引物的合成 参照GenBank收录的GPV基因序列,设计了一对用于扩增VP3基因的引物,由宝生物(大连)有限公司合成。上游引物:5-ATAATGGATCCATGGCAGAGGGAGG-3;下 游 引物:5-GGCGCAAGCTTTTACAGATTTTGAGTTAG-3。下划线部分分别为上下游引物中添加的Bam HI和Hin dⅢ酶切位点。
1.2.2 病毒DNA的提取 参照试剂盒说明书进行。
1.2.3 VP3基因的扩增 PCR反应体系:10×Pfx Amplification buffer 5μL,10×PCR Enhancer Solution 5μL,d NTPs(2.5 mmol/L)5μL,50 mmol/L MgSO41μL,上游引物2.5μL,下游引物2.5μL,模板DNA 2μL,Pfx聚合酶0.5μL,dd H2O 26.5 μL。PCR反应条件:95℃预变性3 min;95℃变性30 s,50℃退火45 s,68℃延伸2 min,30个循环;68℃延伸10 min。10 g/L琼脂糖凝胶电泳检测后胶回收纯化。
1.2.4 原核表达质粒PET-32a-VP3的构建与鉴定将回收纯化的VP3基因产物和原核表达载体PET-32a分别用Hin dⅢ和Bam HI双酶切,回收约1.6 kb的目的片段和5.9 kb左右的载体片段,并连接。连接反应体系为:载体片段12μL,VP3基因目的片段5μL,T4 DNA连接酶1μL,缓冲液2μL,16℃连接12 h。将连接产物转化表达菌BL21,涂布于含Amp+的LB平板,选择可疑菌落(命名为BL21/PET-32a-VP3)接种含 Amp+的LB液体培养基扩增培养。碱裂解法小量提取质粒,用限制性内切酶Bam HI、Hin dⅢ双酶切鉴定。
1.2.5 VP3蛋白最佳诱导时间及IPTG最佳诱导浓度的优化
1.2.5.1 诱导时间优化 将重组菌 BL21/PET-32a-VP3接种于5 mL LB液体培养基中(含100 μg/mL氨苄青霉素),在30℃、180 r/min摇床培养过夜。取1 mL菌液以1:50接种于50 mL含同上抗生素的LB液体培养基中,继续培养至OD600 nm约为0.6时加入终浓度为0.5 mmol/L的IPTG,诱导表达5 h。每1 h取样1次,每次取80μL,加入20 μL 5×Protein loading buffer,混匀后煮沸8 min,进行SDS-PAGE分析。
1.2.5.2 IPTG浓度优化 同1.2.5.1将菌液培养至OD600 nm约为0.6时平均分到6支试管中,加入IPTG使终浓度分别为0.2、0.4、0.8、1.0、1.2、1.5mmol/L,30℃诱导5 h后 ,同上取样处理进行SDS-PAGE分析。
1.2.6 VP3蛋白的可溶性分析 取50 mL LB液体培养基(同前),加入1 mL菌液,在30℃、180 r/min摇床培养,至OD600 nm约为0.6时加入终浓度为0.4 mmol/L的IPTG,诱导表达5 h。将菌液在4℃以12 000 r/min离心10 min,弃上清,菌体以1/10原体积加入TE缓冲液悬浮,超声破碎20 min,在4℃以12 000 r/min离心20 min,将上清转入新的离心管中,沉淀加等体积的缓冲液悬浮。上清和沉淀悬浮液各取100μL,加入25μL 5×Protein loading buffer,煮沸8 min,进行SDS-PAGE分析。
1.2.7 VP3蛋白的纯化及 Western blot分析 本试验对包涵体采用高浓度尿素变性及梯度尿素逐渐复性的方法进行纯化处理。对纯化的蛋白进行Western blot分析,其方法参照文献[7]进行,即将VP3蛋白经SDS-PAGE(50 g/L浓缩胶,150 g/L分离胶)电泳后,采用BIO-RAD半干电转仪转印硝酸纤维素膜,转膜后将膜用含有50 g/L脱脂奶粉的PBST封闭2 h,弃去封闭液,加入20倍稀释的兔抗GPV阳性血清,37℃孵育1 h,PBST洗涤3次后加入10 000倍稀释的FITC标记的鼠抗兔二抗,37℃孵育1 h,PBST洗涤3次后用Odyssey双色红外激光成像系统扫描结果。
2 结果
2.1 VP3基因的克隆
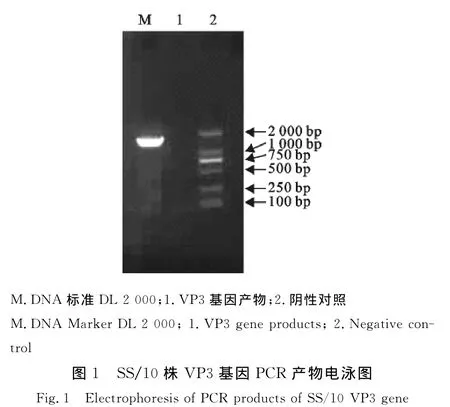
以SS/10病毒DNA为模板,以VP3基因扩增引物进行PCR扩增,结果成功扩增出约1 600 bp的基因片段(图1)。
2.2 原核表达载体双酶切鉴定
对重组质粒PET-32a-VP3进行双酶切,琼脂糖凝胶电泳结果显示,成功扩增出了大小分别为5 900 bp和1 600 bp左右的片段(图2),与目的片段大小一致,说明原核表达载体构建成功。
2.3 最佳诱导时间的优化
SDS-PAGE结果表明,从诱导5 h开始,随着诱导时间的增加,蛋白表达量不再有明显的升高,所以最佳诱导时间定为5 h(图3)。
2.4 IPTG最佳诱导浓度的优化
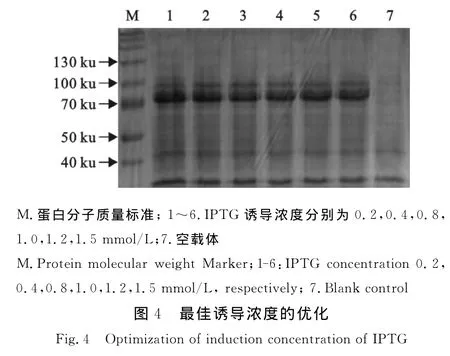
SDS-PAGE结果表明,当IPTG 浓度为0.4 mmol/L时,随着浓度的进一步升高 ,蛋白表达量没有明显增加,所以IPTG最佳诱导浓度定为0.4 mmol/L(图4)。
2.5 可溶性分析
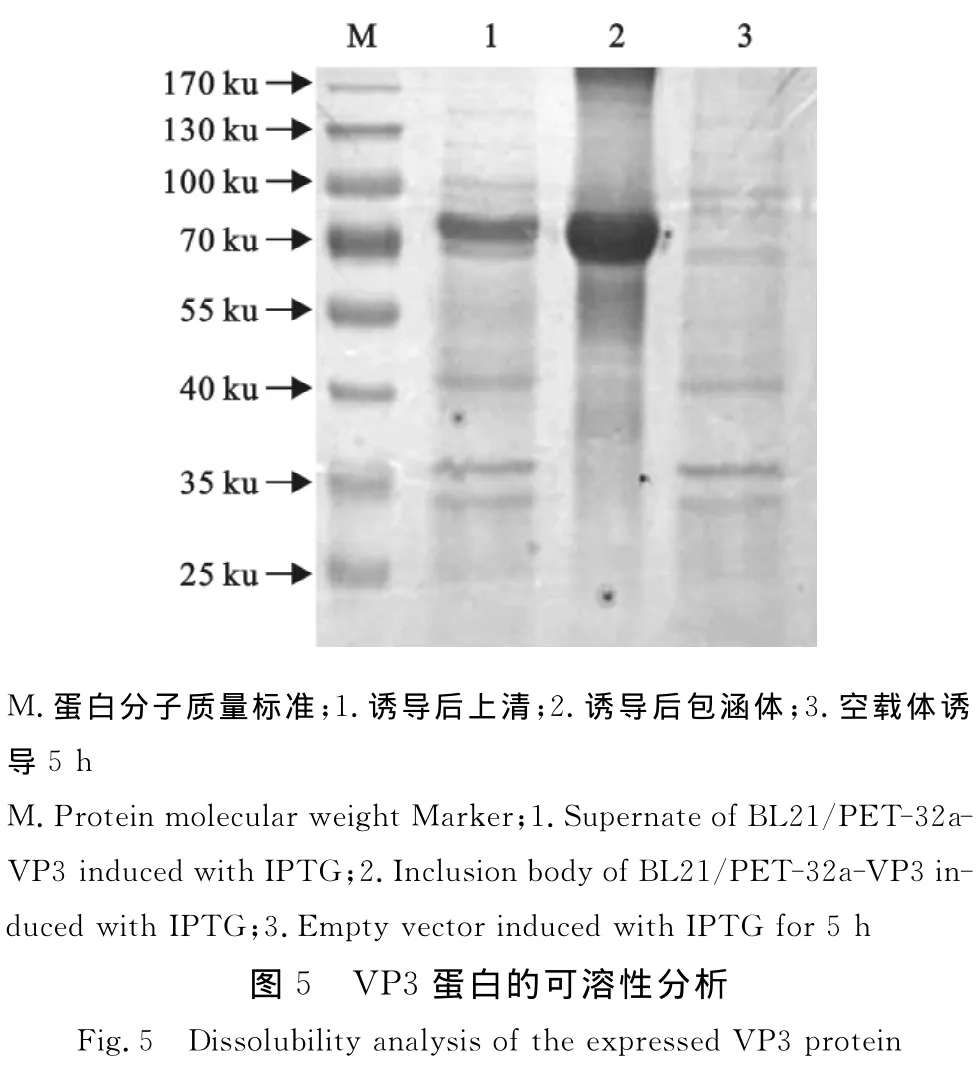
可溶性分析表明,表达的VP3融合蛋白部分可溶,大部分以包涵体的形式存在于菌体中(图5)。
2.6 Western blot分析
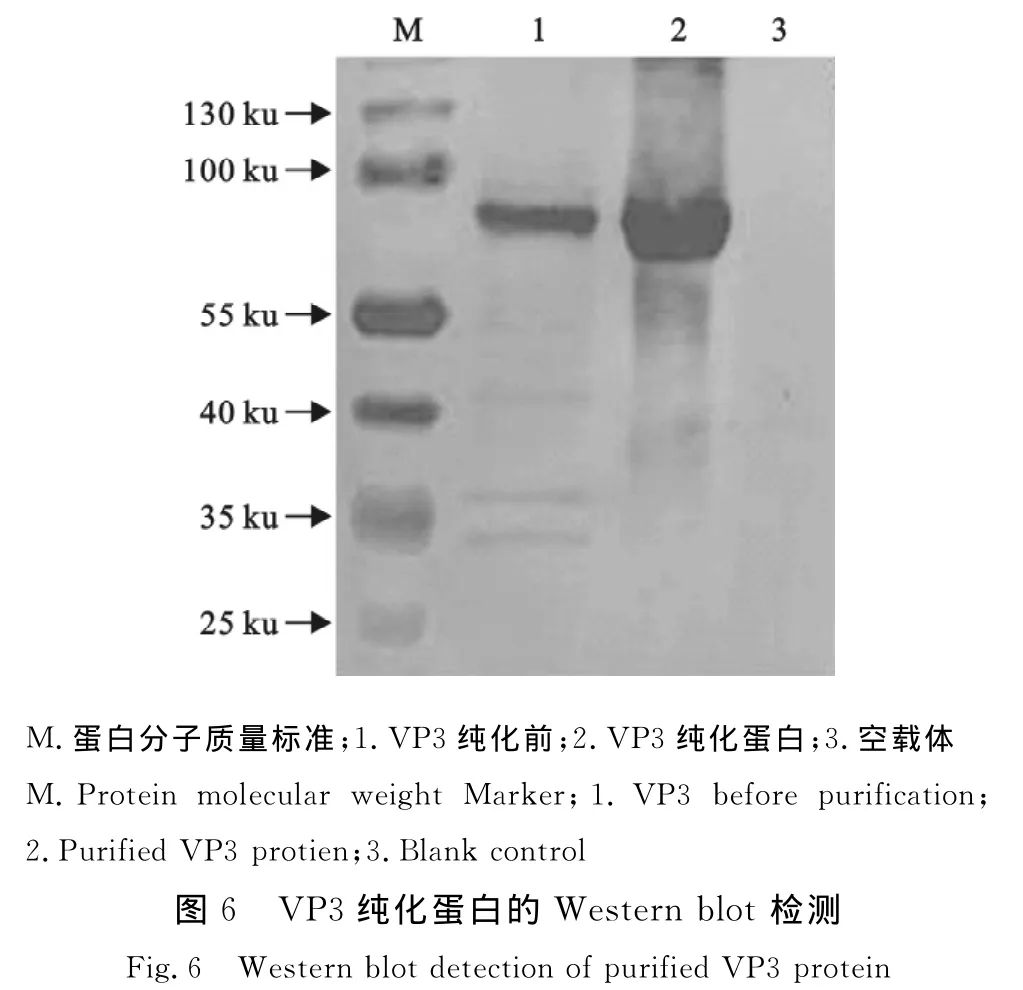
对重组VP3蛋白进行Western blot检测,结果表明,表达的融合蛋白能被兔抗GPV阳性血清所识别(图6)。

3 讨论
目前检测小鹅瘟抗体的方法主要有中和试验[8-9]、琼脂扩散试验、免疫酶琼脂扩散试验、酶联免疫吸附试验(ELISA)、间接血凝试验、精子凝集抑制试验等。本研究表达VP3蛋白旨在为建立一种检测小鹅瘟抗体的简便、灵敏、有效的方法奠定基础。
于天飞等[10]分析了GPV H1株结构蛋白的B细胞抗原表位,结果显示大部分抗原表位都集中分布在VP3蛋白的423-732氨基酸部位,表明VP3蛋白是主要的免疫原性蛋白。与VP1和VP2相比,VP3蛋白还具有表达量高,稳定等优点[11]。近年来,国内外学者对GPV衣壳蛋白研究较多,特别是VP3蛋白的研究。李宝臣等[12]于2003年首次利用pGEX原核表达载体系统成功表达了GPV的VP3基因;余祖华于2006年在乳酸菌中成功表达了VP3基因;毕玉海等[13]根据GPV B株全基因序列利用原核表达载体PET-28a对GPV GD-01株的VP3基因进行扩增、测序分析并进行了原核表达;田丽红等[14]构建了含有VP3基因的重组禽痘病毒转移载体,为构建表达VP3基因的重组禽痘病毒打下了基础。
本研究用PET-32a表达载体对SS/10株VP3基因进行了原核表达,对表达产物进行SDS-PAGE电泳,结果表明成功表达出了约72 ku的融合蛋白,其中VP3蛋白约60 ku,硫氧还蛋白(融合伴侣)约12 ku。对表达条件进行优化,确定了IPTG的最佳诱导浓度为0.4 mmol/L,最佳诱导时间为5 h。表达的VP3重组蛋白部分可溶,大部分以包涵体形式存在于菌体中,采用高浓度尿素变性和梯度尿素逐渐复性的方法对包涵体纯化处理后得到了较纯的可溶性蛋白,这为包涵体蛋白的纯化和利用提供了一种新思路。对表达产物进行 Western blot分析,结果表明该VP3蛋白能与兔抗GPV阳性血清反应,证明其具有良好的反应原性,为建立间接ELISA方法、研制基因工程疫苗及诊断制品奠定了基础。
[1]殷 震.刘景华.动物病毒学[M].2版.北京:科学出版社,1997:1165-1168.
[2]Gough R E.Goose parvovirus infection[M].Disease of Poultry,1991:684-690.
[3]Takehara K,Nishio T,Hayashi Y,et al.An outbreak of goose parvovirus infection in Japan[J].Vet Med Sci,1995,57(4):777-779.
[4]Brownk E,Greens W,Youngn S.Goose parvovirus:an autonomous member of the dependovirus genus[J].Virology,1995,210(2):283-291.
[5]Zadori Z,Judith E,Nagy J,et al.Characteristics of the genomeof goose parvovirus[J].Avian Pathol,1994,23(2):359-364.
[6]Zadori Z,Stefancsik R,Rauch T,et al.Analysis of the complete nucleotide sequences of goose and Muscovy duck parvovirus indicates common ancestral origin with adeno-associated virus 2[J].Virology,1995,212(2):562-573.
[7]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].3版.黄培堂,王嘉玺,朱厚础,等译.北京:科学出版社,2002.
[8]Derzsy D.A viral disease of goslings:epidemiological,clinical,pathological and aetiological-ical studies[J].Acta Vet Acad Sci,1970(17):443-448.
[9]Schettler H.Virus hepatitis of goose1 Properties of the casual agent[J].Avian Pathol,1973,2:179-193.
[10]于天飞,马 波,邢明伟,等.鹅细小病毒非结构蛋白和结构蛋白的二级结构及B细胞抗原表位预测[J].中国家禽,2007,29(7):7-11.
[11]Zhang Yun,Li Y F,Liu Ming,et al.Development and evaluation of a VP3-ELISA for the detection of goose and Muscovy duck parvovirus antibodies[J].J Virol Meth,2010,163:405-409.
[12]李宝臣,齐 岩,马 波,等.鹅细小病毒不同毒株VP3基因的克隆与序列分析[J].中国预防兽医学报,2003,25(6):430-433.
[13]毕玉海,丁 壮,徐 明,等.鹅细小病毒主要免疫原性蛋白VP3基因遗传变异及其原核表达[J].中国兽医学报,2007,27(2):172-175.
[14]田丽红,贾永清,王君伟,等.鹅细小病毒VP3基因重组禽痘病毒转移载体的构建[J].中国兽医科技,2002,32(9):5-8.
