苯酚在活性炭上的吸附模型
2012-09-26尤翔宇王云燕苏艳蓉柴立元舒余德
尤翔宇,杨 杰,王云燕,苏艳蓉,柴立元,舒余德
(1. 中南大学 冶金科学与工程学院,长沙 410017;2. 中南大学 国家重金属污染防治工程技术研究中心,长沙 410017;3. 湖南省环境保护科学研究院,长沙 410004;4. 长沙市审计局,长沙 410013;5. 中机国际工程设计研究院有限责任公司,长沙 410007)
苯酚在活性炭上的吸附模型
尤翔宇1,2,3,杨 杰4,王云燕1,2,苏艳蓉5,柴立元1,2,舒余德1,2
(1. 中南大学 冶金科学与工程学院,长沙 410017;2. 中南大学 国家重金属污染防治工程技术研究中心,长沙 410017;3. 湖南省环境保护科学研究院,长沙 410004;4. 长沙市审计局,长沙 410013;5. 中机国际工程设计研究院有限责任公司,长沙 410007)
采用静态吸附实验研究苯酚在活性炭上的吸附热力学及动力学行为。采用预处理后的活性炭吸附苯酚,吸附过程遵守二级动力学方程,最大吸附量为0.276 1 g/g。吸附热为−23.89 kJ/mol,吸附键强度较小,一个苯酚分子通过氢键吸附在活性炭界面两个活性点上;随着苯酚引入量的增加,红外光谱在3 432 cm−1的羟基谱线由尖逐渐变宽,出现弥散光谱,由此推测出苯酚通过羟基上的氢键发生缔合。综合所得数据提出活性炭吸附苯酚的模型,并圆满解释相关的实验现象。
苯酚;活性炭;吸附模型
苯酚是一种常见的高毒性难降解有机物。焦化工业的发展使含酚废水的排放量越来越大,成分也越来越复杂。含酚废水COD含量高,苯环结构稳定,不易分解,可生化性差,处理难度大,是当前环境领域研究的热点与难点问题[1]。因此,研究开发高效的含酚废水处理技术具有十分重要的意义。
吸附法在处理含酚废水中应用较为广泛,吸附剂对废水中苯酚的吸附具有很好的可逆性,容易脱附回收[2],能多次使用,处理效果明显,且吸附剂可选择的范围较多。常用的吸附剂如活性炭[3]、沸石[4]、膨润土[5]、大孔树脂[6−7]等对苯酚的吸附效率一般都在90%以上。活性炭是以碳为主要成分的吸附材料,结构比较复杂。活性炭的吸附性能不仅和其空隙结构有关,而且与其化学组成和化学结构有关[8]。作为多孔吸附剂的活性炭基本上是非结晶性物质,由微细的石墨状微晶和将其连接在一起的碳氢化合物构成的,固体部分之间的间隙形成孔隙,赋予活性炭所特有的吸附性能。王贵珍等[3]对毛竹活性炭的制备及其吸附苯酚废水进行了研究;RADOVIC等[9]研究了不同活性炭表面物理化学特性,包括表面含氧基团、孔径及活性炭材质等对苯酚吸附去除率的影响。ROOSTAEI等[10]等研究的实验结果表明活性炭对苯酚的吸附性能优于硅胶和活性铝土;VIRARAGHAVAN[11]采用泥炭处理苯酚废水,去除率达到46.1%,吸附效果明显优于飞灰与皂土;詹旭等[12]研究活性炭吸附苯酚废水的处理效果,在活性炭用量为14 g/L,初始浓度为0.505 mg/L的情况下,20 min挥发酚的去除率即可达到96.04%。这些研究表明,采用活性炭处理含酚废水是完全可行的。
目前,国内外对活性炭吸附处理苯酚废水的研究大多停留在工艺上[13],没有对苯酚吸附过程进行深入研究,无法清楚地解释苯酚的吸附机理,影响该工艺的研究和应用。本文作者在查明活性炭吸附苯酚行为的过程后,由吸附热力学、吸附动力学及吸附不同浓度苯酚后活性炭的红外光谱图推测出活性炭吸附苯酚的模型,为苯酚吸附工艺过程的优化和吸附机理的探讨提供理论依据。
1 实验
1.1 苯酚废水
模拟苯酚废水:称取1.35 g苯酚溶于1000 mL水中,总有机碳(TOC)浓度为950 mg/L,化学需氧量(COD)浓度为2 850 mg/L,pH值为6.5。
1.2 实验过程
将购置的HA-B型活性炭用清水冲洗干净,再放入沸水中煮去除杂质后烘干备用。
称取一定量的预处理后活性炭吸附剂投入到已调pH值的装有100 mL模拟苯酚废水的锥形瓶中,恒温振荡(转速170 r/min,反应温度20 ℃),反应完成后取样,在520 nm的波长下,用722型可见光分光光度计对剩余苯酚浓度进行检测。
在吸附等温线研究中,活性炭用量为5 g/L,溶液pH值为5.8。在吸附动力学研究中,活性炭用量为5 g/L,苯酚初始浓度为1.35 g/L,溶液pH值5.8,反应时间为2 h。
实验过程中溶液pH值使用稀H2SO4和NaOH调整。所有实验均设3个平行样,测量数据的平均值用于结果分析。
1.3 分析方法
标准曲线法:于一组8支50 mL比色管中分别加入0、0.5、1.0、3.0、5.0、7.0、10.0、12.5 mL苯酚标准中间液,加水至50 mL标线,加0.5 mL缓冲溶液,混匀,此时pH值为10±0.2,加入4-氨基安替比林溶液1.0 mL混匀。再加1.0 mL铁氰化钾溶液,充分混匀,放置10 min后于510 nm波长下用光程20 mm的比色皿,以纯水为参比,测量吸光度,经空白校正后,绘制吸光度对苯酚含量的标准曲线。
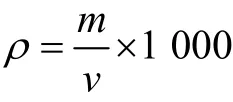
式中:ρ 为苯酚浓度,mg/L;m为由水样校正吸光度,从校准曲线上查得苯酚含量,mg;v为移取的溶液体积,L。
样品的红外光谱采用傅里叶红外光谱仪(美国热电公司,Nicolet Nexus670)测定;TOC采用总有机碳测定仪(日本岛津公司生产,TOC-VCPH)测定。
2 结果与讨论
2.1 吸附动力学
在活性炭投加量0.5 g,温度20 ℃,苯酚浓度1.35 g/L时,吸附量随反应时间的变化如图1所示。由图1可看出,随着时间的增加,活性炭吸附苯酚的量在70 min时逐渐达到平衡,为了保证活性炭吸附苯酚能达到饱和,采取的吸附时间为120 min。
在活性炭吸附剂吸附苯酚的动力学研究中,分别用一级动力学方程(Pseudo-first-order)和二级动力学方程(pseudo-second-order)对活性炭吸附动力学行为进行拟合[14],得到相关系数分别为0.984 2、0996 3,其他拟合结果见表1。

表1 活性炭吸附苯酚的动力学参数Table 1 Kinetic parameters of phenol adsorption on activated carbon
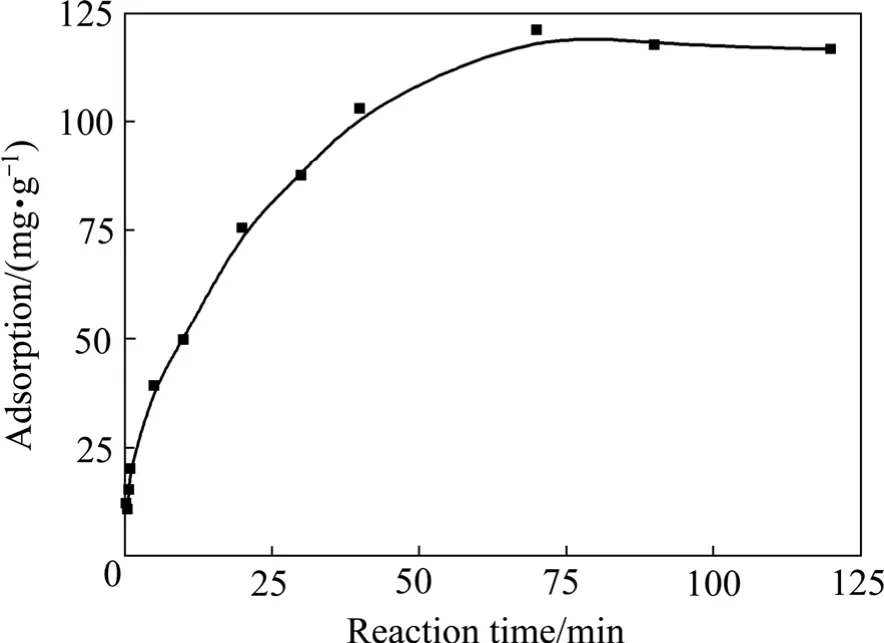
图1 活性炭吸附量与吸附时间的关系Fig. 1 Relationship between adsorption capacity and reaction time
由表1看出,根据一、二级吸附动力学方程计算的平衡吸附量分别为105.36、127.55 mg/g,实验测得的平衡吸附量为120.96 mg/g,二级动力学方程计算出的平衡吸附量接近实验值,且拟合的相关系数更高。所以,二级动力学方程更适合描述活性炭吸附苯酚的吸附动力学,表明活性炭吸附苯酚的过程为化学吸附。
2.2 吸附等温线
在不同的苯酚初始浓度下,投加0.5 g活性炭,吸附平衡时间为120 min,实验结束测定平衡浓度。在不同温度下进行上述实验得到吸附等温曲线如图2所示。
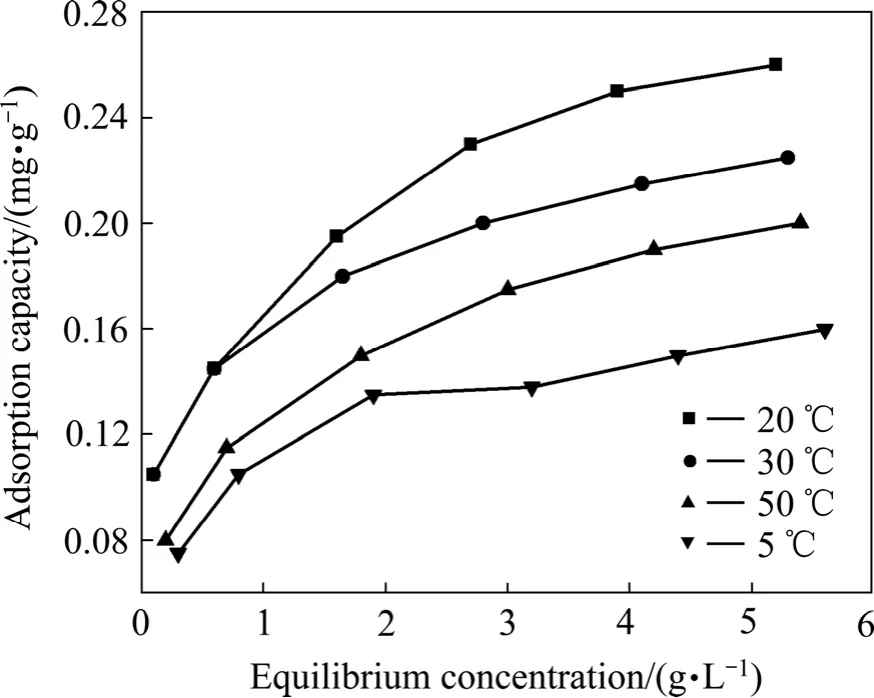
图2 活性炭吸附量与平衡浓度的关系Fig. 2 Relationship between adsorption capacity and equilibrium concentration
由Clausius-clapyron方程式推导可得

式中:Q为吸附热,kJ/mol;R为摩尔气体常数,8.314 J/(mol·K);T1、T2分别为反应温度,K;c1、c2分别为温度T1、T2时对应的平衡浓度,mol/L。
根据两个不同温度下吸附平衡浓度可近似求得吸附热。吸附通常为放热过程,故由图2提供的数据及式(1)求得吸附热为−23.89 kJ/mol。吸附热较小,介于物理吸附和化学吸附之间,推测可能为氢键吸附。
2.3 吸附位
如果苯酚吸附在活性炭粒子表面的两个位置上[15−16],吸附平衡时应遵循如下方程式:

式中:b为吸附平衡常数,又称吸附系数;c为不同初始浓度时的平衡浓度,mol/L;θ为吸附位覆盖度,可以用不同初始浓度时的平衡吸附量q与饱和吸附量qm的比值表示,即θ=q/qm。
将方程式(2)转化为线性方程式得

用c1/2/q对c1/2作图得一直线,结果如图3所示,由直线斜率得qm为0.276 1 g/g,拟合相关系数为0.993 1。结果表明,苯酚吸附在活性炭上时与两个活性点成键。
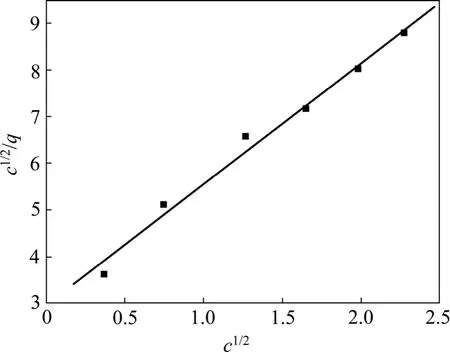
图3c1/2/q与c1/2的关系Fig.3 Relationship betweenc1/2/qandc1/2
2.4 苯酚在活性炭上的吸附形态
2.4.1 红外光谱
为了查明苯酚在活性炭上的吸附形态,测定不同苯酚浓度下活性炭吸附苯酚后的红外光谱图,如图4所示。图4中由下往上曲线1~4分别为活性炭,加入浓度为0.65 g/L苯酚,浓度为1.95 g/L苯酚及浓度为6.5 g/L苯酚的活性炭红外光谱。随着苯酚引入量的增加,羟基吸收带由活性炭得到的尖峰逐渐变宽,出现弥散的宽谱。而由1 000 cm−1处吸收带的位置没有偏移,可知苯环在活性炭上无相互作用,因此可以认为活性炭吸附苯酚时是苯酚的羟基与活性炭的表面发生作用。
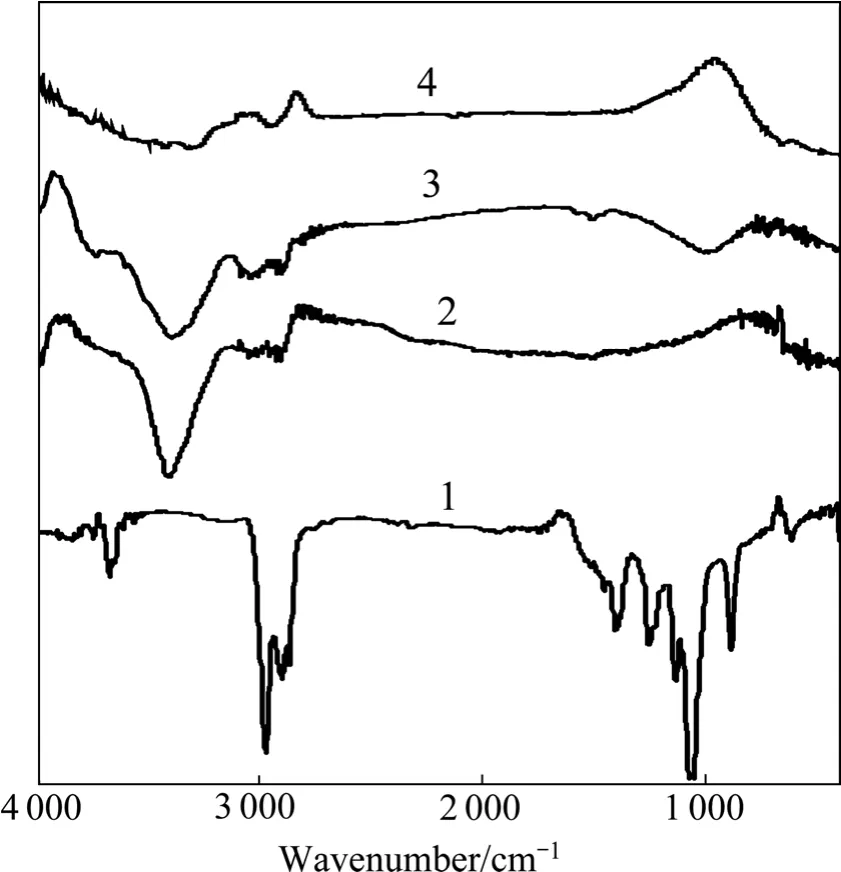
图4 活性炭的红外光谱Fig.4 IR spectra of activated carbon: 1—Activated carbon; 2—0.65 g/L phenol+activated carbon; 3—1.95 g/L phenol+ activated carbon; 4—6.5 g/L phenol+activated carbon
2.4.2 活性炭羟基的形成
由活性炭的红外光谱图看到,在波长为3 432 cm−1时出现很强的O—H伸缩振动,表明活性炭存在羟基,可以这样推测活性炭中有羟基形成。活性炭类似石墨分子结构,由大量微晶分子组成,碳分子用sp2杂化轨道形成δ键骨架,微晶中的一个未饱和sp2杂化轨道与O—H键中氧原子一个sp3轨道成键,形成活性炭表面上的羟基,剩下的两个sp3杂化轨道均有孤对电子。按照价键理论,键的结构式表示为

2.4.3 苯酚在活性炭上的吸附化学键结构式
在苯酚分子中,氧原子的价电子是以sp2杂化轨道参与成键。酚羟基中氧原子上的一对未共用电子对所在p轨道与苯酚的6个碳原子的p轨道平行形成离域π键,sp2杂化轨道中其中一个sp2轨道与酚中C成键,另一个sp2轨道与H原子成键。第三个sp2轨道具有未用的孤对电子,苯酚分子结构可表示为

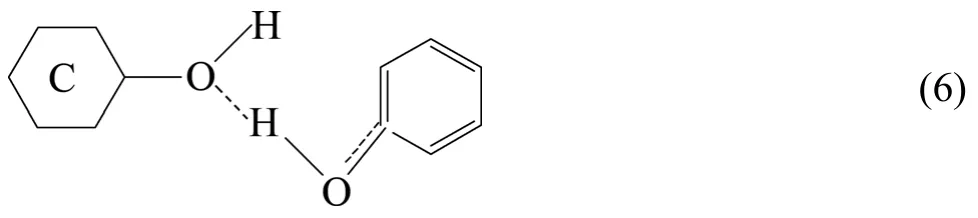
由式(4)~(5)可知,活性炭中羟基氧原子sp3轨道中存在的孤对电子,可与苯酚中羟基中的氢形成氢键,苯酚吸附在活性炭上的结构为
2.4.4 苯酚在活性炭上的吸附形态
由等温方程求得的吸附热为−33.046 kJ/mol,也证明苯酚以氢键吸附在活性炭上[17]。式(5)表明,苯酚羟基中氧一个sp3轨道有一对未用的孤对电子,通过它形成氢键如式(6)所示。图5所示为苯酚在活性炭上的吸附态示意图。由图5看到,活性炭中的羟基使吸附的苯酚发生缔合,故随着苯酚浓度的增加,使羟基的氧原子有两对孤对电子,其中一对可以与另一个被吸附酚的羟基氧原子又形成了氢键。通过这种连结方式使苯酚在活性炭界面上发生缔合。这就解释了红外光谱中随活性炭吸附苯酚吸附量的增加,羟基吸附带变宽,出现弥散的宽谱。式(5)中苯酚在活性炭的吸附是通过两个氢键吸附在活性炭两个羟基的氧原子上,吸附位为2,与吸附等温曲线实际结果一致。
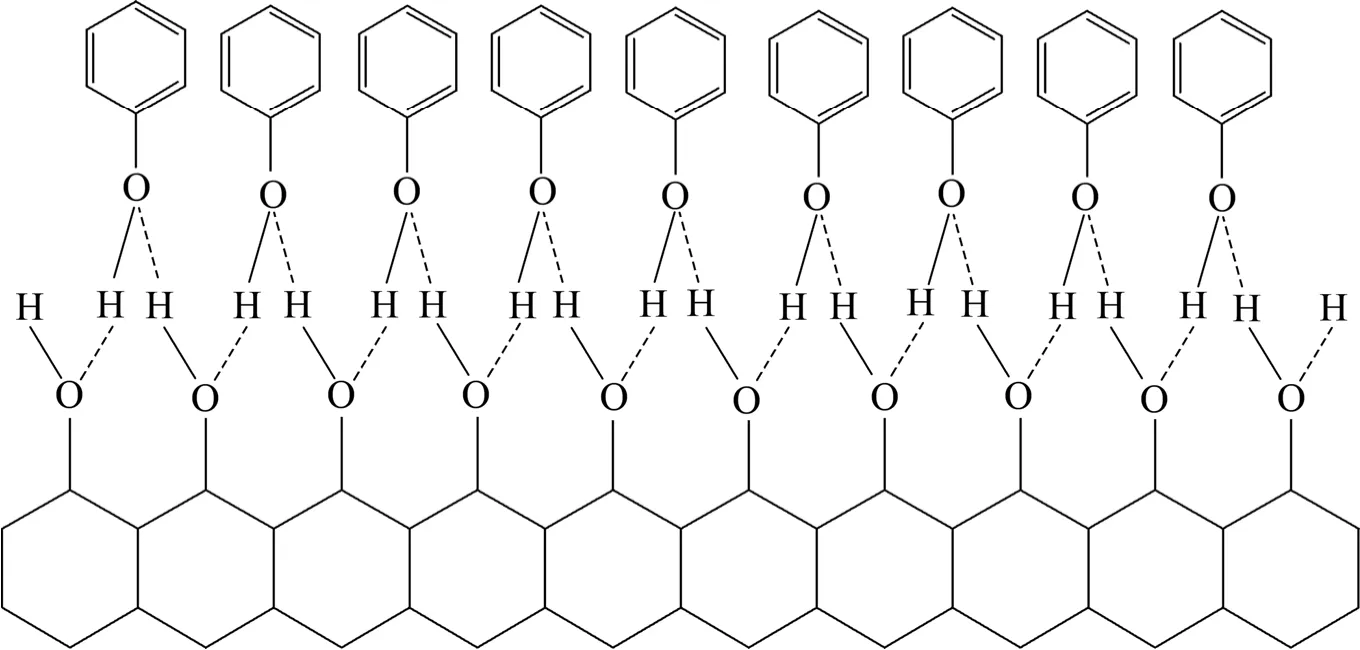
图5 苯酚在活性炭上的吸附态示意图Fig. 5 Structure of phenol adsorbed on activated carbon
2.5 吸附模型对实验现象的解释
2.5.1 温度对活性炭吸附苯酚的影响
在活性炭投加量为0.5 g,吸附时间为120 min,苯酚浓度为1.34 g/L,pH值为6时,当温度从10 ℃增加到70 ℃时,得到吸附量与温度的关系如图6所示。
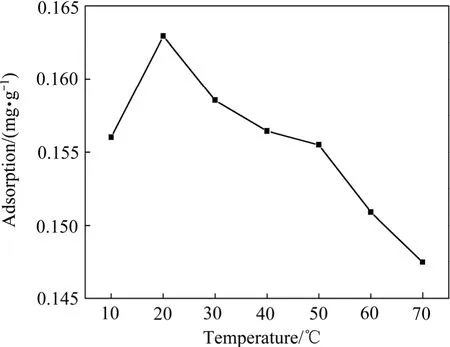
图6 温度对活性炭吸附苯酚的影响Fig.6 Effect of temperature on phenol adsorption on activated carbon
由图6可看出,当温度小于20 ℃时,活性炭吸附苯酚的吸附量随着温度的升高而升高;当温度为20 ℃时,得到最大的吸附量0.163 g/g;当温度大于20℃时,活性炭的吸附量随着温度的升高而降低;当温度达到70 ℃时,活性炭对苯酚的吸附量只有0.1474 g/g。由于吸附为放热反应,故增加温度,吸附效果变差。
2.5.2 初始pH值对活性炭吸附苯酚的影响
在温度20 ℃,吸附时间为120 min,苯酚浓度为1.34 g/L,活性炭投加量为0.5 g时,改变pH值从2到12,得到初始pH值对活性炭吸附苯酚的影响如图7所示。
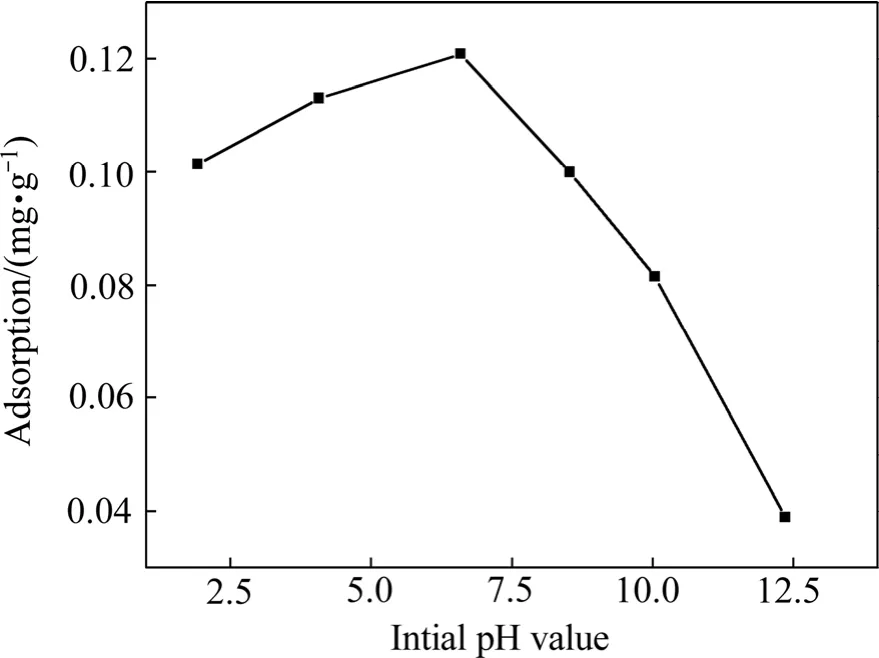
图7 初始pH值对活性炭吸附苯酚的影响Fig.7 Effect of initial pH value on phenol adsorption on activated carbon
由图7看到,当活性炭在pH值为6~7时,活性炭对苯酚有最大的吸附量;当pH值大于或小于6~7时,活性炭吸附苯酚的性能将受到很大的影响。酸性条件下,活性炭吸附苯酚的性能有所降低,但影响不明显。但当pH值大于8时,活性炭的吸附性能下降明显;当pH值大于12时,活性炭吸附性能几乎完全丧失,吸附量只有0.04 g/g。由式(5)看到,酚羟基中氧原子上的一对未共用电子对所在的p轨道与苯环的六个碳原子平行,组成共轭体系。使氧原子的负电荷离域,降低了氧原子上的电子云密度,从而消弱O—H键与活性炭形成的氢键。故随着OH−浓度的增加,会发生如下反应:
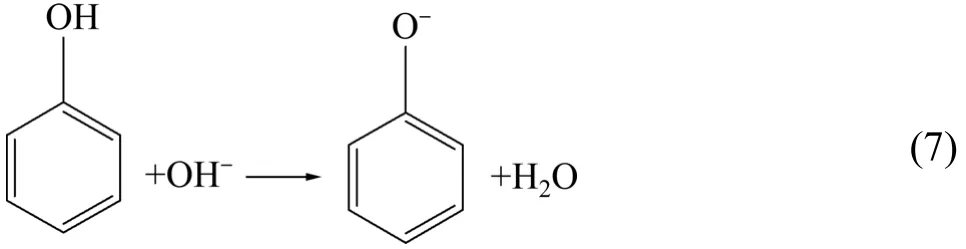
当OH−达到一定程度后,氢键全部断裂,故活性炭失去吸附性能。
3 结论
1) 活性炭对苯酚的吸附遵守二级动力学方程,最大吸附量为0.2761 g/g。
2) 活性炭吸附苯酚服从朗格缪尔方程式,表明有一个苯酚分子吸附在两个活性点上。实际测得的吸附热为−33.046 kJ/mol,表明吸附键的强度较小,推测苯酚通过氢键吸附在活性炭上。
3) 红外光谱实验表明,随着苯酚浓度增加,红外光谱在3 432 cm−1的羟基谱线由尖逐渐变宽,出现弥散光谱,推测苯酚通过氢键发生缔合。
4) 提出了活性炭吸附苯酚的模型,并圆满解释吸附实验的有关现象。
REFERENCES
[1]DOS SANTOS V L, MONTEIRO A S, BRAGA D T, SANTORO M M. Phenol degradation by Aureobasidium pullulans FE13 isolated from industrial effluents[J]. Journal of Hazardous Materials, 2009, 161(2/3): 1413−1420.
[2]LIN K L, PAN J Y, CHEN Y W, CHENG R M, XU X C. Study the adsorption of phenol from aqueous solution on hydroxyapatite nanopowders[J]. Journal of Hazardous Materials, 2009, 161(1): 231−240.
[3]王贵珍, 李丽欣, 李永真, 薛全民. 毛竹活性炭制备及其对含苯酚废水吸附的研究[J]. 高校化学工程学报, 2010, 24(4): 700−704. WANG Gui-zhen, LI Li-xin, LI Yong-zhen, XUE Quan-min. Study on the preparation of bamboo activated carbon and its phenol adsorption properties[J]. Journal of Chemical Engineering of Chinese Universities, 2010, 24(4): 700−704.
[4]李增新, 孟 韵, 梁 强, 王彤. 壳聚糖改性沸石吸附废水中的苯酚[J]. 生态环境, 2008, 17(6): 2168−2172. LI Zeng-xin, MENG Yun, LIANG Qiang, WANG Tong. Adsorption of phenol in wastewater with modified zeolite-chitosan adsorbent[J]. Ecology and Environment, 2008, 17(6): 2168−2172.
[5]MA J F, ZHU L Z. Removal of phenols from water accompanied with synthesis of organobentonite in one-step process[J]. Chemosphere, 2007, 68(10): 1883−1888.
[6]JUANG R S, SHIAN J Y. Adsorption of phenol from water onto macrovoreticularresins[J]. Journal of Hazardous Materials, 1999, B(70): 171−183.
[7]周 芸, 胡俐萍, 徐满才. 两种酰胺基数值对苯酚的吸附热力学[J]. 湖南师范大学自然科学学报, 2007, 30(4): 85−89. ZHOU Yun, HU Li-ping, XU Man-cai. Adsorption thermodynamics of phenol onto polymeric adsorbents with amide groups[J]. Journal of Natural Science of Hunan Normal University, 2007, 30(4): 85−89.
[8]王 璞, 闵小波, 柴立元, 王云燕, 方 艳, 常 皓, 袁 林.颗粒活性炭对乳酸钠的吸附及其特性[J]. 中国有色金属学报, 2007, 17(6): 1008−1013. WANG Pu, MIN Xiao-bo, CHAI Li-yuan, WANG Yun-yan, FANG Yan, CHANG Hao, YUAN Lin. Adsorption of sodium lactate on modified active carbon and its characteristics[J]. The Chinese Journal of Nonferrous Metals, 2007, 17(6): 1008−1013.
[9]RADOVIC L R, MORENO-CASTILLA C, RIVERA-UTRILLA J. Carbon materials as adsorbents in aqueous solutions[J]. Chemistry and Physics of Carbon, 2000, 27: 227.
[10]ROOSTAEI N, TEZEL F H. Removal of phenol from aqueous solutions by adsorption[J]. Journal of Environmental Management, 2004, 70(2): 157−164.
[11]VIRARAGHA V T. Removal of phenol from wastewater by adsorption on peat,fly ash and bentonite[J]. Environment Engineering, 1992, 5: 311−317.
[12]詹 旭, 邹路易, 邵 帅, 李 靖. 活性炭对挥发酚的吸附特性[J]. 科技导报, 2010, 28(24): 44−47. ZHAN Xu, ZOU Lu-yi, SHAO Shuai, LI Jing. Absorption characteristics of activated carbon on volatile phenol[J]. Science & Technology Review, 2010, 28(24): 44−47.
[13]BUSCA G, BERARDINELLI S, RESINI C, ARRIGHI L. Technologies for the removal of phenol from fluid streams: A short review of recent developments[J]. Journal of Hazardous Materials, 2008, 160(2/3): 265−288.
[14]HAMEED B H, AHMAD A A, AZIZ N. Isotherms kinetics and thermodynamics of acid dye adsorption on activated palm ash[J]. Chemical Engineering Journal, 2007, 133: 195−203.
[15]张金利, 冀秀玲, 李 韡, 黄群武. 苯酚在活性炭上吸附平衡模型的研究[J]. 化学工业与工程, 2001(6): 341−345. ZHANG Jin-li, JI Xiu-ling, LI Wei, HUANG Qun-wu. Study on adsorption in activated carbon[J]. Chemical Industry & Engineering, 2001(6): 341−345.
[16]张启伟, 王桂仙. 竹炭对苯酚吸附的热力学及动力学参数的研究[J]. 生物质化学功工程, 2008, 42(2): 19−22. ZHANG Qi-wei, WANG Gui-xian. Study on the kinetic and the thermodynamic parameters for adsorption of phenol by bamboo-charcoal[J]. Biomass Chemical Engineering, 2008, 42(2): 19−22.
[17]辛 勤. 固体催化剂研究方法[M]. 北京: 科学出版社, 2004: 364−367. XIN Qin. Methods for the investigation of solid catalysts[M]. Beijing: Science Press, 2004: 364−367.
(编辑 李艳红)
Adsorption model of phenol on activated carbon
YOU Xiang-yu1,2,3, YANG Jie4, WANG Yun-yan1,2, SU Yan-rong5, CHAI Li-yuan1,2, SHU Yu-de1,2
(1. School of Metallurgical Science and Engineering, Central South University, Changsha 410017, China; 2. National Engineering Research Center for Pollution Control of Heavy Metals, Central South University, Changsha 410017, China; 3. Hunan Research Academy of Environmental Sciences, Changsha 410004, China; 4. Changsha Municipal Audit Bureau, Changsha 410013, China; 5. China Machinery International Engineering Design & Research Institute Co., Ltd., Changsha 410007, China)
The dynamics and thermodynamics of activated carbon adsorbing phenol were investigated by static adsorption experiments. The adsorption process obeys the second-level dynamic equation, where the pretreatment activated carbon is used to adsorb phenol. The maximum adsorption capacity is 0.276 1 g/g. The experimental results deduced from the adsorption thermodynamics computation and the infrared spectrogram shows that the adsorption heat is−33.046 kJ/mol, the adsorption bond strength is small, and a phenol molecule adsorbs on two active points of activated carbon surface via hydrogen bond. With the increase of phenol dosage, the infrared spectrum broadens gradually on 3 432 cm−1hydroxyl spectral line, the dissemination spectrum occurs, which indicates that phenol associates through hydrogen bond on hydroxyl. Adsorption model being built based to the obtained data could be used to explain the related experiment phenomena.
phenol; activated carbon; adsorption model
X703.1,X793
A
国家杰出青年科学基金资助项目(50925417);国家自然科学基金重点项目(50830301);湖南省研究生科研创新项目(CX2010B121)
2011-10-18;
2012-03-20
王云燕,副教授,博士;电话:0731-88830577;E-mail: wyy@csu.edu.cn
1004-0609(2012)10-2924-06
