扁蕾不同部位的化学成分研究
2012-09-25罗洲飞刘妮娜徐彦军饶力群
罗洲飞,刘妮娜,徐彦军,饶力群
(1.湖南农业大学生物科学技术学院,湖南 长沙 410128;2.中国科学院植物研究所北京植物园,北京 100093;3.中国农业大学理学院,北京 100193;4.中国科学院研究生院,北京 100049)
扁蕾(Herba Gentianopsis)为龙胆科植物扁蕾Gentianopsis barbata(Froel.)Ma 的全草,主要生长在高海拔的河滩、山坡草地及林缘地区,在我国主要分布于西南、内蒙古、河北、东北等地[1]。扁蕾在治疗急性黄疸型肝炎、结膜炎、高血压、急性肾盂肾炎、疮疖肿毒、慢性肺源性心脏病等有广泛的应用[2-3]。大兴安岭地区的扁蕾产量极少,民间药用价值很高,已作为一种传统蒙药植物被广泛运用,但其化学成分尚未见报道。为进一步研究其药效成分,笔者对产于大兴安岭地区的扁蕾进行了化学成分的初步研究,并比较了不同部位的化学组成差异。李作平等[4]用色谱法和光谱法对扁蕾的化学成分进行了分析,其中主要成分为口山酮类。文章利用高效液相色谱-质谱联用技术(HPLC-ESI-MSn)分离鉴定大兴安岭地区的野生扁蕾不同部位的口山酮类化学成分,为该药材的品质评价和开发利用提供科学依据。
1 材料与方法
1.1 材料及试剂
1.1.1 供试材料 自然干燥的野生扁蕾全草,于2011年采自大兴安岭漠河(经度:124°07′ E,纬度:53°42′ N,海拔高度:576 m),经黑龙江大兴安岭地区农业林业科学院鉴定为龙胆科植物扁蕾,标本保存于中科院植物所植物园。
1.1.2 试 剂 乙腈和甲醇(色谱纯)购于北京先明乐施科技发展有限公司;三氟乙酸(≥99%)购于德国Merck 公司(Darmstadt, Germany);甲醇(分析纯)和甲酸(分析纯)购自北京化工厂;HPLC 级水由Milli-Q 超纯水系统(Millipore, Billerica,MA,USA)制备;黄酮醇标准品:芦丁(纯度91.7%)购自中国药品生物制品检定所。
1.2 化学成分提取
称取扁蕾不同部位(花、叶、主茎、侧枝、根)干燥粉末3 份,每份约100.00 mg,溶于10 mL 甲醇(甲酸的抽提溶剂),超声提取30 min,离心(12 000 r/min,10 min),收集上清液。提取3 次后合并滤液,依次用滤纸及0.22 μm 的滤膜过滤。
1.3 定性分析及结构鉴定
采用Agilent 1100 LC/MSD Trap VL 液质联用仪(HPLC-ESI-MSn)进行口山酮类化合物定性分析。色谱条件为:采用TSK gel ODS-80Ts QA(150 mm×4.6 mm,5 μm i.d.,Tosoh,Tokyo,Japan) 色谱柱,流动相组成:A 相为10%甲酸-水溶液;B 相为乙腈溶液,洗脱梯度为:0 min,10%B→20 min,22%B→65 min,60%B→70 min,10%B,检测波长:330 nm,流速:0.8 mL/min,进样量:10 μL,柱温:25℃。质谱电离源采用电喷雾电离(ESI),分别在正离子和负离子模式下进行全扫描,扫描范围:(m/z)100~1 000 μ。正离子模式下的质谱分析条件为:氮气作为干燥和喷雾气体,干燥温度:350℃,氮气流速:6.0 L/min,喷雾器压力:241.3 KPa;毛细管电压:3 500 KV,毛细管出口电压:140 V;八级射频电压振幅:150 Vpp;skim 1 电压:55.6 V,skim 2 电压:6.0 V;cap exit offset:84.4 V。负离子模式下,参数设定值不同的为:毛细管出口电压:-127.3 V;skim 1 电压:-47.7 V,skim 2 电压:-6.0 V;cap exit offset:-79.6 V。用LC/MSD Trap 软件(5.2 版本)分析不同模式下的质谱数据。
1.4 定量分析
采用Dionex HPLC 系统对扁蕾中不同部位的化学成分进行定量分析。该系统包括P680 泵、TCC-100 自动控温柱箱、PDA-100 光电二极管阵列检测器及变色龙色谱工作站(Chromeleon,6.60版本)。色谱条件与化合物定性分析一致。利用标准品芦丁分别对各化合物进行相对定量分析,重复3次,单位为每g 干燥扁蕾中含有的化合物mg 数。计算不同部位的各个组分含量,比较各部位之间不同化学成分的组成差异。
2 结果与分析
2.1 扁蕾化学成分的定性分析
利用HPLC-ESI-MSn 从扁蕾全株样品中检测出11 种主要化合物成分(图1),各化合物的紫外可见吸收光谱和质谱数据如表1 所示。依据样品HPLC 分析的保留时间、洗脱顺序、紫外-可见吸收光谱和质谱信息,通过与参考文献比较推定了各化合物的结构[5]。其中,正离子模式下的质谱数据为化合物的结构解析提供了更多信息。
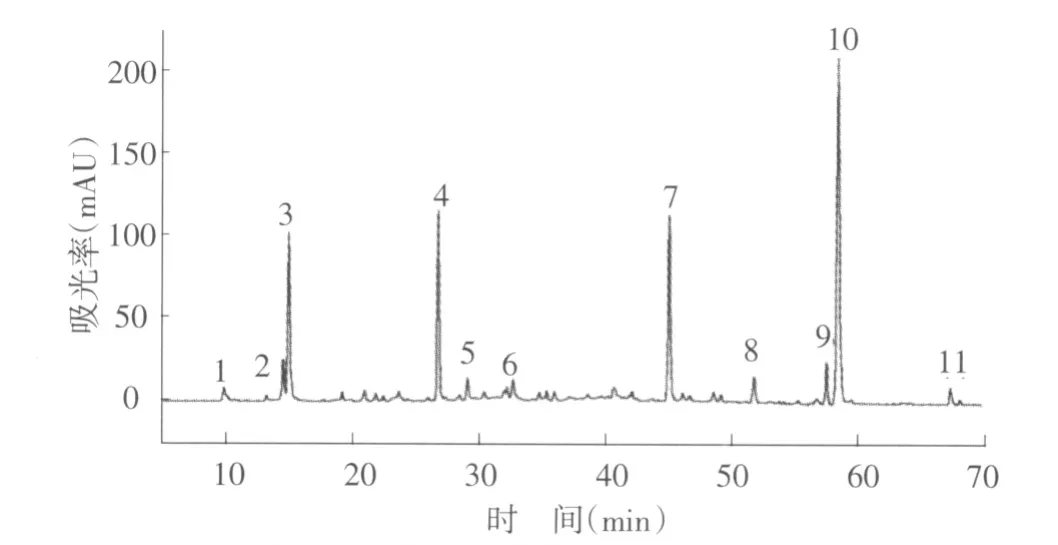
图1 扁蕾全株化学组成成分HPLC 图谱
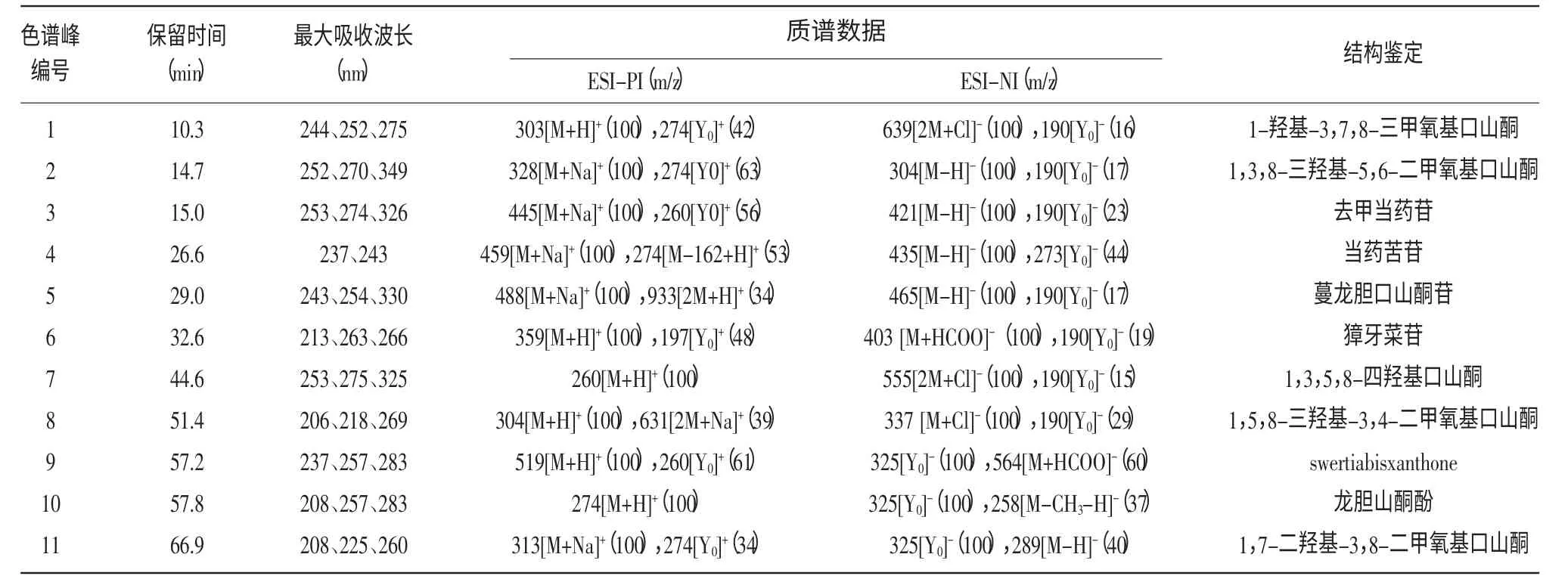
表1 扁蕾中化学成分的紫外-可见吸收光谱及ESI-质谱数据
组分1 在紫外吸收光谱中的最大吸收波长为244、252、275 nm,为较典型的口山酮特征吸收。正离子模式下检测到分子离子m/z 303([M+H]+)和苷元碎片离子m/z 274([Y0]+),负离子模式下检测到碎片离子m/z 639([2M+Cl]-),它与湿生扁蕾中的1-羟基-3,7,8-三甲氧基口山酮的裂解特征相同,因此推定组分1 为1-羟基-3,7,8-三甲氧基口山酮[6]。
组分2 在正离子模式下检测到高丰度的加钠分子离子m/z 328([M+Na]+),负离子模式下检测到分子离子m/z 304([M-H]-),且碎片离子信息与文献报道一致[7],由于缺乏更多的结构信息,暂推定组分2 为1,3,8-三羟基-5,6-二甲氧基口山酮。
组分3 在正离子模式下检测到高丰度的加钠分子离子m/z 445([M+Na]+),负离子模式下检测到分子离子m/z 421([M-H]-),m/z 260 是苷元1,3,5,8-四羟基口山酮的特征质荷比[13]。其与去甲当药苷的裂解特征相同,结合紫外数据,推定组分3 为去甲当药苷,质谱信息和结构图如图2(a)所示[8]。
组分4 在正离子模式下检测到苷元碎片离子m/z 274([M-162+H]+)及高丰度的加钠分子离子m/z 459([M+Na]+),负离子模式下检测到去质子分子离子m/z 273([Y0]-)和m/z 435([M-H]-),分子量是在苷元碎片离子(m/z 274)的基础上加上一个己糖的分子量(162 u),再结合紫外可见吸收光谱数据,推定组分4 为当药苦苷[9],质谱信息和结构图如图2(b)所示。
组分5 在正离子模式下得到加纳分子离子m/z 488([M+Na]+),负离子模式检测到显著的分子离子m/z 465([M-H]-),且紫外光谱在243、254、330 nm处出现特征吸收,结合文献报道,推定组分5 为蔓龙胆口山酮苷[10]。
组分6 的紫外光谱在263 nm、266 nm 处出现肩峰,为环烯醚萜苷类化合物的特征吸收峰,正谱数据为分子离子m/z 359([M+H]+)及苷元原子m/z 197([Y0]+),负谱数据为m/z 403([M+HCOO]-)及碎片离子m/z 190([Y0]-),与文献中獐牙菜苷的数据一致,因此,推定组分6 为獐牙菜苷[11]。
组分7 的质谱数据为正离子模式下高丰度分子离子m/z 260([M+H]+),m/z 260 是1,3,5,8-四羟基口山酮的特征质荷比[12]。负离子模式下也检测到碎片离子m/z 555([2M+Cl]-),结合紫外吸收数据,推定峰7 为1,3,5,8-四羟基口山酮,质谱信息和结构图如图2(c)所示。
组分8 的紫外吸收为206、218、269 nm,可知组分8 为口山酮类化合物的五氧取代类型,正离子模式下含有碎片离子m/z 631([2M+Na]+)和分子离子m/z 304([M+H]+),负离子模式下检测到m/z 337([M+Cl]-)。口山酮类化合物若只有羟基和甲氧基取代,其不饱和度为10,故推测其分子组成为C15H12O6,通过与文献的光谱数据进行比较,可推定峰8 为1,5,8-三羟基-3,4-二甲氧基口山酮[13]。
峰9 正离子模式下检测到显著的分子离子m/z 519([M+H]+),负离子模式下也检测去质子分子离子m/z 564([M+HCOO]-)和碎片离子m/z 325([Y0]-),紫外最大吸收为237、257、283 nm,峰9 的质谱信息与从大籽獐牙菜分离到的新口山酮类化合物Swertiabisxanthone 一致,由于缺乏更多的信息,暂推定组分9 为Swertiabisxanthone[14-15]。
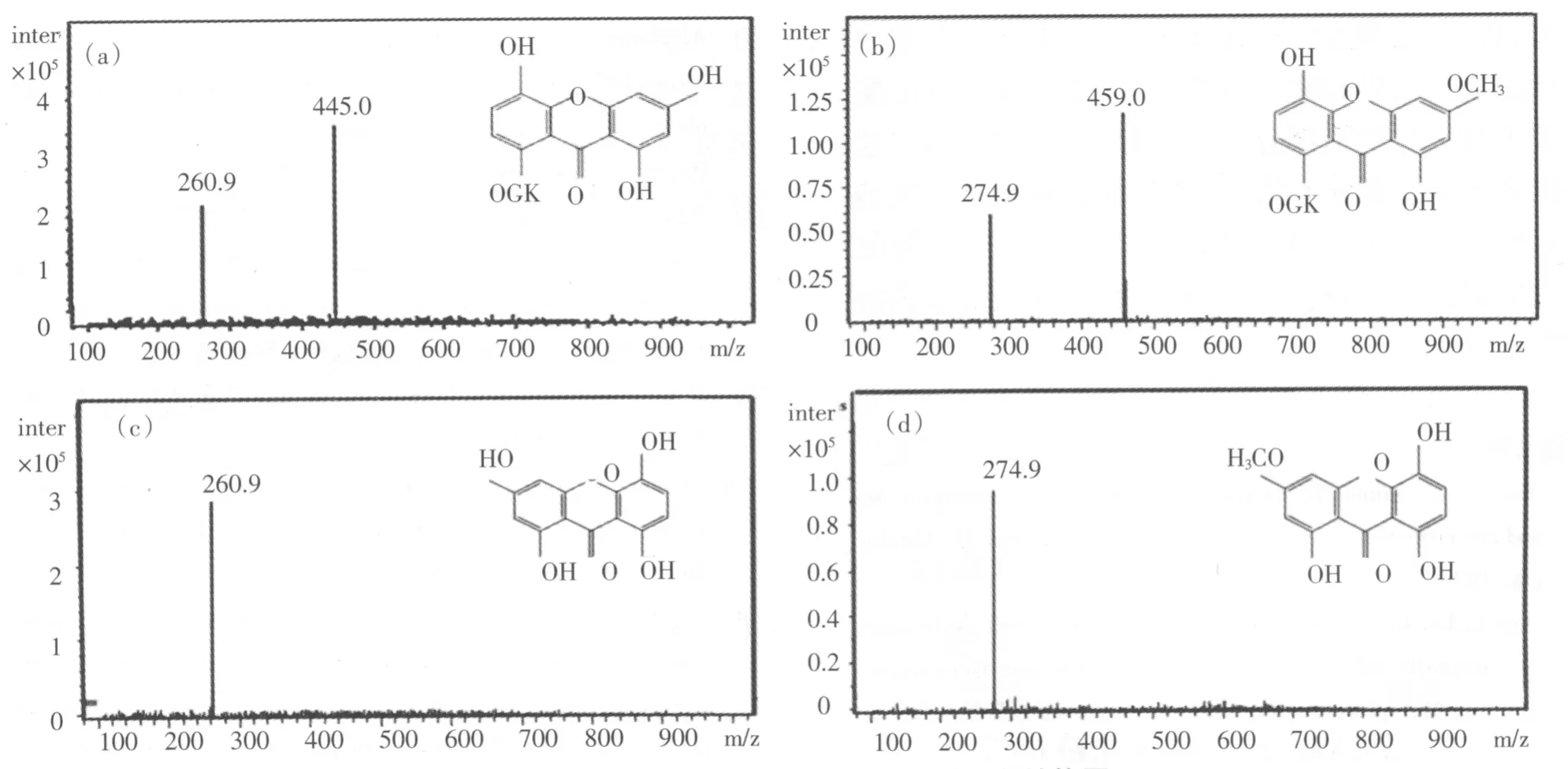
图2 扁蕾中4 种主成分的正谱质谱图和结构图
组分10 正离子模式下检测到显著的分子离子m/z 274([M+H]+),负离子模式下检测到去甲基碎片离子m/z 258([M-CH3-H]-),m/z 274 是龙胆山酮酚的特征质荷比,再结合其在色谱柱中的洗脱顺序和紫外可见吸收光谱数据,故确定组分10 为龙胆山酮酚[15],质谱信息和结构图如图2(d)所示。
组分11 在紫外吸收光谱中的最大吸收波长为208、225、260 nm,且为口山酮类化合物的四氧取代类型。正离子模式下检测到加纳分子离子峰m/z 313([M+Na]+)和碎片离子m/z 274([Y0]+),负离子模式下检测到苷元离子m/z 289([M-H]-),与文献的光谱数据进行比较,推定组分11 为1,7-二羟基-3,8-二甲氧基口山酮[2,16]。
2.2 扁蕾不同部位中化合物定量分析
扁蕾不同部位化合物的含量差异如表2 所示。其中去甲当药苷、当药苦苷、1,3,5,8-四羟基口山酮和龙胆山酮酚为扁蕾的4 种主要组成成分。扁蕾各部位的口山酮类化合物总含量的分布状态为:花>叶>侧枝>主茎>根,含量最多的为花器官,根中含量很低。
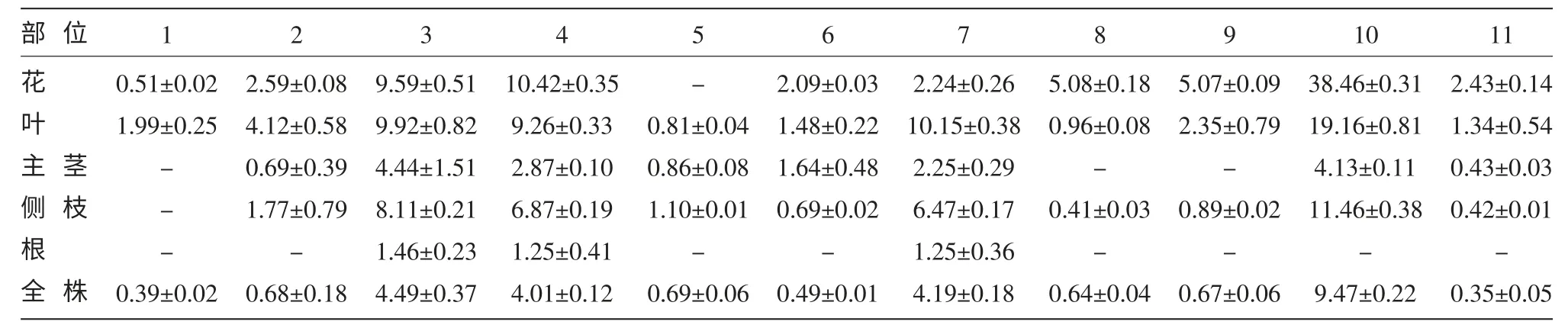
表2 扁蕾不同部位的组成成分分析 (mg)
3 小结与讨论
通过高效液相色谱-质谱联用技术(HPLCESI-MSn)检出了大兴安岭地区产传统蒙药扁蕾不同部位的化学成分共11 种化合物,其中9 种化合物首次从扁蕾中检测到。扁蕾不同部位的化合物定量分析结果表明,检出的11 种化合物中,去甲当药苷、当药苦苷、1,3,5,8-四羟基口山酮和龙胆山酮酚为扁蕾的4 种主要组成成分;口山酮类总含量分布状态为:花>叶>侧枝>主茎>根,地上部分口山酮种类丰富,与地下部分化学成分存在显著差异,建议以扁蕾地上部分入药。这为阐明将扁蕾开发成治疗药物及应用的最佳药用部位提供了客观可靠的理论依据,为该药材的品质评价和开发利用提供科学参考。
[1]Yuan Y M, Küpfer P.Karyological Studies of Gentianopsis Ma and Some related genera of Gentianaceae from China[J].Cytologia., 1993, 58:115-123.
[2]Ding L, Liu B, Qi L L, et al.Anti-proliferation, cell cycle arrest and apoptosis induced by a natural xanthone from Gentianopsis paludosa Ma, in human promyelocytic leukemia cell line HL-60 cells[J].Toxicol.in Vitro, 2009, 23:408-417.
[3]王焕弟,谭成玉,杜昱光,等.藏药湿生扁蕾的化学成分研究[J].中国中药杂志,2004,29(11):1055-1056.
[4]李作平,霍长虹,郑小莉.扁蕾化学成分的研究[J].中国现代应用药学,2003,20(1):24-25.
[5]Yang L G, Wang Y, Wang L X.et al.Rapid quantication of iridoid glycosides analogues in the formulated Chinese medicine Longdan Xiegan Decoction using high-performance liquid chromatography coupled with mass spectromentry[J].J.Chromatogr.A, 2009, 1216:2098-2103.
[6]米 琴,曹长年,赵宙兴,等.藏药湿生扁蕾有效成分的研究[J].青海师范大学学报(自然科学版),2005,(2):64-66.
[7]Aberhama A, Pieri V, Croom Jr.E.M.et al.Analysis of iridoids,secoiridoids and xanthones in Centaurium erythraea, Frasera caroliniensis and Gentiana lutea using LC-MS and RP-HPLC[J].J.Pharm.Biomed.Anal., 2011, 54:517-525.
[8]Urbain A, Marston A, Marsden-Edwardsb E.et al.Ultra-performance Liquid Chromatography Time-of-flight Mass Spectrometry as a Ch emotaxonomic Tool for the Analysis of Gentianaceae Species[J].Phytochem.Anal.2008, 20:134-138.
[9]许旭东,杨峻山.毛獐芽菜苷口山酮化学成分研究[J].中国药学杂志,2005,9:657-659.
[10]Hideaki O.Triptexanthosides A-E: Xanthone glycosides from aerial parts of Tripterospermum japonicum[J].Chem.Pharm.Bull., 1999, 47(7):962-965.
[11]Ye J, Zhang X, Dai W X.et al.Chemical fingerprinting of Liuwei Dihuang Pill and simultaneous determination of its major bioactive constituents by HPLC coupled with multiple detections of DAD, ELSD and ESI-MS[J].J.Pharm.Biomed.Anal., 2009, 49:638-645.
[12]周 青,陈家春,刘焱文.贵州獐牙菜化学成分研究[J].中药材,2004,27(12):908-910.
[13]Qiao X, Ye G, Liu C F.et al.Chemical analysis of Eriocaulon buergerianum and adulterating species by high-performance liquid chromatography with diode array detection and electrospray ionization tandem mass spectrometry[J].J.Pharm.Biomed.Anal.,2012, 57:133-142.
[14]Zhou H, Liu Y L, Blasko G.et al.Swertiabisxanthone-I from swertia –macrosperma[J].Phytochem., 2008, 12:3569-3571.
[15]Li M H, Li L, Yang Y M.et al.Genus Gentianella moench: a phytochemical and ethnopharmacological review[J].Chinese Herbal Med., 2010, 2(4):262-271
[16]Wang Z G, Ma C M, Tang S H.et al.Qualitative and quantitative analysis of swertia herbs by High Performance Liquid Chro -matography-Diode Array Detector-Mass Spectrometry (HPLCDAD-MS)[J].Chem.Pharm.Bull., 2008, 56(4):485-490.
