双齿围沙蚕对饲料中氮元素的利用及其与体质量和温度的关系
2012-09-25王玲周一兵杨大佐袁秀堂
王玲,周一兵,杨大佐,袁秀堂
(1.集美大学水产学院 福建省高校水产科学与食品安全重点实验室,厦门 361021;2.大连海洋大学 辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁 大连 116023;3. 国家海洋环境监测中心,辽宁 大连 116023)
水域生态环境中的有机物污染问题已制约着中国水产养殖业的可持续发展,研究有效去除养殖环境污染的方法,尤其是去除养殖滩涂沉积有机物污染的方法,尽快恢复和优化养殖环境,对中国海水养殖业的健康发展以及滩涂、浅海和湿地资源的可持续利用具有重要的理论和现实意义。目前,在环境研究领域,国际上有关多毛类生物学研究的焦点多集中在作为海洋污染底质原位生物修复的重要类群和测试生物上[1-8]。其原理就是充分利用底栖多毛类沉积食性的生态功能及其对有机物的利用,使环境中过量积累的生源要素转化为生物生产力。双齿围沙蚕Perinereisaibuhitensis广泛分布于沿海滩涂。作为有机污染底质原位生物修复类群,研究双齿围沙蚕对海洋沉积质中有机污染物的吸收、转化等生物利用特征和清除效应,可为中国典型海域富营养化的沉积环境生态修复研究提供依据。
氮是水环境污染的主要元素之一,又是蛋白质的特征元素,其收支状况与水生动物的蛋白质代谢过程密切相关。氮收支组分包括摄食氮、粪便氮、排泄氮和累积氮。其中氮累积关系到养殖生物的产量,是水产养殖中最被关注的问题,水生动物排出的粪便氮和排泄氮对养殖环境会直接产生影响。本研究中,作者研究了双齿围沙蚕对饲料中氮元素的利用及其与体质量和温度的关系,以期为养殖滩涂和近岸浅海原位生物的修复提供参考,同时也为双齿围沙蚕的健康养殖模式的建立提供基础资料。
1 材料与方法
1.1 材料
试验用双齿围沙蚕采自大连市庄河海域。在玻璃水族箱(70 cm×50 cm×50 cm)底部覆盖约10 cm厚的细沙作为双齿围沙蚕生活的底质。试验用海水取自大连市黑石礁海域,经沉淀砂滤后使用,水族箱水深30 cm。试验期间,盐度为31~32,保持连续充气,并以控温仪(HXSWT-100)调控试验所需的水温。
试验饲料为山东升索渔用饲料研究中心提供的S号牙鲆配合饲料,其粗蛋白、粗脂肪、粗灰分和水分的质量分数(除水分外均为干物质)分别为54.25%、11.06%、14.66%和6.64%。
1.2 方法
1.2.1 试验设计 试验按沙蚕体质量(湿重)分为3组:(0.40±0.19)、(1.00±0.22)、(2.00±0.50)g,分别记为S、M和L组,将3组沙蚕分别放入铺有底质的玻璃水族箱中,每箱放养200尾,每组设置3个重复。试验设置16、20、24 ℃ 3个温度梯度,初始水温为12 ℃。将双齿围沙蚕暂养7 d后,每天升温1 ℃至试验设置水温,然后再让双齿围沙蚕适应7 d后开始正式试验。
1.2.2 试验管理 试验期间仿照海区潮汐的变化,每天6:00和17:00换水两次,放水和加水之间干露1 h。每天早上换水前过量投喂牙鲆配合饲料,投喂量为双齿围沙蚕湿重的10%。
1.2.3 样品的收集
1)粪便样品。为提高收集粪便的效率,减少粪便营养成分在水中的溶失,本试验中沙蚕粪便的收集在广口瓶中进行。具体操作如下:从底质中取出沙蚕,放入500 mL广口瓶中,3~5尾/瓶,每箱放4个广口瓶,广口瓶在水族箱中水浴维持试验设定温度,待其有粪便排出立即用虹吸管收集,于65 ℃下烘干保存,待测。
2)饲料样品。取饲料100 g在65 ℃下烘干至恒重保存,待测。
3)沙蚕样品。取肠道已排空的双齿围沙蚕15尾,65 ℃下烘干保存,待测。
1.2.4 氮含量的测定 分别将沙蚕、饲料和粪便样品研碎混匀,用元素分析仪(Pekin-Elmen 240C)分别测定样品中的氮含量。测定结果表明:沙蚕和饲料干物质中的氮含量分别为9.85%和8.68%;各试验组沙蚕粪便干物质的氮含量平均为5.06%,变异范围为3.39%~6.88%。
1.2.5 氮摄食率的测定 双齿围沙蚕对饲料氮的摄食率采用刘健康[9]、王诗红等[10]报道的间接法测定。
当水温达到试验温度后,待沙蚕适应7 d开始肠道容量测定的试验。在投喂饲料2 h后,分别从每箱挑选出4尾肠道饱满的虫体,放入500 mL广口瓶中(1尾/瓶),在水族箱中水浴维持试验温度,待其有粪便排出后,分别用虹吸管收集至无粪便排出。试验过程中记录每条沙蚕粪便完全排出所用时间t(h)。将双齿围沙蚕和粪便在65 ℃下烘干至恒重,分别计算单位虫体干质量沙蚕排出的粪便干重A(mg/g)。
双齿围沙蚕(按虫体干质量计)对氮的摄食率CN( mg/(d·g))的计算公式为
CN=24At(1-Ab)×N饲料×1000,
式中:Ab为双齿围沙蚕对饲料的表观消化率(%),具体测定参见王玲等[11]的方法;N饲料为饲料中氮的含量。
1.2.6 饲料中粗蛋白溶失率的测定 在测定双齿围沙蚕对氮的摄食率的同时,还需测定试验饲料在相同条件下2 h内粗蛋白的溶失率。水温达到试验温度后,在水族箱中放入盛有50 g试验饲料的培养皿2个(直径为90 mm),分别在1 h和2 h后取出烘干至恒重,用凯氏定氮法测定其粗蛋白的含量。
1.2.7 氮收支方程的计算 用奈氏试剂法测定氮的排泄率(UN)[12]。
氮的排粪率(FN)根据粪便中氮含量和排粪量计算得出[8]。
氮的累积率(PN)根据收支方程计算:
PN=CN-UN-FN。
2 结果
2.1 双齿围沙蚕对氮的摄食率
不同体质量双齿围沙蚕于16、20、24 ℃下对饲料中氮的摄食率见表1。从表1可见:各体质量组沙蚕对氮的摄食率在16 ℃时均为最低,平均为8.4 mg/(d·g),变幅为6.6~10.5 mg/(d·g);20 ℃时不同体质量的沙蚕摄食率均达到最大,平均为17.0 mg/(d·g),变幅为14.3~22.0 mg/(d·g);当温度升至24 ℃时,沙蚕对氮的摄食率开始降低,平均为14.5 mg/(d·g),变幅为12.0~18.7 mg/(d·g)。
不同温度下,沙蚕对氮的摄食率均随体质量的增加而降低,沙蚕对氮的摄食率大小依次为S组>M组>L组,其中,S组为10.5~22.0 mg/(d·g);M组和L组则分别为8.0~14.7 mg/(d·g)和6.6~14.3 mg/(d·g)。
根据上述结果,以沙蚕干质量为区组变量,温度为分组变量,沙蚕干质量对氮的摄食率为观测数据变量,经双因素方差分析表明,温度和体质量对氮的摄食率的影响差异均极显著(F=79.125,P<0.001;F=34.308,P<0.001)。
双齿围沙蚕在不同温度下对饲料中氮的摄食率可用幂函数关系式表示:
CN=aWb。
式中:CN为沙蚕单位体质量(干重)每日摄入氮的质量( mg/(d·g));W为沙蚕个体干质量(g);a的生物学意义为个体单位质量的沙蚕对氮的摄食率,在20 ℃时最高,为10.618;b为单位体质量氮的摄食率随体质量增加的降低比率,变幅为-0.2076~-0.1911。从表2可见:各温度下双齿围沙蚕对氮的摄食率与体质量之间相关关系均显著。
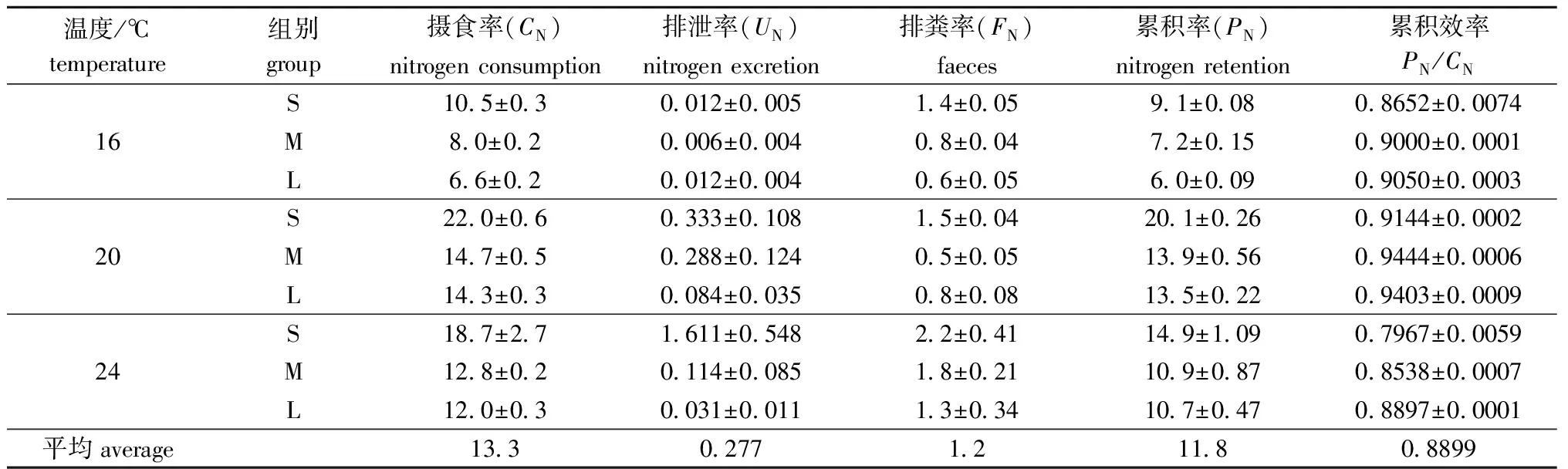
表1 不同温度下双齿围沙蚕对氮的摄食率、排泄率、排粪率、累积率和累积效率(平均数±标准误,n=12)
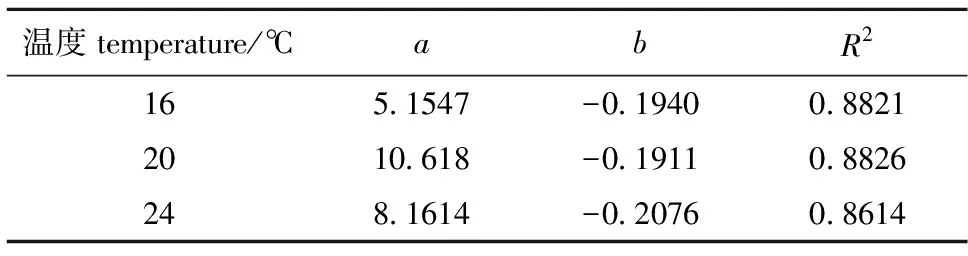
表2 不同温度下双齿围沙蚕体质量与氮的摄食率的关系
2.2 双齿围沙蚕摄食氮的分配
双齿围沙蚕各体质量组于不同温度下对氮的摄食率(CN)、排泄率(FN)、排粪率(UN)和累积率(PN)如表1所示。经双因素方差分析,温度对双齿围沙蚕氮的摄食率、排泄率、排粪率、累积率和累积效率均有显著影响(F=79.125,P<0.001;F=5.143,P=0.013;F=48.884,P<0.001;F=135.166,P<0.001;F=434.773,P<0.001),体质量对双齿围沙蚕氮的摄食率、排泄率、排粪率、累积率和累积效率均有显著影响(F=34.308,P<0.001;F=5.973,P=0.007;F=43.331,P<0.001;F=49.944,P<0.001;F=158.051,P<0.001)。本试验条件下,双齿围沙蚕对氮的累积率平均为11.8 mg/(d·g),在20 ℃时达到最高,S、M、L组对氮的累积率分别为20.1、13.9、13.5 mg/(d·g);在试验条件下,双齿围沙蚕对氮的累积效率(PN/CN)平均为88.99%。
2.3 双齿围沙蚕的氮收支方程
根据表1中双齿围沙蚕对氮的摄食率、排粪率、排泄率和累积率,设摄食的氮为100%,计算其它各组分比例,建立了16、20、24 ℃ 下不同体质量组双齿围沙蚕对饲料中氮的收支情况(表3)。
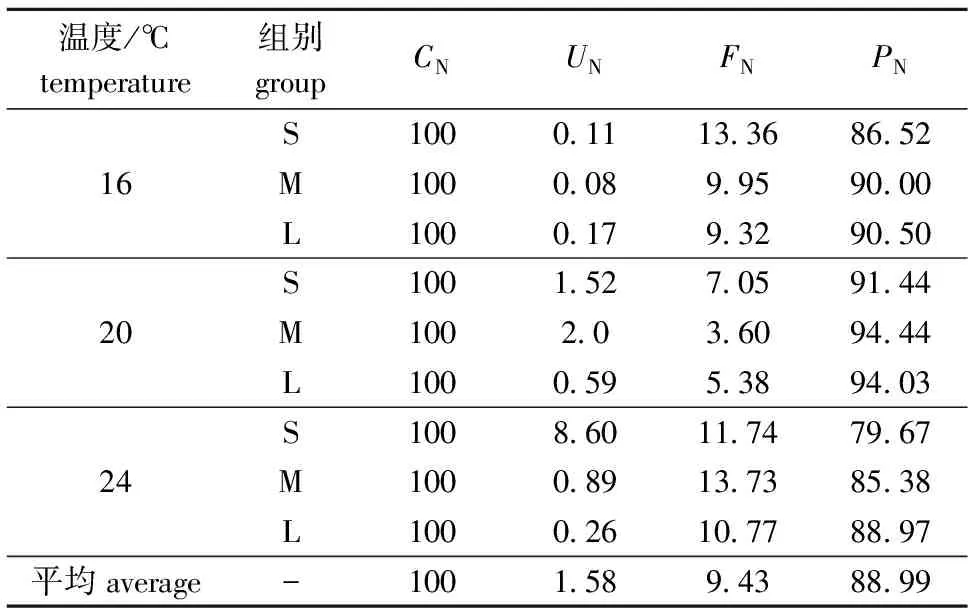
表3 双齿围沙蚕的氮收支
从表3可见,在双齿围沙蚕摄食氮的分配中,氮的累积率所占的比例最大,氮的排粪率次之,而氮的排泄率所占的比例最小。20 ℃ 时双齿围沙蚕氮累积率占摄食氮的比例达到最大,S、M、L组分别为91.44%、94.44%和94.03%;排粪氮占摄食氮的比例在20 ℃ 时最小,而排泄氮的比例在20 ℃ 时则最大。在本试验条件下,双齿围沙蚕的氮收支方程为100CN=88.99PN+1.58UN+9.43FN。
3 讨论
3.1 温度和体质量对双齿围沙蚕氮摄食率的影响
双齿围沙蚕营底栖生活,属非即时性摄食,直接测定其摄食率比较困难。作者综合已报道的对鱼类摄食率和多毛类沙蚕摄食率的研究方法[9-10],采用间接法测定双齿围沙蚕的摄食率。结果表明,16~24 ℃ 时双齿围沙蚕对氮的摄食率为6.6~22.0 mg/(d·g),20 ℃ 时摄食率最大,为14.3~22.0 mg/(d·g)。结合其代谢适宜温度[12],可以推断本试验条件下,20 ℃ 是双齿围沙蚕的最适摄食温度。 Honda等[8]报道了0.2~0.6 g的Perinereisnuntiavallata在20 ℃ 时对日本褐牙鲆Paralichthysolivaceus粪便的摄食率为每虫体4.9~25.7 mg/d;刘勇等[13]的研究表明,日本刺沙蚕Neanthesjaponica在17~29 ℃ 时对人工饲料中氮的摄食率为4.23~7.87 mg/(d·g)。显然,底栖动物的摄食率与动物的种类及发育阶段、饵料种类和环境条件等密切相关[14-15],沙蚕对食物氮摄取的差异亦可能是由于种类、个体大小、食物不同所致。
在本试验温度范围内,沙蚕对饲料中氮的摄食率均随体质量增加而减小,两者之间呈幂函数关系CN=aWb,其中b值变动于-0.2076~-0.1911。Cammen[16]对沙蚕Nereissuccinea摄食率的研究结果亦表明,随着体质量的增加,其摄食率呈下降趋势。这种现象普遍存在于鱼类和其它水生无脊椎动物中[16-20]。这是由于幼体的代谢强度较高、能量消耗较大、食欲相对较旺盛所致。沙蚕对氮的累积率亦反映出上述同样规律,本试验结果表明,在同一温度下,随着双齿围沙蚕体质量的增加,对氮的累积率也呈下降趋势。
3.2 温度和体质量对双齿围沙蚕氮累积的影响
氮的累积率和累积效率是衡量沙蚕对蛋白质利用的重要指标,其变化趋势与动物生长的变化趋势是一致的。氮的累积率和累积效率亦受多种因素影响。温度是影响水生动物生长的一个重要因子[13,21-22]。本试验结果表明,20 ℃ 下各体质量组沙蚕对氮的累积率和累积效率均高于16 ℃ 和24 ℃,说明该温度应是双齿围沙蚕的最适温度。另外,水生动物对氮的累积率还与个体大小有关[23-24]。本试验结果表明,在同一温度下,随着体质量的增加,双齿围沙蚕对氮的累积率呈下降趋势。这与小个体动物生长快,对蛋白质的需要量高有关[25-26]。
研究表明,不同种类的水生动物对氮的累积效率存在较大的差异。李军等[27]报道,黑鲷Sparusmacrocephalus幼鱼在14.8~26.8 ℃ 下摄食玉筋鱼的氮累积效率为5.81%~34.20%。Du等[28]对草鱼Ctenopharyngodonidella幼鱼的研究表明,在22~26 ℃ 时,每天投喂体质量1.0%~3.0%的人工饲料,草鱼幼鱼对氮的累积效率为16.70%~32.68%。张硕等[18]报道,20~30 ℃ 下中国对虾摄食沙蚕的氮累积效率为18.53%~34.78%,摄食配合饲料的氮累积效率为8.47%~26.06%。然而,日本刺沙蚕Neanthesjaponica在25 ℃ 时对人工饲料氮的累积效率为65.45%[29]。Perinereisnuntiavallata在20 ℃ 时对日本褐牙鲆Paralichthysolivaceus粪便、饲料以及沙蚕饲料中氮的累积效率分别为46.3%、47.4%和53.7%[8]。本试验中,各体质量组双齿围沙蚕摄食牙鲆人工合成饲料的氮累积效率平均为88.99%(表3)。由此可见,沉积食性多毛类沙蚕较鱼、虾等水生动物具有较高的蛋白质转化效率,体现了沙蚕这一类底栖动物在沉积环境中所具有的生物修复潜力。
3.3 双齿围沙蚕的氮收支方程与误差分析
在本试验条件下,双齿围沙蚕的氮收支方程为100CN=88.99PN+1.58UN+9.43FN。已有报道表明,0.2~0.6 g的Perinereisnuntiavallata在20 ℃ 时摄食日本褐牙鲆Paralichthysolivaceus粪便的氮收支方程为100CN=62.8PN+16.2UN+21.0FN[8];1.425 g的日本刺沙蚕在盐度为15~35时摄食人工配合饲料的氮收支方程为100CN=49.01PN+42.45UN+8.54FN[29]。由此可见,在沙蚕的氮收支方程中,生长组份均大于其它组份,代谢和粪便中氮的含量较少,这可能是与其生活环境有关。自然环境下沙蚕在浅海营底栖穴居生活,活动能力较弱,代谢水平较低;食物来源是其洞穴附近的沉积质,而这些沉积质中泥沙占主要成分,在长时间的环境适应下,多毛类大量吞食沉积物并增加吸收转化效率来获得较多的营养物质,以满足其正常的生长需要[5-6]。
比较已报道的其它沙蚕的氮收支方程,本试验中所得的双齿围沙蚕对配合饲料的氮累积效率较高,这可能与试验方法不同有关。本试验中是用生长预算差减法测得沙蚕对饲料氮的累积效率,饲料和粪便在水中溶失,可能会高估其表观消化率。Honda等[8]通过实测生长的方法,得到Perinereisnuntiavallata在20 ℃ 时对日本褐牙鲆的粪便的累积效率为46.3%,但通过生长预算差减法测得对牙鲆粪便的氮累积效率则为62.8%,较实测值高出16.5%。为减少试验误差,在本试验中及时收集粪便,可最大程度地降低粪便中物质的溶失。试验饲料粗蛋白溶失率的测定结果表明,2 h内的溶失率为1.7%~2.2%,若据此将文中数据进行校正,可降低氮累积效率0.5%左右。显然,饲料中氮的溶失会导致双齿围沙蚕的累积氮偏高,但影响不大。另一方面,沙蚕在穴居生活时体表会分泌大量黏液,其表皮细胞中存在许多腺细胞已为组织学观察所证明[30],因此认为,沙蚕代谢物中以黏液分泌形式的含氮排泄物可能也会导致高估其氮积累效率[8]。另外,饲料中较高的蛋白含量可能会促进动物对氮的摄入,这或许也是导致其氮积累效率偏高的原因之一。
3.4 双齿围沙蚕在生物修复中作用的评估
近年来,如何以较低的环境成本获得较高的水产养殖产量是海水养殖产业可持续发展面临的重要问题之一。沙蚕是典型的以沉积有机质为营养的沉积食性底栖动物。一些研究表明,利用其摄食习性可以有效去除近岸养殖水域的有机废物。据Honda等[8]报道,体质量为1 000 g的牙鲆摄食配合颗粒饲料(按体质量的1.5%),24~96 h后排出的粪便相当于摄食量的12.7%,即1.9 g粪便,将这些粪便完全处理,需要100~150条沙蚕(按0.4~0.6 g/尾计)。由表1可见,在16~24 ℃ 条件下,双齿围沙蚕对氮的累积率平均为11.8 mg/(d·g),积累效率平均为88.99%。这意味着在上述条件下,每克沙蚕平均每日可消耗沉积质中13.30 mg氮,或每克氮可带动生产约73.3 mg的沙蚕。近年来,中国海水鱼类网箱养殖和浅海浮筏贝类养殖发展极为迅速,但海水养殖对沿岸水域环境及其底质也产生了重大影响。据Hall等[31]报道,每生产1 t鲑就有92~102 kg的氮溶失到养殖水环境中去,其中有40%的氮以颗粒物形式输入沉积质(36.8~40.8 kg),如全部被沙蚕所摄取,则每吨鱼产生的废弃氮可带动生产212.1~236.2 kg的沙蚕。同样的情况亦存在于许多筏式贝类养殖区,由滤食性贝类粪便和假粪形成的生物性沉降作用非常显著[32-33]。研究表明,贝类养殖海区颗粒物质的年平均沉降速率为278.8 g/(m2·g),而每克颗粒物质携带190.4 μg氮沉入海底,即氮的沉降速率为53 g/(m2·g),由此,可带动约305.52 g/m2沙蚕的生产。显然,沙蚕对养殖过程中产生的有机残饵中的营养元素具有较好的去除效果,以底栖多毛类沙蚕作为滩涂、浅海富营养化沉积环境的生物修复类群,可以有效地将底质中的有机氮转化为自身生产力,达到环境效益和经济效益的统一。
参考文献:
[1] Wang W X,Stupakoff L,Gagnon C,et al.Bioavailability of inorganic and methylmercury to a marine deposit-feeding Polychaete [J].Environ Sci Technol,1998,32:2564-2571.
[2] Penry D L,Weston D P.Digestive determinants of benzo[a]pyrene and phenanthrene bioaccumulation by a deposit-feeding polychaete [J].Environmental Toxicology and Chemistry,1998,17(11):2254-2265.
[3] Taghon G L.The benefits and costs of deposit feeding in the polycheateAbarenicolapacifica[J].Liminol Oceanogr,1988,33 (5):1166-1175.
[4] Taghon G L,Self R F L,Jumars P A.Predicting particle selection by deposit feeders:A model and its implication[J].Liminol Oceanogr,1978,23(4):752-759.
[5] Ahrens M J,Hertz J,Elizabeth M,et al.The role of digestive surfactants in determining bioavailability of sediment-bound hydrophobic organic contaminants to 2 deposit-feeding polychaetes[J].Marine Ecology Progress Series,2001,212:145-157.
[6] Ahrens M J,Hertz J,Elizabeth M,et al.The effect of body size on digestive chemistry and absorption efficiencies of food and sediment-bound organic contaminants inNereissuccinea(Polychaeta)[J].Journal of Experimental Marine Biology and Ecology,2001,263:185-209.
[7] Tsutsumi H,Montani S.Utilization of biological activities of capitellid polychaete for treatment of “hedoro” (organically enriched sediment) deposited on the marine bottom below fish net pen culture [J].Nippon Suisan Gakkaishi,1993,59(8):1343-1347.
[8] Honda H,Kikuchi K.Nitrogen budget of polychaetePerinereisnuntiavallatafed on the feces of Japanese flounder[J].Fisheries Science,2002,68 (6):304-308.
[9] 刘建康.中国科学院东湖生态系统试验站文集——东湖生态学研究(I)[M].北京:科学出版社,1990:295-296.
[10] 王诗红,张志南.日本刺沙蚕摄食沉积物的实验研究[J].青岛海洋大学学报,1998,28(4):587-592.
[11] 王玲,周一兵,刘海映,等.双齿围沙蚕(PerinereisaibuhitensisGrube)表观消化率及其与温度和体重关系的初步研究[J].大连水产学院学报,2008,23(6):431-436.
[12] 王玲,陈爱华,赵啸,等.温度和体重对双齿围沙蚕呼吸和排泄的影响[J].大连水产学院学报,2004,19(3):176-181.
[13] 刘勇,线薇薇.温度对日本刺沙蚕氮生长和氮收支的影响[J].水产科学,2010,29(6):311-316.
[14] Matti T,Leppänen,Jussi V,et al.Factors affecting feeding rate,reproduction and growth of an oligochaeteLumbriculusvariegatus(Müller) [J].Hydrobiologia,1998,377:183-194.
[15] Palomo G,Martinetto P,Iribarne O.Changes in the feeding behavior of the deposit-feeding polychaeteLaeonereisacutaon soft sediments inhabited by burrowing crabs[J].Marine Biology,2004,145:657-667.
[16] Cammen L M.A method for measuring ingestion rate of deposit feeders and its use with the polycheateNereissuccinea[J].Estuaries,1980,3 (1):55-60.
[17] 谢小军,孙濡泳.南方鲇的最大摄食率及其与体重和温度的关系[J].生态学报,1992,12 (3):225-231.
[18] 张硕,董双林,王芳.中国对虾(Penaeuschinensis)氮收支的初步研究[J].海洋学报,1999,21(6):81-86.
[19] Cui Y,Liu L.Comparison of energy budget among six teleosts.I.food consumption,faecal production and nitrogenous excretion[J].Comp Biochem Physiol,1990,96A:163-171.
[20] 江双林,赵从明,王彦怀,等.菲律宾蛤仔摄食率与温度、壳长和饵料浓度的关系[J].渔业科学进展,2009,30(4):78-83.
[21] Sun L,Chen H,Huang L.Effect of temperature on growth and energy of juvenile cobia(Rachycentroncanadum)[J].Aquaculture,2006,261:872-878.
[22] Thomas C W,Crear B J,Hart P R.The effect of temperature on survival,growth,feeding and metabolic activity of the southern rock lobster,Jasusedwardsii[J].Aquaculture,2000,185:73-84.
[23] Jobling M.Growth studies with fish-overcoming the problem of size variation[J].J Fish Biol,1983,22:153-157.
[24] 彭树锋,王云新,叶富良,等.体重对斜带石斑鱼能量收支的影响[J].水生生物学报,2008,32(6):934-940.
[25] 李爱杰.水产动物营养与饲料学[M].北京:中国农业出版社,1996:14-18.
[26] Bowen S H.Dietary protein requirements of fishes.A reassessment[J].Canadian Journal of Fisheries and Aquatic Science,1987,44:1995-2001.
[27] 李军,徐世宏,薛玉平.日粮水平对黑鲷幼鱼氮收支的影响[J].海洋与湖沼,1998,29(4):369-373.
[28] Du Z Y,Liu Y J,Tian L X,et al.The influence of feeding rate on growth,feed efficiency and body composition of juvenile grass carp (Ctenopharyngodonidella)[J].Aquaculture International,2006,14:247-257.
[29] 刘勇,线薇薇.日本刺沙蚕对饵料中氮的利用及其对盐度变化的响应[J].海洋湖沼通报,2009(2):33-41.
[30] 宋贞坪,李霞,王福景,等.双齿围沙蚕主要器官组织学的研究[J].大连海洋大学学报,2010,25(4):320-323.
[31] Hall P O J,Holby O,Kollberg S,et al.Chemical fluxes and mass balances in a marine fish cage farm.IV Nitrogen[J].Mar Ecol Prog Ser,1992,89:81-91.
[32] 杨红生,张福绥.浅海筏式养殖系统贝类养殖容纳量研究进展[J].水产学报,1999,23(1):84-89.
[33] 季如宝,毛兴华,朱明远.贝类养殖对海湾生态系统的影响[J].黄渤海海洋,1998,16(1):21-27.
