用壳聚糖絮凝法采收小球藻及上清液再利用的研究
2012-09-25张鹏李兴锐张永奎
张鹏,李兴锐,张永奎
(四川大学 化工学院制药与生物工程系,四川 成都 610065)
在生物能源和活性物质的开发中,微藻具有巨大的优势[1-3]。但在微藻的工业化开发中还存在许多瓶颈问题,如优良藻种的选育、培养模式的经济化、藻体采集及后续可用物质的分离和纯化等[4-5]。在工业化培养的藻种中,因小球藻富含蛋白质和油脂等成分,其工业化前景更加诱人。但由于小球藻在生长过程中悬浮于水面,采收过程中存在一些困难,因而使运行成本增加,影响了其工业化应用。
目前,采收小球藻的常用方法有絮凝法、过滤法、离心法和气浮法等,絮凝法具有操作简单、成本低廉的优点,可常与其它方法配合使用[1,4-5]。在絮凝法中,选择絮凝剂是关键。壳聚糖是一种常用的絮凝剂,具有絮凝效果好、絮凝物体积大、絮凝速率快和无二次污染等优点,因而广泛用于微藻的絮凝中[6-11]。在小球藻的絮凝采收中,国内外学者的研究大多集中于絮凝剂的选择上[6-8,12-13]。研究表明,壳聚糖对小球藻的絮凝效果较好[6,8,10],但关于絮凝后上清液的循环利用性能的研究较少[8,14-16]。在微藻工业化生产中,培养液的体积巨大,采集藻体后遗留的上清液若可循环利用,既可以节省培养成本,又可以简化上清液的后续处理操作,因而具有一定的经济意义。本研究中,作者在自制的气升式反应器中培养小球藻,研究了用壳聚糖作为絮凝剂采收小球藻后上清液的循环利用性能,同时研究了壳聚糖对采用多次循环上清液培养的小球藻的絮凝性能,旨在为工业化培养藻类的采收及其上清液的循环利用提供参考资料。
1 材料与方法
1.1 材料
试验用小球藻Chlorellavulgaris(藻种编号为FACHB—1072)购自中国科学院武汉水生研究所。壳聚糖购自上海伯奥生物科技有限公司,脱乙酰度≥90.0%,黏度为0.1 Pa·s。
试验仪器包括UV-1800PC分光光度计,TDL-5-A型低速台式离心机,85-2恒温磁力搅拌器等。
SE培养基的配制:将0.25 g NaNO3、0.075 g K2HPO4·3H2O 、0.075 g MgSO4·7H2O 、0.025 g CaCl2·2H2O 、0.175 g KH2PO4和0.025 g NaCl 溶于蒸馏水中,加入A5浸出液1 mL、土壤浸出液40 mL和Fe—EDTA液1 mL,定容至1 L。
A5浸出液的配制:将286 mg H3BO3、181 mg MnCl2·4H2O、22 mg ZnSO4·7H2O、7.9 mg CuSO4·5H2O、3.9 mg(NH4)6Mo7O24·4H2O 溶于蒸馏水中,并定容至100 mL。
土壤浸出液的配制:取未施过肥的花园土0.5 kg置于烧杯或三角瓶中,加入蒸馏水1 000 mL,瓶口用透气塞封口,在水浴中沸水加热2 h,冷却后,在无菌条件下过滤,取上清液。将灭菌蒸馏水加入上清液中至总体积为1 000 mL,于4 ℃下保存备用。
Fe-EDTA液的配制:将0.1 g Na2EDTA和8.1 mg FeCl3·6H2O分别溶于50 mL蒸馏水和50 mL的HCl(0.1 mol/L)中,然后混匀即可。
1.2 方法
1.2.1 新型循环模式的设计 每次循环分为4个步骤,具体操作方法如下:
1)在气升式反应器中培养小球藻。自制气升式反应器体积为3 L,装液量为2.5 L,通入空气流量为100 L/h。采用普通白炽灯光照,光照强度为3 000 lx,光照时间为24 h。第1次循环中藻液生长至稳定期,取出部分藻液进行后续操作,后4次循环中藻液在气升式反应器中的培养时间均为3 d。每天定时测定反应器中藻液的吸光度值ODi。
2)加入壳聚糖絮凝。取出反应器藻液体积的60%(1.5 L),测定藻液吸光度值ODa。利用醋酸调节藻液的pH为6.00,然后在每升藻液中加入10 mg壳聚糖,利用机械搅拌器以300 r/min搅拌3 min,搅拌后静止10 min,测量距液面2 cm处藻液的吸光度值ODb。
3)过滤分离藻体得上清液。使用慢速定量滤纸抽滤除去沉淀的絮体,得到上清液,取出适量体积的上清液,用于NO-3-N、PO3-4-P的测定。
4)在上清液中补加营养成分。向上清液中补加SE培养基,并用蒸馏水将上清液的体积补加至1.5 L(补加蒸馏水的体积低于0.1 L),不调节上清液的pH为7.00。
至此一个循环完成,然后将处理后的上清液加入气升式反应器中,再次进行小球藻的培养,如此循环4次。
1.2.2 分析方法 用紫外分光光度计在波长为680 nm处测定藻液浓度,用吸光度值OD表示小球藻藻液的浓度。采用何腊平等[16]的方法测定藻液中NO-3-N、PO3-4-P的浓度。
采用下列公式计算壳聚糖的絮凝效率(μ):
μ=ODa-ODbODa×100 %。
2 结果与分析
2.1 循环培养小球藻的生长曲线
从图1可见:在后4次循环培养中,小球藻的生长曲线基本类似,说明小球藻的生长速率基本相近,而且后4次循环收获期藻液的浓度与第1次藻液的浓度非常接近(表1)。可见利用壳聚糖作为絮凝剂,采用在过滤后的上清液中补加营养成分,然后再次作为培养液,对微藻的生长无抑制作用,说明上清液可以数次循环利用。
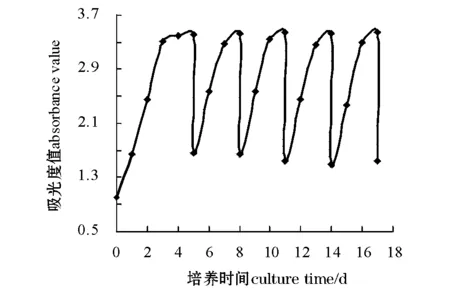
图1 小球藻的生长曲线Fig.1 Growth curve of alga Chlorella vulgaris
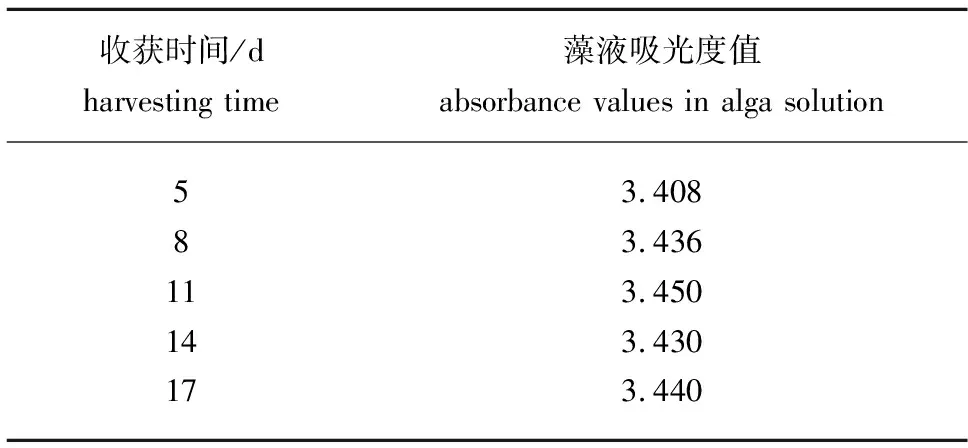
表1 5次循环收获期藻液的吸光度值(λ=680 nm)
据报道,微藻在生长过程中可以产生化感性物质,并将此物质排放至培养液中,对其它微藻产生抑制或刺激作用,从而影响其生长[17-19]。本试验中,利用上清液作为培养液循环培养小球藻5次,小球藻的生物量及生长速率均正常,对藻类的生长无明显抑制作用或刺激作用,这可能与藻体的采集及分离方式有关。虽然上清液中的化感性物质会在絮凝过程中富集,但可以随絮体一同被过滤掉,因而循环使用的上清液中化感性物质很少。在后4次的循环培养中,每次循环反应器中剩余的40%藻液可以作为下次循环培养的藻种,但藻种在长期培养过程中可能产生老化现象[14],影响藻种的生命活力。如果能接种新鲜的藻种,收获期藻液的浓度会更高,这样会延长上清液循环培养的周期。
2.2 壳聚糖对藻体的絮凝效率
在每次加入壳聚糖之前,需先利用醋酸调节藻液的pH为6.00,然后才能加入壳聚糖进行絮凝操作。据报道,藻液在不同的pH下具有不同ξ电位值,同时不同pH值对壳聚糖在藻液中的作用也有很大影响[13]。藻液pH为6.00左右时,藻体ξ电位值接近于零,而壳聚糖可以增加其分子链的带正电荷的氨基数量。根据絮凝电中和理论,藻液pH为6.00左右时,壳聚糖的使用量可以降低。每次循环收获期的藻液pH在8.00以上,而采用此方式得到的上清液呈酸性,在加入反应器后中可调节藻液的pH值接近中性,有利于藻体的生长。
5次循环絮凝操作中,壳聚糖的使用量均相同(10 mg/L藻液)。从图2可见,5次循环中壳聚糖的絮凝效率虽呈下降趋势,但絮凝效率均在95%以上。据报道,在同一个培养液中多次使用壳聚糖,会产生絮凝抑制现象,这与藻体生长中排放的物质有关[20-21]。但本试验中,壳聚糖均具有较高的絮凝性能,可能与培养液中抑制絮凝物质的浓度有关。

图2 5次循环壳聚糖的絮凝效率Fig.2 Efficiency of chitosan flocculation in five cycles
2.3 循环利用的上清液中NO-3-N和PO3-4-P含量的变化
在每次循环培养中都要补加营养成分,为微藻的生长和繁殖提供所需的营养物质。研究表明,微藻所需的营养物质存在一个最佳浓度范围,低于或高于此范围都会对微藻的生长产生抑制作用,甚至导致微藻死亡。在小球藻的培养中,NO-3-N、PO3-4-P浓度对其生长有较大的影响,故本试验中研究了5次循环培养中NO-3-N、PO3-4-P浓度的变化,为上清液中补加营养成分提供参考。
本试验中,SE培养基中初始NO-3-N、PO3-4-P的浓度分别为182、153 mg/L。从表2可见,在5次循环利用的上清液中,NO-3-N的浓度为21.2~28.3 mg/L,PO3-4-P的浓度为13.9~19.6 mg/L,变化范围不大。这说明藻体利用营养成分的能力基本不变,同时也说明在循环利用上清液时必须补加营养成分。
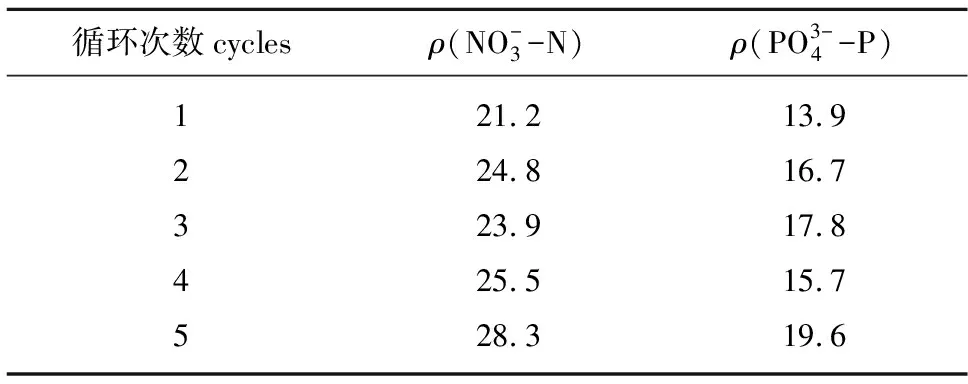
表2 5次循环上清液中NO-3-N、PO3-4-P含量的变化
3 讨论
在微藻絮凝采收中,絮凝剂的种类对絮凝效果和上清液的循环利用性能有较大的影响。本研究结果表明,5次循环培养的上清液中小球藻均能正常生长,而壳聚糖的絮凝效率也在95%以上,NO-3-N、PO3-4-P含量无抑制积累。这说明壳聚糖在小球藻絮凝采收中具有一定的应用价值,但如果进行更多次的循环培养,效果如何,还需进一步深入研究。研究表明:上清液在循环利用时,微藻在生长过程中会出现化感现象,通过化感作用影响自身或其它藻体的生长能力,化感作用的方式为藻体将化感性物质排放至培养液中;此化感性物质会改变自身或其它藻体的表面结构,从而影响藻体对营养物质的吸收能力和藻体排放体内代谢废物的能力;在多次循环的上清液中化感性物质势必会积累,不仅会影响藻体的生长,同时也会影响絮凝剂对藻体的絮凝性能,导致上清液的循环利用性能下降[14,17-21]。而选择合适的絮凝剂或在多次循环后改用其它絮凝剂,或者选择絮体与上清液合适的分离方法,都可降低上清液中化感物质的积累,从而提高上清液的循环利用性能。一些研究表明,壳聚糖对多种微藻均具有较高的絮凝效率[6,8-11]。但目前关于上清液循环利用性能方面的研究较少,希望本研究结果能为其它微藻的研究提供一些参考资料。
参考文献:
[1] Brennan L,Owende P.Biofuels from microalgae-A review of technologies for production,processing,and extractions of biofuels and co-products[J].Renewable and Sustainable Energy Reviews,2010,14(2):557-577.
[2] Ahmad A L,Yasin N H M,Derek C J C,et al.Microalgae as a sustainable energy source for biodiesel production:A review[J].Renewable and Sustainable Energy Reviews,2011,15(1):584-593.
[3] Mata T M,Martins A A,Caetano N S.Microalgae for biodiesel production and other applications:A review[J].Renewable and Sustainable Energy Reviews,2010,14(1):217-232.
[4] Grima E M,Belarbi E H, Fernández F G A,et al.Recovery of microalgal biomass and metabolites:process options and economics[J].Biotechnology Advances,2003,20(7-8):491-515.
[5] 李道义,李树君,刘天舒,等.微藻能源产业化关键技术的研究进展[J].农业机械学报,2010,41(5):160-166.
[6] 郑必胜,蔡妙颜,郭祀远,等.壳聚糖在小球藻采收中的应用[J].海湖盐与化工,2002,32(1):7-9.
[7] 李琳.小球藻的絮凝沉降采收[J].粮油加工与食品机械,2002(12):51-53.
[8] Divakaran R,Pillai V N S.Flocculation of algae using chitosan[J].J Appl Phycol,2002,14(5):419-422.
[9] 刘振儒,赵纪强.壳聚糖去除铜绿微囊藻的工艺研究及机理探讨[J].青岛科技大学学报,2005,26(5):394-397.
[10] Morales J,Noue J,Picard G.Harvesting marine microalgae species by chitosan flocculation[J].Aquacultural Engineering,1985,4(4):257-270.
[11] Lertsutthiwong P,Sutti S,Powtongsook S.Optimization of chitosan flocculation for phytoplankton removal in shrimp culture ponds[J].Aquacultural Engineering,2009,41(3):188-193.
[12] Papazi A,Makridis P,Divanach P.HarvestingChlorellaminutissimausing cell coagulants[J].J Appl Phycol,2010,22(3):349-355.
[13] Salim S,Bosma R,Marian H,et al.Harvesting of microalgae by bio-flocculation[J].J Appl Phycol,2010,23(5):849-855.
[14] 蔡明星,姜建国,任悦.日采收量与培养液回流对盐藻生长的影响[J].食品科技,2006,31(4):22-24.
[15] Kim D G,La H J,Ahn C Y,et al.Harvest ofScenedesmussp.with bioflocculant and reuse of culture medium for subsequent high-density cultures[J].Bioresource Technology,2011,102(3):3163-3168.
[16] 何腊平,于丽娟,张义明.螺旋藻培养液回收利用的研究[J].贵州工业大学学报:自然科学版,2004,33(3):23-27.
[17] Robertson P.Studies onChlorellavulgarisⅤ some properties of the growth-inhibitor formed byChlorellacells[J].Amer J Bot,1942,9:142-148.
[18] Irfanullah H M,Moss B.Allelopathy of filamentous green algae[J].Hydrobiologia,2005,543(1):169-179.
[19] Harris D O.Growth inhibitors produced by the green algae(Volvocaceae)[J].Arch Mikrobiol,1971,76:47-50.
[20] Henderson R,Parsons S A,Jefferson B.The impact of algal properties and pre-oxidation on solid liquid separation of algae[J].Water Research,2008,42(8-9):1827-1845.
[21] Li C,Li P F,Liu Z L,et al.The released polysaccharide of the cyanobacteriumAphanothecehalophyticainhibits flocculation of the alga with ferric chloride[J].J Appl Phycol,2009,21(3):327-331.
