中间球海胆精子超低温冷冻损伤的研究
2012-09-25李霞刘志丹秦艳杰
李霞,刘志丹,秦艳杰
(大连海洋大学 辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁 大连 116023)
随着冷冻保存技术的发展,人们开始探讨超低温冷冻保存对精子超微结构以及遗传物质的损伤。林丹军等[1]检测了冷冻-解冻复苏过程对大黄鱼精子超微结构的影响;徐西长等[2]应用单细胞凝胶电泳技术(SCGE)研究了超低温保存真鲷精子对其DNA的损伤。中间球海胆Strongylocentrotusintermedius作为中国北方重要的养殖种类,研究其精子的冷冻保存对种质资源保护、良种培育、人工育苗等具有重要意义。关于中间球海胆精子超低温冷冻保存的研究已有一些报道[3-4],但研究内容主要集中在抗冻剂种类、降温方式及解冻方式的选择等方面,对精子超低温冷冻保存的损伤尚未见报道。本研究中,作者采用透射电镜技术对超低温冷冻保存前后精子的形态和超微结构进行了观察,同时应用单细胞凝胶电泳技术研究了超低温冷冻保存对中间球海胆精子DNA的损伤,旨在为建立中间球海胆超低温冷冻保存技术和冻精质量的检测提供参考。
1 材料与方法
1.1 材料
中间球海胆取自大连新碧龙海产有限公司。于2009年5—6月和2010年9—11月分别选取性腺发育成熟的海胆,从中间球海胆围口膜处注射0.075 mol/L KCl 1 mL,然后单个放在50 mL烧杯中,收集产出后的精子用于试验。
1.2 方法
1.2.1 冷冻精子的制备 制备冷冻精子时分为对照组(A0)和试验组(A1),方法如下:
试验组(A1):将400 μL鲜精与用400 μL消毒海水配制的抗冻剂(体积分数为10%的DMSO+体积分数为6%的甘油+25 mmol/L海藻糖)混合装入1.8 mL冻存管中,将冻存管放入冰箱(4 ℃)内平衡10 min,取出后在液氮面上方15 cm和3 cm处分别停留3 min和5 min,再浸入液氮中冷冻保存。24 h后取出冻存管在(22±2)℃下水浴中解冻。
对照组(A0):将400 μL鲜精与400 μL消毒海水混合,装入1.8 mL冻存管中,冷冻、解冻方法同上。
1.2.2 电镜样品的制备与观察 将新鲜精液与各组冷冻精子,分别放入用磷酸缓冲液(pH 7.2)配制的体积分数为2.5%的戊二醛中固定24 h,再用体积分数为1%的锇酸固定2 h后,用梯度乙醇脱水,E-pon812包埋,用醋酸铀和柠檬酸铅双重染色,在JEM-1200型透射电镜下观察并拍照。
在电镜下观察各组100个精子的质膜、顶体、线粒体、鞭毛等细胞器,并计算各细胞器的畸形率:
畸形率=受损细胞器个数/总细胞器个数×100%。
1.2.3 单细胞凝胶电泳 将新鲜精液与解冻后的精液用4 ℃下预冷的磷酸缓冲液(pH 7.4)离心洗涤两次(2 000 r/min),然后用磷酸缓冲液将精液稀释至106个/mL。试验参照Singh等[5]提出的碱性单细胞凝胶电泳方法,略加改进。步骤如下:
1)凝胶片的制备。用PBS配制6.5 g/L常温熔点琼脂糖(NMA)溶液,于微波炉内加热熔化,将熔解后的凝胶冷却至45 ℃待用。取100 μL凝胶滴于预冷载玻片上,迅速盖上盖玻片,置于冰箱(4 ℃)内保存20 min,待琼脂糖冷却变硬,取下盖玻片,形成第一层凝胶;取10 μL精液与70 μL 6.5 g/L的低熔点琼脂糖(LMA)溶液混匀,制成精子LMA悬液,迅速滴在第一层琼脂糖上,加上盖玻片,4 ℃下放置20 min使LMA硬化,轻轻取下盖玻片,形成第二层凝胶;随后在其上滴加75 μL 6.5 g/L LMA,加盖玻片,形成第三层胶,凝固后取下盖玻片。
2)裂解。将铺好胶的载玻片立即浸入预冷的裂解液(2.5 mol/L NaCl,100 mmol/L Na2EDTA,10 mmol/L Tris,调节pH至10后加入10 g/L肌氨酸钠,临用前加入体积分数为1%的TritonX-100和体积分数为10%的DMSO)中,于4 ℃下裂解1 h。
3)电泳。将上述处理的玻片,吸去表面液体。并列放置在水平电泳槽的阳极,然后加入预冷的碱性电泳液(300 mmol/L NaOH,1 mmol/L Na2EDTA,pH>13),液面高出玻片约2.5 mm,浸泡30 min,使DNA双链充分解旋, 之后在25 V、300 mA条件下,避光电泳40 min。
4)观察并拍照。取出载玻片吸干水分,用Tris-HCl(0.4 mol/L,pH 7.5)中和3次,每次5 min;随后滴加50 μL EB(50 μg/mL)溶液,加上盖玻片染色15 min;避光操作,在荧光显微镜(Nikon DXM 1200)下观察并拍照。
5)图像分析及数据处理。采用CASP彗星图像分析软件测量。根据彗星尾部的DNA含量将DNA损伤程度分为5级:0级(G0),DNA含量<5%,无损伤,精子核完整;1级(G1),DNA含量为5%~20%,轻度损伤,可见彗尾,精子核基本完整;2级(G2),DNA含量为20%~40%,中度损伤,可见明显的彗尾,精子核缩小;3级(G3),DNA含量为40%~95%,重度损伤,彗尾荧光信号强而密,并见明显缩小的精子核;4级(G4),DNA含量>95%,完全损伤,仅见荧光强而密的彗星,精子核基本消失。每次计数100个精子,重复3次,计算各级损伤率[6]以及彗星率:
彗星率=彗星细胞数/总细胞数×100%,
损伤系数=∑(Gi级损伤细胞数×i),i=0~4。
1.3 数据处理
用SPSS 17.0软件处理试验数据,采用One Way-ANOVA做单因素方差分析, 差异显著性水平设为0.05。试验数据用平均数±标准差表示。
2 结果
2.1 正常中间球海胆的精子形态
在透射电镜下观察新鲜精子的超微结构时发现,中间球海胆精子属鞭毛型,由头和尾组成。精子头部形似“子弹头”,紧紧包被于平滑的质膜下,头部主要由顶体和细胞核组成。顶体位于前端,呈圆锥状,前端钝圆,内含电子密度较高的物质;细胞核由前到后逐渐变宽,电子密度很高,细胞核外有一层核膜,正常状态下核膜和质膜不易区分;核的上端为顶体窝,呈“U”型,窝内物质电子密度较低,排列疏松(图1-a);核后窝位于核的下端,呈倒“V”字型(图1-b);线粒体数目为1个,形态较大,位于细胞核的后方,近圆形,具有双层膜结构,内膜向内折形成排列不规则的内嵴(图1-c)。鞭毛从核后窝内伸出,由轴丝和鞘组成,横切面可见轴丝为典型的“9+2”型结构(图1-d)。
2.2 冷冻后中间球海胆精子的形态变化
观察发现,A0组精子线粒体和顶体结构均不完整,质膜、鞭毛破损,细胞核裸露(图1-e)。A1组多数精子结构完好,但有部分精子的细胞器受损,表现为质膜褶皱(图1-f),或膨胀举起,与核膜间隙明显增大(图1-g);顶体肿胀、破裂(图1-h)或脱落(图1-i);线粒体嵴间隙增大,内部出现空泡(图1-j),甚至线粒体内膜破损,内嵴减少,呈弥散状(图1-k);鞭毛被膜肿胀,呈波浪状,“9+2”型结构模糊(图1-l)。细胞核结构同新鲜精子。各组细胞器畸形率见表1。由表1可见,冷冻对质膜和线粒体结构影响较大,对顶体次之。

图1 中间球海胆新鲜精子和冷冻精子超微结构的比较Fig.1 Ultrastructural comparison of fresh and post-thawed sperm in sea urchin Strongylocentrotus intermedius
注:a~d 正常鲜精子的亚显微结构;e A0组冷冻精子,示细胞核裸露; f A1组冷冻精子,示质膜褶皱;g A1组冷冻精子,示质膜高度膨胀;h A1组冷冻精子,示顶体肿胀变形;i A1组冷冻精子,示顶体脱落;j A1组线粒体,示内嵴间隙增大;k A1组线粒体,示线粒体内膜解体;l A1组冷冻精子鞭毛纵切,鞭毛外膜肿胀,呈波浪状。Ac示顶体;N示细胞核;M示线粒体;AF示顶体窝(核前窝);SS示亚顶体腔;PF示核后窝;F示鞭毛;PM示质膜。
Note:a-d Ultrastructure of normal fresh sperm; e Post-thawed sperm in group A0, showing nucleus exposure; f Post-thawed sperm in group A1, showing the swollen plasma membrane; g Post-thawed sperm in group A1, showing swollen plasma membrane;h Post-thawed sperm in group A1, showing the swollen acrosome;i Post-thawed sperm in group A1, showing detachment of acrosome;j Mitochondria in group A1, showing enlargement of mitochondrion cristae space; k Mitochondria in group A1, showing disruption of the external membrane of mitochondrion;l Cross section of flagellum of post-thawed sperm in group A1, showing swolled membrane of flagellum.Ac,acrosome; N,nucleus; M,mitochondria; AF,acrosome fossa; SS,subacrosomal space;PF, posterior nuclear fossa; F,flagellum; PM,plasma membrane.

表1 冷冻前后精子细胞器畸形率的变化
注:同列中标有不同小写字母者表示组间差异显著(P<0.05)。
Note:The means with the different letters within the same column are significant differences at the 0.05 probability level.
2.3 冻存精子DNA损伤的检测
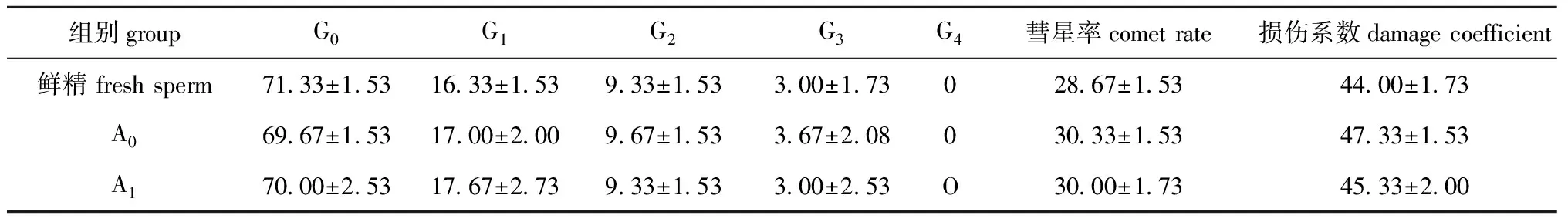
用SCGE检测不同冷冻保护液保存精子后,冷冻精子DNA有不同程度的损伤(表2)。DNA彗星图见图2。
由表2可见,A0组、A1组精子解冻后各级损伤情况、彗星率以及损伤系数与鲜精均无显著差异(P>0.05)。冷冻精子DNA损伤主要为轻度和中度损伤,重度损伤比率较低,而完全损伤则未发现。
表2用SCGE检测中间球海胆鲜精及冻存精子的DNA损伤分级(n=100)
Tab.2C1assificationofDNAdamagedetectioninfleshandfrozen-thawedspermintheseaurchinbySCGE(n=100)
%

图2 中间球海胆精子SCGE彗星图Fig.2 Comet image of the sea urchin sperm through SCGE
注:A DNA 0级损伤;B DNA 1级损伤;C DNA 2级损伤;D DNA 3级损伤。
Note:A Damage grade 0 in DNA;B Damage grade 1 in DNA;C Damage grade 2 in DNA;D Damage grade 3 in DNA.
3 讨论
3.1 冷冻对精子结构损伤和功能的影响
精子冷冻过程中细胞内外冰晶的形成以及细胞内电解质或大分子物质的浓缩(如蛋白质等)是造成冷冻损伤的主要因素。细胞内外环境存在一定水分,冷冻时温度降低会形成冰晶,使细胞器受到机械损伤。同时由于细胞外溶液浓度增加引起细胞严重脱水,胞内物质浓缩,或者膜破损,胞内物质丢失,细胞器结构发生改变[7]。DMSO、甘油等渗透型保护剂可以增强细胞膜的通透性,能够渗入细胞内部,与细胞内的水分子结合,使得溶液黏性增加,从而弱化水的结晶,减少冰晶对精子的损伤。所以添加抗冻剂一组冷冻精子的质膜、顶体、线粒体、鞭毛等细胞器畸形率较不添加组显著下降。
用透射电镜观察冷冻前后精子的超微结构,结果表明,添加抗冻剂后虽有多数精子结构完好,但仍有部分精子的细胞器受损,表现为质膜膨胀举起,嵴间隙增大,内部出现空泡。顶体破裂或脱落,鞭毛被膜肿胀,呈波浪状,“9+2”型结构模糊,表现形式的不同和精子个体间的差异有关。损伤特征与西伯利亚鲟[8]、太平洋牡蛎[9]精子冻存的研究结果相似。细胞器结构与精子行使正常生理功能密切相关,如质膜具有维持细胞内环境稳定以及接受外界刺激的作用;线粒体是精子能量的来源,它为精子的新陈代谢和运动提供能量。Gwo[10]对运动前后精子的线粒体观察后发现,运动后线粒体体积变小,数目也迅速减少,最后完全消失。顶体是精子行使受精功能必不可少的细胞器,顶体变形以及破裂将使得精子不能正常受精。杨培民[11]认为,顶体破裂将导致无法识别精卵。精子靠鞭毛的摆动进行运动,鞭毛的畸变也会影响精子的运动能力,使得其进入卵子的几率降低。细胞器受损后必然导致解冻后精子丧失运动能力,不能完成正常受精。
3.2 冷冻和抗冻剂对DNA损伤的影响
精子细胞核是遗传物质的载体,而DNA作为遗传物质,其完整性对于物种的延续具有重要意义。关于冷冻对精子DNA损伤目前有两种观点:一种观点认为,冰冻对精子DNA没有影响,精子作为单倍体细胞,其染色质结构与体细胞不同,由鱼精蛋白浓缩形成超螺旋四聚体,染色质高度凝聚,细胞内液体成分极少,不会形成冰晶,可以采用冰冻方式保存精子DNA[12];第二种观点认为,冷冻会造成DNA损伤,精子在从精原细胞逐渐转化为精子的过程中, 在后期丢失了大部分的细胞质, 从而也就遗失了一部分保护精子细胞免遭氧化损伤的酶类, 而这些酶有利于组蛋白向鱼精蛋白的转化[13]。有学者认为,高浓度的抗冻剂可引起精子DNA损伤。魏平等[14]检测了不同浓度的DMSO对真鲷Pagrosomusmajor精子DNA的损伤,认为用体积分数为5%~25%DMSO组成的抗冻剂冷冻精子,解冻后DNA的损伤状况与鲜精接近,但DMSO的体积分数高于25%时,真鲷冷冻精子DNA的损伤比鲜精显著加重。陈东华等[15]认为,体积分数为10%的DMSO抗冻剂对河蟹Eriocheirsinensis精子DNA的损伤最为明显。本试验结果表明:冷冻以及添加较低浓度的抗冻剂对中间球海胆精子DNA损伤均没有显著影响,说明适宜的抗冻剂种类和浓度能够对精子DNA起到较好的保护效果,高浓度的抗冻剂对DNA结构是否有影响还有待进一步研究。
参考文献:
[1] 林丹军,尤永隆,张炳英.大黄鱼精子冷冻复苏后活力和超微结构的变化[J].福建师范大学学报,2006,22(3):71-76.
[2] 徐西长,丁福红,李军.单细胞凝胶电泳用于检测低温保存的真鲷(Pagrosomusmajor)精子DNA损伤[J].海洋与湖沼,2005,36(3):221-225.
[3] 王笑月,周遵春,李华林,等.中间球海胆精子的超低温保存技术[J].水产科学,2002,21(3):1-3.
[4] 刘志丹,李霞,秦艳杰.中间球海胆精子超低温冷冻保存方法的研究[J].大连海洋大学学报,2012,27(1):53-57.
[5] Singh N P,Mccoy M T,Tice R R,et al.A simple technique for quantitation of low levels of DNA damage in individual cell[J].Exp Cell Res,1988,175(2):184-191.
[6] 陈安.单细胞凝胶电泳法检测单细胞DNA损伤[J].国外医学临床生物化学与检验学分册,1998,19(4):145-146.
[7] 张轩杰,张良平,沈晓勤.鱼类冷冻精子结构变异的电子显微镜研究[J].湖南师范大学学报,1991,14(2):160-164.
[8] 章龙珍,刘鹏,庄平,等.超低温冷冻对西伯利亚鲟精子形态结构损伤的观察[J].水产学报,2008,32(4):558-565.
[9] 李赟,贺桂珍,王品虹.超低温保存前后太平洋牡蛎精子(Crassostreagigas(Thunberg))超微结构观察[J].青岛海洋大学学报, 2002, 32(4):526-532.
[10] Gwo J C.Ultrastructural study of osmolality effect on spermatozoa of three marine teleosts[J].Tissue Cell,1995,27(5):491-497.
[11] 杨培民.虾夷扇贝和栉孔扇贝精子的冷冻保存研究[D].上海:上海水产大学,2007.
[12] 宋博,郑履康,邓丽霞,等.冰冻对精子DNA的影响[J].中华男科学,2002,8(4):253-254.
[13] Cabrita E,Robles V,Rebordinos L,et al.Evaluation of DNA damage in rainbow trout (Oncorhynchusmykiss)and gilthead sea bream (Sparusaurata) cryopreserved sperm[J]. Cryobiology, 2005, 50(2):144-153.
[14] 魏平,竺俊全,闫家强,等.真鲷精子的超低温冻存及DNA损伤的检测[J].水生生物学报,2010,34(5):1049-1055.
[15] 陈东华,李艳东,贾林芝,等.冷冻保护剂及预冷时间对河蟹精子体外冷冻保存的影响[J].水生生物学报,2008,32(4):579-585.
