硫酸根自由基处理含酚废水的研究
2012-09-25郑欢,孙德栋,梁花梅,马春,张新欣,郝军,薛芒
郑 欢, 孙 德 栋, 梁 花 梅, 马 春, 张 新 欣, 郝 军, 薛 芒
( 大连工业大学 轻工与化学工程学院, 辽宁 大连 116034 )
0 引 言
含酚废水是各国水污染控制中列为重点解决的有毒有害废水之一。苯酚是最难生物降解的污染物之一,在工业废水和城市污水中大量存在。因此,采用苯酚作为目标化合物有很强的代表性和现实性。
过渡金属离子(如Fe2+)与过硫酸钾反应能够生成硫酸根自由基,近年来在降解有机污染物方面日益引起关注。Anipsitakis等[6-8]研究了过渡金属钴以及铁离子活化单过氧硫酸氢盐产生硫酸根自由基,氧化降解氯酚、多氯联苯和多环芳烃类化合物,取得了很好的降解效果。张金凤等[9]研究了Fe(Ⅱ)/K2S2O8体系降解水中的敌草隆,并且鉴定了敌草隆的主要降解产物。
本文通过加热和亚铁离子活化过硫酸钾2种方式,以苯酚为处理对象,考察了各项因素对难降解有机物苯酚降解率的影响。
1 实 验
1.1 仪器与试剂
仪器:721分光光度计,电热恒温水浴锅,微波炉。
试剂:苯酚,过硫酸钾,硫酸亚铁氨,重铬酸钾,铁氰化钾,4-氨基安替比林,浓硫酸,氢氧化钠。
本实验所用的含酚废水为实验室自配模拟废水 ,该废水含苯酚质量浓度约为200 mg/L。
1.2 实验方法
取配置好的水样100 mL于锥形瓶中,并迅速加入一定量的过硫酸钾和Fe2+溶液混匀。为减小苯酚的挥发性对测量结果造成的影响,本实验在反应过程中将锥形瓶口扣上小烧杯,同时做空白实验。加热反应在电热恒温水浴锅中进行(本实验最高温度为100 ℃),用硫酸或氢氧化钠调节pH,在不同的反应条件下进行苯酚降解实验。每隔一定时间取水样进行测定。苯酚去除率
式中,ρ0为苯酚溶液的初始质量浓度,mg/L;ρt为t时刻苯酚溶液的质量浓度,mg/L。
1.3 分析项目及方法
COD测定采用微波消解法,苯酚含量测定采用 4-氨基安替比林分光光度法,pH采用FE20型pH计测量。
2 结果与讨论
2.1 过硫酸钾投加量对COD去除率的影响
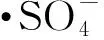
(1)
(2)
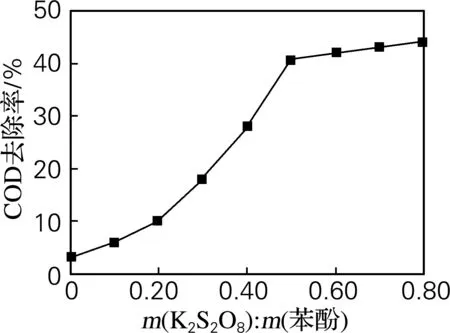
图1 过硫酸钾投加量对COD去除率的影响
Fig.1 Effect of K2S2O8dosages on the degradation efficiency of COD
2.2 Fe2+投加量对苯酚降解情况的影响
固定过硫酸钾投加量为0.50,保持其他实验条件不变,考察Fe2+投加量对苯酚及COD去除率的影响。结果如表1所示,在K2S2O8与Fe2+摩尔比为1∶1时降解效果最佳,随着Fe2+浓度进一步提高,苯酚降解率反而减小。这一现象可以通过下面的反应式(3)、(4)解释。在这里,亚铁离子为电子供体,首先它会催化分解过硫酸根离子,产生硫酸根自由基,硫酸根自由基稳定存在可以氧化降解苯酚。但是,当亚铁离子浓度较高时,反应(3)产生的硫酸根自由基同时会与溶液中存在的亚铁离子发生反应(4),从而消耗了部分硫酸根自由基,在这一过程中苯酚与亚铁离子对硫酸根自由基的竞争作用,抑制了苯酚降解[4]。
(3)
(4)
表1 Fe2+投加量对苯酚及COD去除率的影响
Tab.1 Effect of Fe2+dosages on the degradation efficiencies of phenol and COD
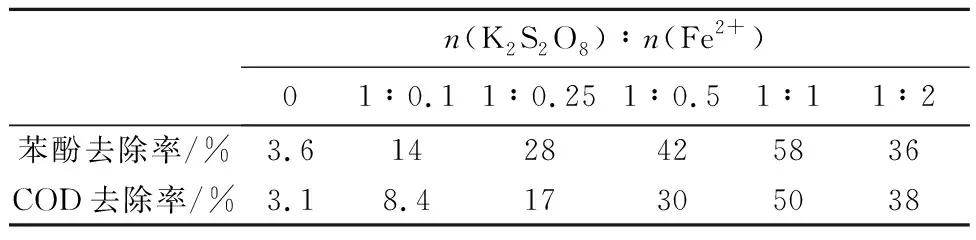
n(K2S2O8)∶n(Fe2+)01∶0.11∶0.251∶0.51∶11∶2苯酚去除率/%3.61428425836COD去除率/%3.18.417305038
2.3 不同体系在不同时间下对苯酚降解情况的影响
研究100 ℃时K2S2O8及Fe2+/K2S2O82种体系在不同时间段对苯酚的降解情况。结果如图2、3所示,从图中可以看出,单纯加热过硫酸盐产生硫酸根自由基,这种活化方法初期降解苯酚的效率较低,在反应3 h时才显现出较明显的降解趋势,此时苯酚和COD去除率分别达50%和45%。2种体系在反应3 h后对苯酚及COD的降解趋势均趋于平缓。比较2种处理体系,Fe2+/K2S2O8的处理效果较优,这主要是因为在加热条件下Fe2+催化K2S2O8产生了更多的硫酸根自由基,提高了苯酚的降解率。
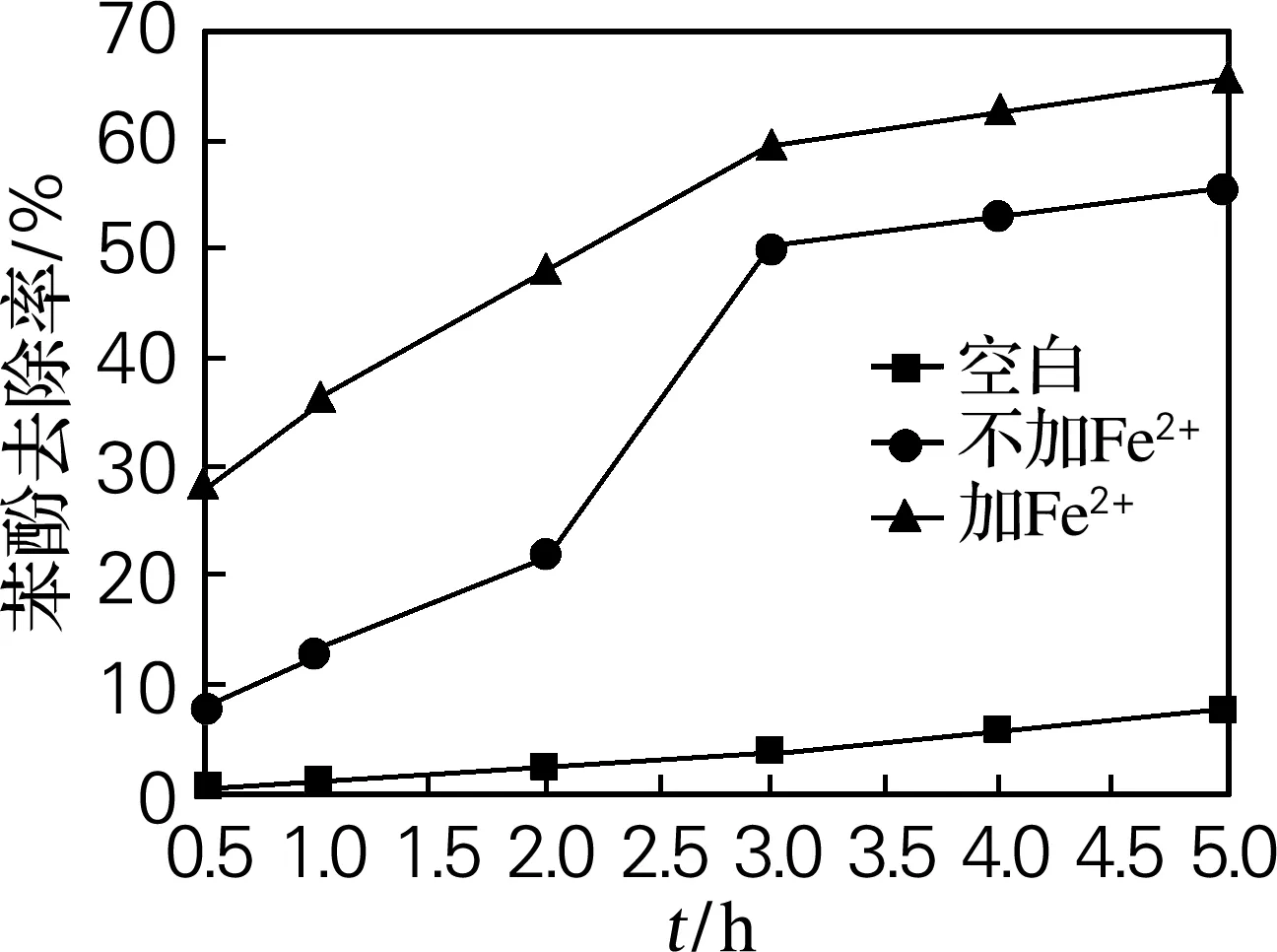
图2 不同体系在不同时间下对苯酚去除率的影响
Fig.2 Effect of reaction time on the degradation efficiency of phenol in different systems
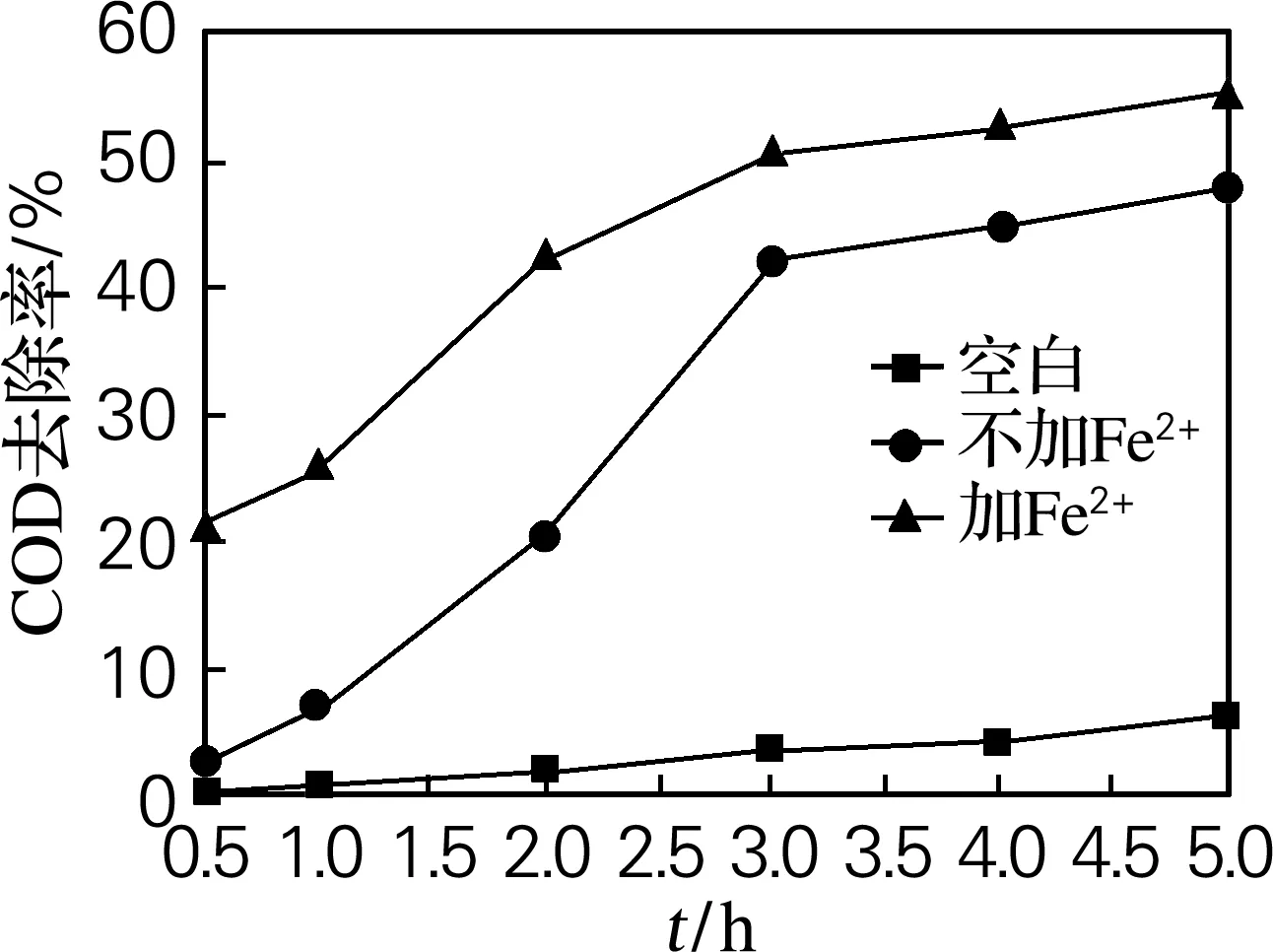
图3 不同体系在不同时间下对COD去除率的影响
Fig.3 Effect of reaction time on the degradation efficiency of COD in different systems
2.4 反应温度对苯酚降解情况的影响
过硫酸钾投加量为0.50,n(K2S2O8)∶n(Fe2+)=1∶1,反应时间3 h,考察K2S2O8及Fe2+/K2S2O82种体系中反应温度对苯酚及COD去除率的影响。结果如图4、5所示,单纯加热K2S2O8体系,温度低于30 ℃时,水样的苯酚及COD去除率均无明显变化,而Fe2+/K2S2O8体系在20 ℃时就有35%和27%的苯酚和COD去除率。在室温下过硫酸钾是相对稳定的,难以分解产生硫酸根自由基,在催化剂Fe2+存在时,可以活化过硫酸钾产生硫酸根自由基。2种体系随着温度的升高,对苯酚的降解率逐渐增大,过硫酸钾的活化效果随之提升,在相同温度下Fe2+/K2S2O8降解苯酚的效果要优于K2S2O8体系,如在100 ℃时,K2S2O8体系中苯酚和COD去除率分别为50%和45%,而Fe2+/K2S2O8体系中苯酚及COD去除率分别增加了11%和8%。温度较低时Fe2+/K2S2O8要比K2S2O8体系降解苯酚的效果更明显。
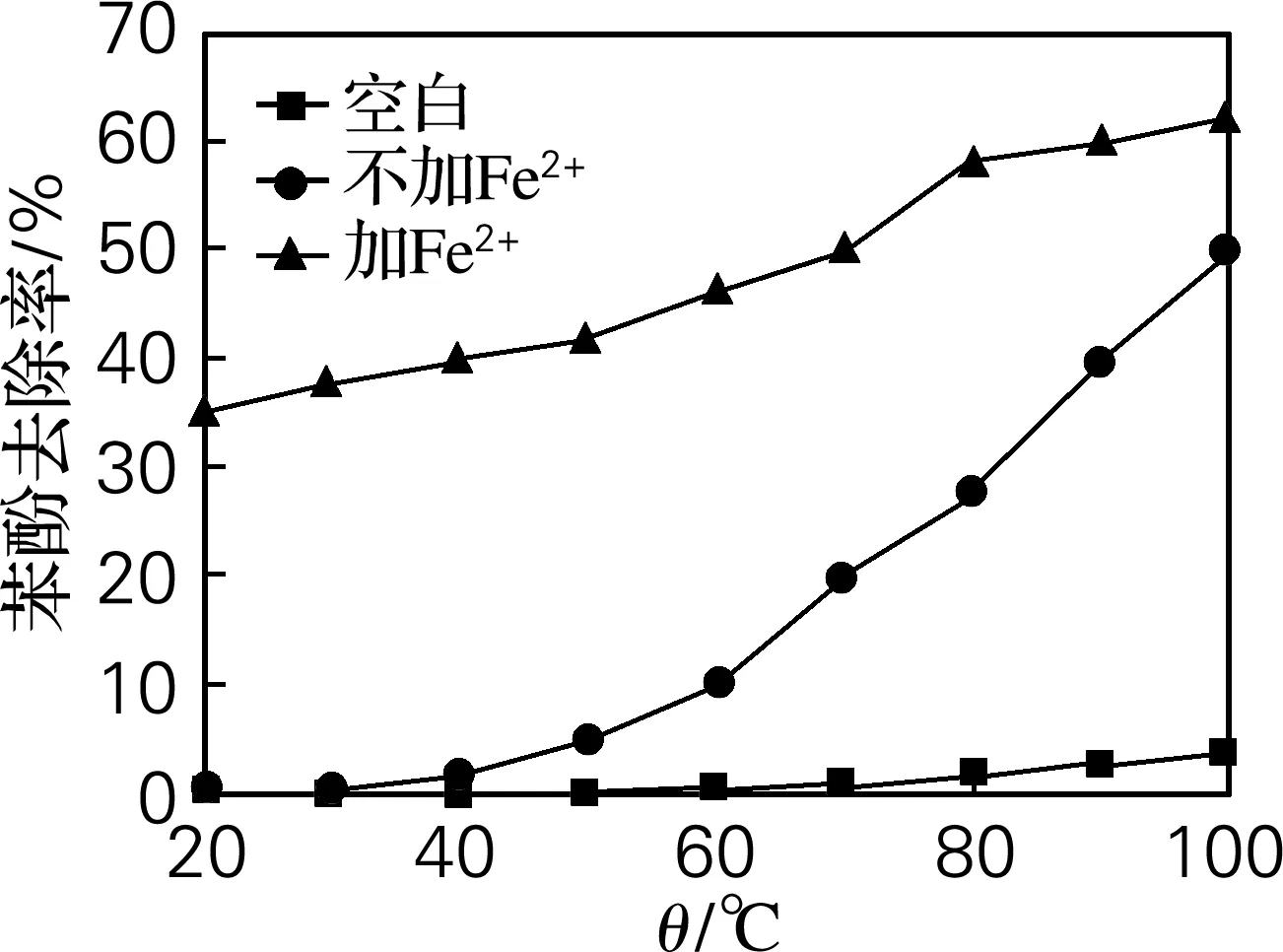
图4 反应温度对苯酚去除率的影响
Fig.4 Effect of reaction temperature on the degradation efficiency of phenol
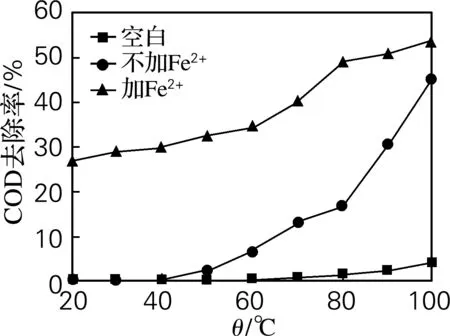
图5 反应温度对COD去除率的影响
Fig.5 Effect of reaction temperature on the degradation efficiency of COD
2.5 pH对苯酚降解率的影响
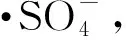
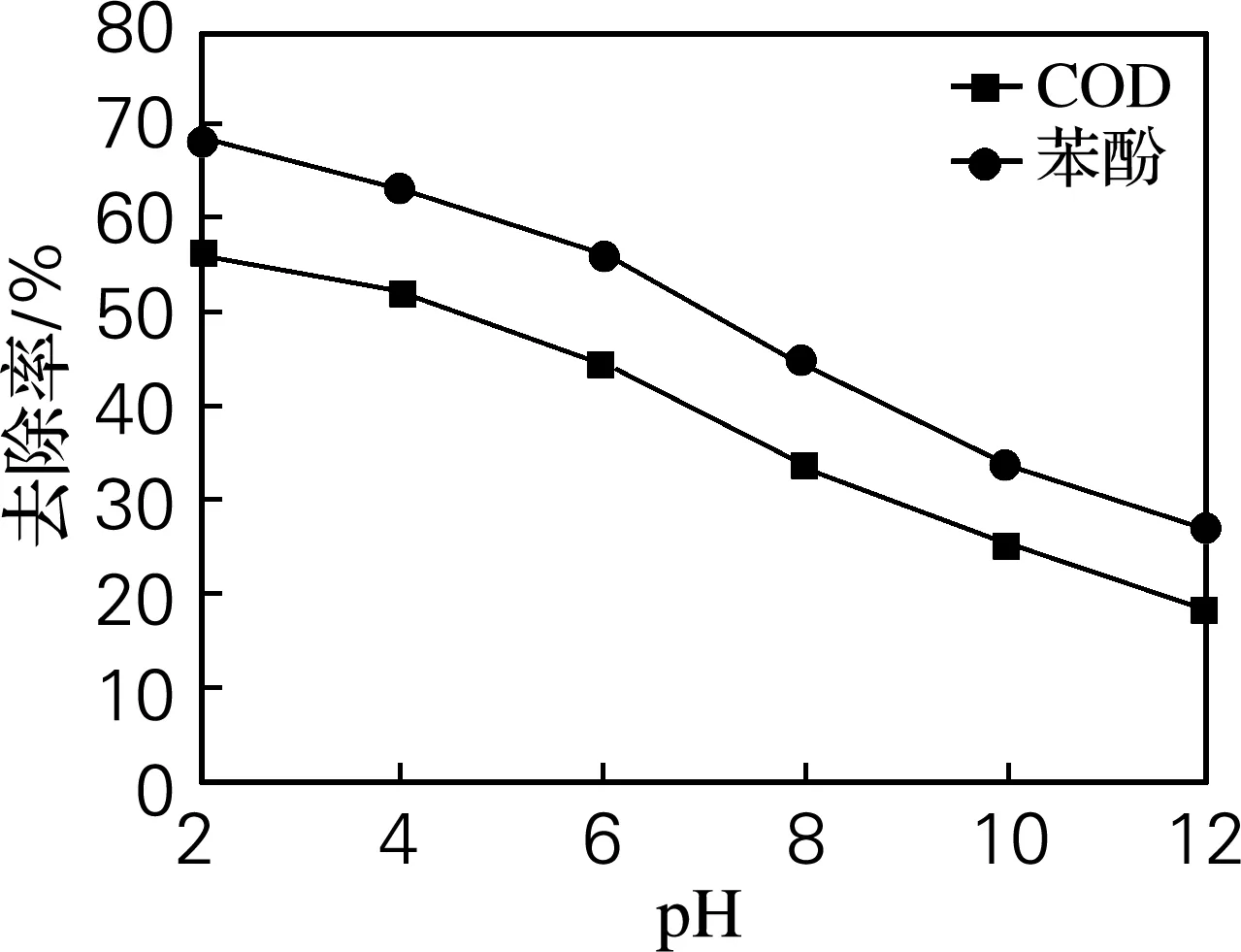
图6 pH对苯酚及COD去除率的影响
Fig.6 Effect of pH on the degradation efficiencies of phenol and COD
同时,Fe2+的存在需要酸性条件,中性或碱性条件易析出沉淀[1]。所以在酸性条件下有利于Fe2+催化过硫酸盐产生更多的硫酸根自由基,从而达到更好的去除效果。
2.6 苯酚初始质量浓度对过硫酸钾氧化作用的影响
分别配制苯酚溶液质量浓度为50、100、200 mg/L 的水样,研究不同初始质量浓度的苯酚溶液降解状况。如图7所示,在相同的实验条件下,不同初始质量浓度的苯酚降解速率有所不同,随着苯酚初始质量浓度的升高,苯酚降解速度下降。这主要是因为当苯酚初始质量浓度较高时,硫酸根自由基氧化产生的中间产物也多,而很多产物又比较容易被氧化,就与苯酚展开对硫酸根自由基的争夺,导致苯酚降解速度降低[11]。
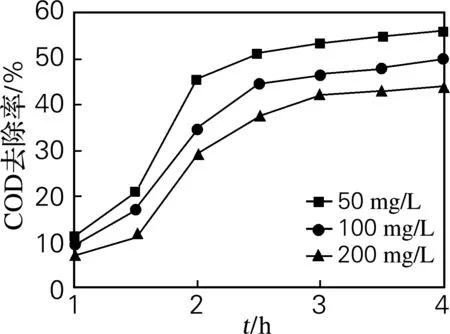
图7 苯酚初始质量浓度对过硫酸钾氧化作用的影响
Fig.7 Effect of phenol concentration on K2S2O8oxidation
3 结 论
(1)在加热条件下,当温度为100 ℃、K2S2O8投加量为m(K2S2O8)∶m(苯酚)=0.50、加热时间3 h时,苯酚和COD去除率分别达50%和45%。温度在30 ℃以下时苯酚基本无降解。
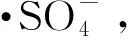
(3)在整个反应体系中,pH对苯酚降解率影响较大,实验证明在酸性条件下过硫酸钾能产生更多的硫酸根自由基,从而达到更好的去除效果。
(4)苯酚的初始质量浓度较高时,氧化产生的中间产物与苯酚争夺硫酸根自由基,导致苯酚降解速度降低。因此在相同的实验条件下,苯酚初始质量浓度越高其降解率越低。
[1] 杨世迎,陈友媛,胥慧真,等. 过硫酸盐活化高级氧化新技术[J]. 化学进展, 2008, 20(9):1433-1438.
[2] HOUSE D A. Kinetics and mechanism of oxidations by peroxydisulfate[J].Chemical Reviews, 1962, 62(3):185-203.
[4] LIANG C J, BRUELL C J, MARLEY M C, et al. Persulfate oxidation for in situ remediation of TCE. I.Activated by ferrous ion with and without a persulfate-thiosulfate redox couple[J]. Chemosphere, 2004, 55(9):1213-1223.
[5] CAO J S, ZHANG W X, BROWN D G, et al. Oxidation of lindane with Fe(Ⅱ)-activated sodium persulfate[J]. Environmental Science and Technology, 2008, 25(2):221-228.
[6] ANIPSITAKIS G P, DIONYSIOU D D. Degradation of organic contaminants in water with sulfate radicals generated by the conjunction of peroxymonosulfate with cobalt[J]. Environmental Science and Technology, 2003, 37(20):4790-4797.
[7] ANIPSITAKIS G P, DIONYSIOU D D, GONZALEZ M A. Cobaltmediated activation of peroxymonosulfate and sulfate radical attack on phenolic compounds. implications of chloride ions[J]. Environmental Science and Technology, 2006, 40(3):1000-1007.
[8] RASTOGI A, AL-ABED S R, DIONYSIOU D D. Sulfate radical-based ferrous-peroxymonosulfate oxidative system for PCBs degradation in aqueous and sediment systems[J]. Applied Catalysis B:Environ, 2009, 85(3/4):171-179.
[9] 张金凤,杨曦,郑伟,等. 水体系中Fe(Ⅱ)/K2S2O8降解敌草隆的研究[J]. 环境化学, 2008, 27(1):15-18.
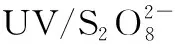
[11] 丁峰. 臭氧氧化法处理苯酚废水的影响因素分析[J]. 污染防治技术, 2010, 23(3):4-6.
