高糖诱导的视网膜胶质细胞凋亡以及牛磺酸的防护效应研究
2012-09-21曾凯宏杨咏涛王静余雪梅崔越
曾凯宏,杨咏涛,王静,余雪梅,崔越
(四川省医学科学院·四川省人民医院临床营养科,四川 成都 610072)
0 引言
近年来,糖尿病(DM)的发病率正以惊人的速度增长。视网膜病变(DR)是糖尿病的常见并发症,也是导致成年人失明的主要原因之一。目前,治疗DR的主要方法为全视网膜光凝固法,但疗效并不理想。因此,寻找一种新的预防和治疗DR的方法十分必要。尽管DR一直被视为一种血管变性疾病,但近期的研究提示DR也是一种神经变性疾病。
DR的早期病变包括视网膜电图改变、胶质细胞反应性增生以及谷氨酸兴奋毒性等。动物研究表明,在DR发生的早期,视网膜神经节细胞已开始凋亡。STZ诱导糖尿病大鼠7个月后,可观察到视网膜神经节细胞数目明显减少,同时视网膜内丛状层和内核层变薄,以内丛状层的变化较为明显[1]。对糖尿病患者的观察发现,糖尿病早期视网膜Müller细胞功能发生改变,且Müller细胞中Bcl-2的表达下调[2]。

图1 GS、GLAST和vimentin联合鉴定胶质细胞
牛磺酸是存在于膳食中的一种人体半必需氨基酸,大量摄入尚未发现毒性反应。牛磺酸在中枢神经系统中可作为渗透压调节剂和抑制性神经调质。研究者很早就发现,牛磺酸能减轻癫痫病的症状,近年来,研究者发现牛磺酸还具有神经保护作用[3]。目前,较多的学者关注牛磺酸对于糖尿病并发症的预防作用。个别研究提示,牛磺酸可降低氧化应激,预防实验性 DR[4]。
本研究利用体外培养的大鼠视网膜胶质细胞高糖模型,观察高糖和牛磺酸对胶质细胞凋亡的影响,深入探讨牛磺酸保护糖尿病引起视网膜损伤的机制。
1 材料和方法
1.1 材料
出生后3~5d的SD大鼠7只,由本院实验动物中心提供。牛磺酸:北京世纪维他生物技术有限公司,纯度>95%;胎牛血清:兰州民海;DMEM/F12、胰酶:美国Gibco公司;D-glucose:Sigma公司;抗谷氨酰胺合成酶(GS)一抗:Sigma公司;波纹蛋白(vimentin):武汉博士德;抗谷氨酸转运蛋白(GLAST)一抗:Sigma公司;荧光二抗罗丹明、FITC:北京中杉生物技术有限公司;Hoechst:北京碧云天生物公司产品;Annexin-V检测试剂盒:罗氏公司。
1.2 方法
1.2.1 SD大鼠视网膜胶质细胞的纯化培养及鉴定
出生后3~5d的新生SD大鼠,用750mL/L酒精浸泡消毒同时麻醉,无菌条件下摘取眼球,用双抗PBS漂洗数遍,小心剥离视网膜,加入5g/L胰蛋白酶,37℃消化20~30min,充分吹打,加入含200mL/L血清的培养基终止消化,不锈钢网过滤,1000r/min离心3~5min,培养基重悬、离心,反复2次。去上清后加入含200mL/L血清的培养基制细胞悬液,调整细胞浓度为3×108个/L,接种于25cm2培养瓶中。细胞鉴定采用胶质细胞标志物GS、GLAST和vimentin联合,免疫细胞荧光双标鉴定。
免疫细胞化学双染步骤为:细胞爬片以40g/L多聚甲醛固定30min,PBS漂洗5min×3次,用含10g/L BSA、5mL/L TritonX-100的 PBS缓冲液孵育30min,同前漂洗后,用含50~100mL/L正常羊血清的PBS缓冲液孵育10min,加1∶2000稀释的 Anti-GS或 Anti-GLAST,4℃过夜(同时设 PBS替代一抗的空白对照和正常羊血清替代一抗的替代对照),PBS漂洗后与罗丹明标记的荧光二抗37℃孵育30min,PBS漂洗后加1∶200稀释的Anti-vimentin,37℃,2h,PBS漂洗后与FITC标记的荧光二抗37℃孵育30min,PBS漂洗后加Hoechst于37℃孵育5min,PBS缓冲液漂洗后,900mL/L甘油封片,激光共聚焦显微镜观察照相。
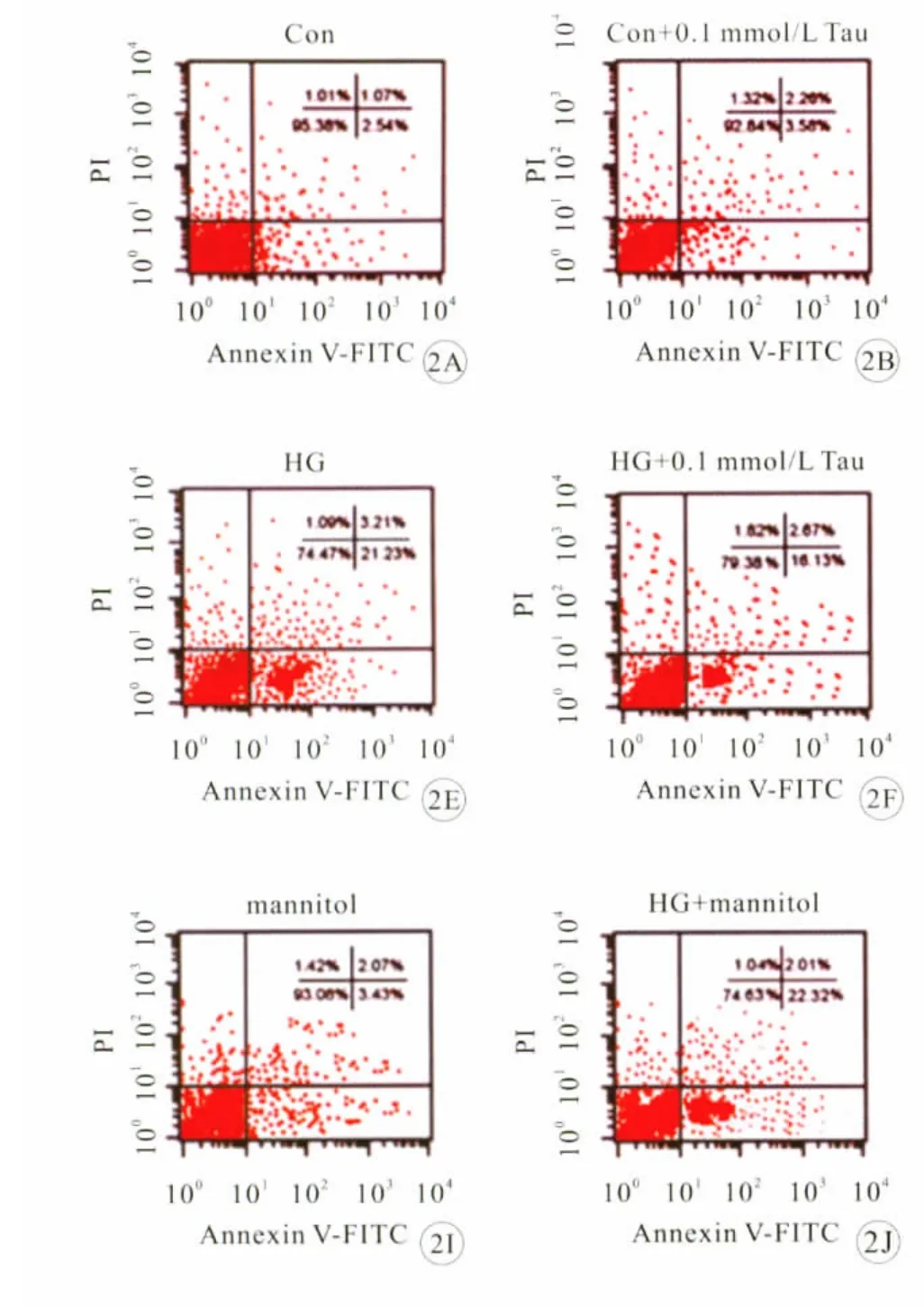
图2 牛磺酸影响体外高糖诱导的大鼠视网膜胶质细胞凋亡的流式图
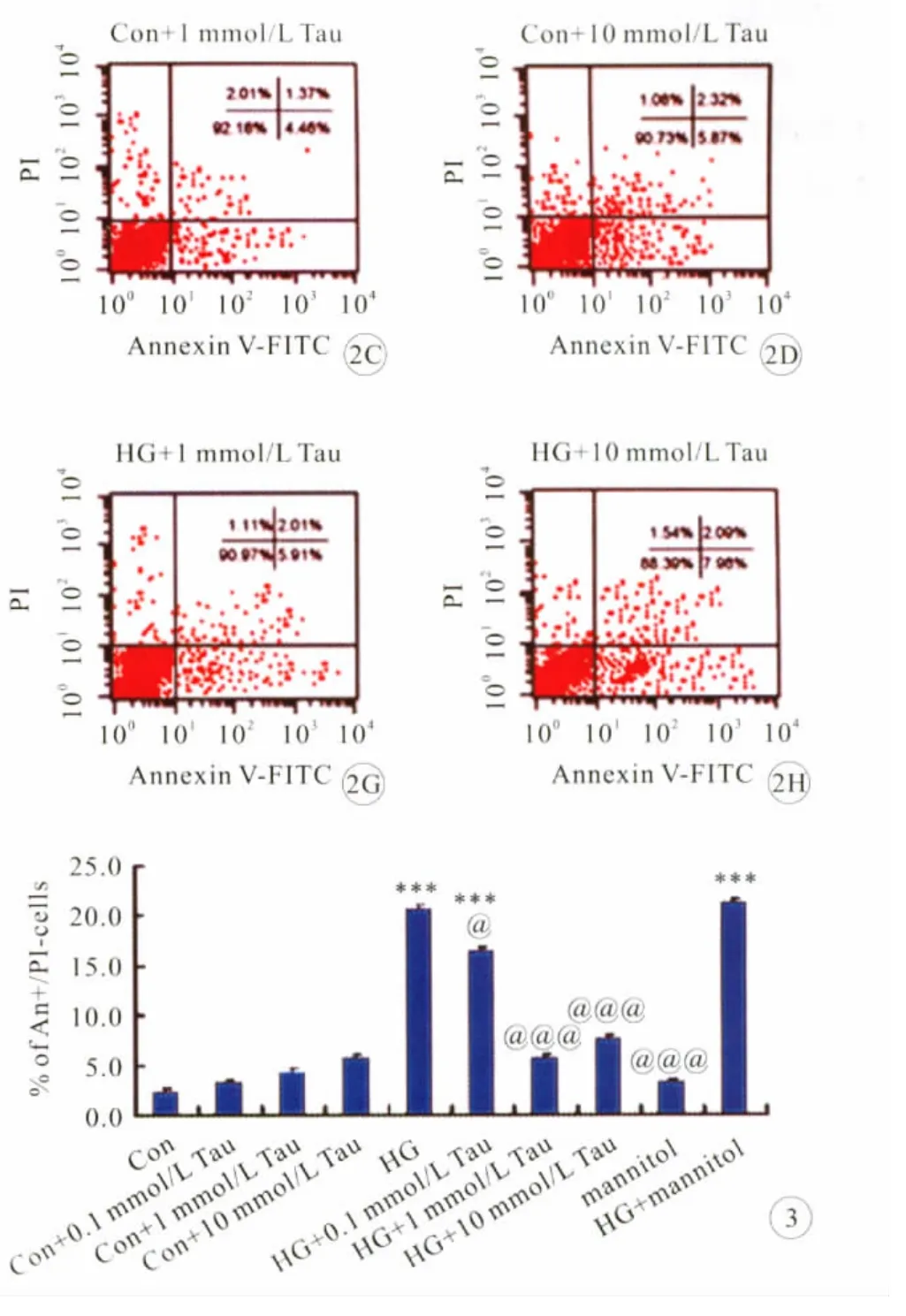
图3 牛磺酸对体外高糖诱导的大鼠视网膜胶质细胞凋亡率的影响
1.2.2 高糖模型建立及实验分组 待细胞达80%融合时,弃掉含血清的培养液,换无血清的培养液培养24h,再换成含不同浓度葡萄糖和牛磺酸培养。实验分10组,分别是:正常对照组(含5mmol/L葡萄糖,Con);牛磺酸对照组(5mmol/L葡萄糖+0.1、1、10mmol/L牛磺酸,Con+0.1、1、10mmol/L Tau);高糖模型组:(含25mmol/L葡萄糖,HG);牛磺酸干预高糖组(25mmol/L葡萄糖+0.1、1、10mmol/L牛磺酸,HG+0.1、1、10mmol/L Tau);甘露醇对照组(5mmol/L、25mmol/L 葡萄糖+20mmol/L mannitol,mannitol、HG+mannitol)。
1.2.3 Annexin-V/PI双染结合流式细胞检测技术检测视网膜胶质细胞凋亡 分组后的细胞培养96h后,用 Annexin-V 结合缓冲液漂洗,然后加入Annexin-V染色液,于37℃避光孵育10min,用钙结合缓冲液漂洗后,加入10μl PI,4℃孵育10min,采用流式细胞检测技术检测胶质细胞的凋亡情况。
1.3 数据统计分析
所有数据均以平均数±标准差表示,用单因素方差分析差异显著性,采用SPSS 13.0统计软件处理结果。
2 结果
2.1 胶质细胞的原代培养及鉴定
接种24h后,细胞部分融合,成簇生长,贴壁不紧;培养3d后,细胞贴壁紧,60%融合,形成集落,呈圆球形,部分细胞从圆球形底部伸出突触;培养6d后,细胞大部分融合,胞体呈纤维形,核圆形或椭圆形;混养的大鼠视网膜细胞培养至第9d时,下层细胞铺满瓶底,细胞与细胞之间相互连接,形成毯状,以胶质细胞特征性标识物 GS、GLAST和vimentin联合对细胞进行鉴定,核用Hoechst复染。图1显示,该培养体系中98%以上的细胞3种抗体染色呈阳性。
2.2 牛磺酸对高糖诱导的大鼠视网膜胶质细胞凋亡的影响
采用Annexin-V/PI双染结合流式细胞检测技术检测体外培养的大鼠视网膜胶质细胞凋亡。与正常对 照 组 相 比 (5mmol/L 葡 萄 糖),在 高 糖(25mmol/L葡萄糖)培养的48h内,未观察到明显的胶质细胞凋亡(数据未显示);图2、3所示,用高糖(25mmol/L葡萄糖)培养72h后,与正常对照组相比,高糖组胶质细胞凋亡明显。高糖组早期凋亡细胞百分率为20.6%;加入0.1、1、10mmol/L牛磺酸干预后,高糖组细胞凋亡率分别降低至16.4%、5.7%和7.6%,牛磺酸干预组胶质细胞凋亡率明显低于高糖未干预组(P<0.05);不同浓度的牛磺酸对照组与正常对照组胶质细胞凋亡率无明显差异(P>0.05);甘露醇处理不改变正常葡萄糖和高葡萄糖组细胞的凋亡率(P>0.05)。
3 讨论
糖尿病视网膜病变(DR)是常见且严重的糖尿病眼部并发症,也是四大主要致盲疾病之一。随着DM发病率的不断上升,DR的危害亦日趋明显。DR的病因目前还不是十分清楚,而高血糖是发病的主要原因[1]。目前,研究者对DR多采用动物模型进行体内实验研究,在体外建立视网膜胶质细胞高糖模型,模拟体内DM微环境,排除体内其它因素的干扰,在DM病程的特殊时期直接观察细胞的变化,这些是体内动物实验所无法取代的。大量的实验发现,体外培养中25~30mmol/L的高糖浓度可近似地模拟糖尿病患者体内的高糖状态,本实验采用25mmol/L葡萄糖浓度作为模拟体内绝对高糖状态的适宜浓度。
早期的研究大多集中于糖尿病视网膜微血管的改变方面,认为是微血管病变引起了视网膜神经的改变。近年来,研究者通过试验发现,糖尿病初期视网膜微血管并未发生改变,在发病6个月后才能够检测到这一改变,而在此之前视网膜神经元已发生改变[5,6]。上述发现使人们意识到,DR的发病原因可能并非如最初所设想的那样,视网膜神经网膜的改变发生在血管病变之前,并且神经网膜的改变可能进而引起微血管的改变。有学者发现,糖尿病发病6个月时外核层出现明显细胞凋亡,在水平细胞、无长突细胞和神经节细胞中均可检测到不同程度的细胞坏死现象。糖尿病4周时可发生光感受器的凋亡,并且随病程的进展,凋亡细胞数将增加[5]。本研究通过体外25mmol/L高糖培养大鼠视网膜胶质细胞发现,与正常对照组相比,高糖培养后大鼠视网膜胶质细胞的凋亡率明显上升。
牛磺酸是一种酸性氨基酸,主要存在于心脏、视网膜、脑和骨骼肌中,白细胞和血小板中牛磺酸浓度也较高。近年来,牛磺酸的生理作用受到越来越多的关注。有人发现,猫膳食中缺乏牛磺酸时会发生视网膜疾病,灵长类动物试验也得到了类似的结论。孕妇膳食缺乏牛磺酸时会导致母子视网膜疾患,当膳食中补充牛磺酸时症状又会消失[7]。给予糖尿病病人早期治疗可以减少其并发症的发生,从而减少死亡率。那么牛磺酸是否能减少糖尿病的死亡率呢?有人比较了牛磺酸和维生素E加硒后发现,维生素E加硒不能降低糖尿病的死亡率,但牛磺酸则可以明显提高患者的存活率。胰岛素依赖性和非胰岛素依赖性糖尿病患者的血浆和血小板中牛磺酸含量均下降[8,9]。本研究通过体外实验发现,培养基中加入0.1、1、10mmol/L牛磺酸干预后,高糖组细胞凋亡率由20.6%分别降为16.4%、5.7%和7.6%,干预组的细胞凋亡率明显低于高糖未干预组。
[1]Barber AJ,Lieth E,Khin SA,etal.Neural apoptosis in the retina during experimental and human diabetes.Early onset and effect of insulin[J].J Clin Invest,1998,102(4):783-791.
[2]Xi X,Gao L,Hatala DA,etal.Chronically elevated glucoseinduced apoptosis is mediated by inactivation of Akt in cultured Müller cells[J].Biochem,2005,326:548-553.
[3]Aizu Y,Katayama H,Takahama S,etal.Topical instillation of ciliary neurotrophic factor inhibits retinal degeneration in streptozotocin-induced diabetic rats[J].Neuroreport,2003,14(16):2067-2071.
[4]Nakaya Y,Minami A,Haradica N,etal.Taurine improves insulin sensitivity in the Otsuka Long-Evans Tokushima Fatty rat,a model of spontaneous type 2diabetes[J].Am J Clin Nutr,2000,71(1):54-58.
[5]Park SH,Park JW,Park SJ,etal.Apoptotic death of photoreceptors in the streptozotocin-induced diabetic rat retina[J].Diabetologia,2003,46(9):1260-1268.
[6]Abu-El-Asrar A,Dralands L,Missotten L,etal.Expression of apoptosis markers in the retinas of human subjects with diabetes[J].Invest Ophthalmol Vis Sci,2004,45(8):2760-2766.
[7]Franconi A,Loizzo G, Ghirlanda G,etal.Taurine supplementation and diabetes mellitus[J].Curr Opin Clin Nutr Metab Care,2006,9(1):32-36.
[8]Di Leo MAS,Ghirlanda G,Gentiloni Silveri N,etal.Potential therapeutic effect of antioxidants in experimental diabetic retina:A comparison between chronic taurine and vitamin E plus selenium supplementations[J].Free Radic Res,2003,37:323-330.
[9]Odetti P,Pesce C,Traverso N,etal.Comparative trial of N-acetyl-cysteine,taurine,and oxerutin on skin and kidney damage in long-term experimental diabetes[J].Diabetes,2002,52(2):499-505.
