亚甲基桥键的bis-1,3-二羰基化合物的合成概述
2012-09-21王兵南
王兵南
(浙江工业大学工业化学工程与材料学院,浙江 杭州 310014)
精细化工
亚甲基桥键的bis-1,3-二羰基化合物的合成概述
王兵南
(浙江工业大学工业化学工程与材料学院,浙江 杭州 310014)
由于亚甲基桥键的bis-1,3-二羰基化合物具有特殊的结构特性,因此被广泛应用于药物合成,在合成化学和生物化学中受到广泛的重视。本文对亚甲基桥键的bis-1,3-二羰基化合物的合成方法进行了总结,为进一步的研究提供一定的理论依据和支持。
1,3-二羰基化合物;亚甲基桥键;合成方法
亚甲基桥键的bis-1,3-二羰基化合物由于其独特的结构特性,从而具备了多种特殊的化学性质,例如作为重要的有机合成中间体,用于合成杂环类化合物。同时它具有高效的抗菌活性,因而在医学上有着广泛的应用,许多不同的bis-1,3-二羰基化合物及其衍生物可以作为合成活性氨基酸的原料,因此该结构单元被看成是最基本的医学分子之一。另外,亚甲基桥键的bis-1,3-二羰基化合物可以与有机硼化物的螯合物相结合,以及与许多不同的金属配体相络合,因此在合成化学和配位化学中吸引了很多化学家的注意[1-3]。
1 常用的合成方法
1.1 有金属参与的合成方法
1.1.1 Fe2(CO)9
Li[4]在2009年报道了利用Fe2(CO)9和过氧化物催化氧化N,N-二甲基苯胺中的氮的α位的C-H键,得到一个高活性的氮鎓中间体,随后这个中间体与1,3-二羰基化合物进行双烷基化反应,合成亚甲基桥键的bis-1,3-二羰基化合物,由于铁属于无毒和易于获取的廉价金属,反应条件温和,易于操作,因此该方法比较新颖和高效。
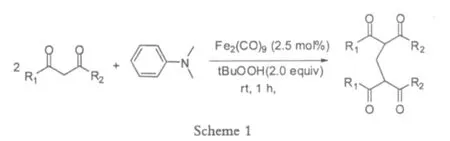
经过反复实验,2.5 mol%的Fe2(CO)9和2.0当量的过氧叔丁醇是最优化的反应条件,产率最可达86%,而且产生的少量副产物,可以通过延长反应时间使之转化为需要的目标产物。随后对其它的N-甲基胺类化合物,也做了一系列的对比实验,经过对比表明脂肪族的甲基胺的活性效果不如芳香族胺,并且带吸电子基团的芳香族胺产率低于带斥电子基团的芳香族胺。对于1,3-二羰基化合物,对不同的取代基进行一系列的比较,并没有发现明显的取代基效应和电子效应,说明该反应的应用范围比较宽广和适应性比较强。
在此基础之上,Li利用得到的bis-1,3-二羰基化合物进一步与肼类结构反应得到了二吡唑化合物,以及和醋酸铵反应得到了1,4-二烷烃的吡啶化合物。
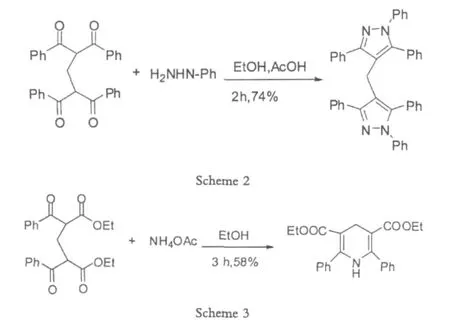
二吡唑化合物以及1,4-二烷烃的吡啶化合物都属于典型的杂环芳香化合物和重要的天然产物,有重要的生物活性,受到广泛的注意。
而在此之前,Bolm[5]于2005年使用铁(III)复合物催化合成bis-1,3-二羰基结构,氧化剂是30%水合的过氧化氢,但是,产率低于Li的方法得到的产率,反应时间相对更长,而且过氧化氢的当量比值也大于过氧叔丁醇,所以,总体来说,Li的方法比Bolm的相对进步了许多。
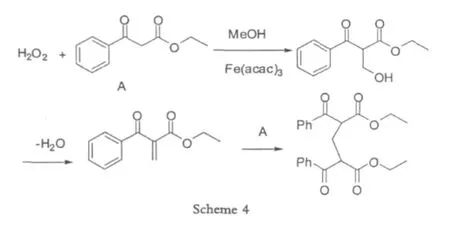
1.1.2VO(acac)2
Mannich反应广泛的应用于三级胺和二级胺衍生物的合成,并且这些衍生物在合成生物活性分子和天然产物分子中扮演了重要的角色。2002年Uang[6]在Mannich反应中使用氮的氧化物和VO(IV),VO(V)的催化剂,比如VO(OiPr)3,以及水合VOSO4等等,通过形成C-N化合物做为桥梁,得到目标产物。之前有人使用过三氟醋酸酐、二氧化硫之类的促进剂,但是要么实验不易于操作,要么价格昂贵,或者化学计量数大,原料消耗多,因此在这个基础上,Uang选择了N-氧化物。虽然对于胺的氧化有过很多的报道,但是使用钒,从胺的氧化物合成N-氧化物的方法。Mannich反应结束之后,形成的胺进行了α,β-消除反应,然后两分子的1,3-二羰基化合物通过迈克尔加成,得到亚甲基桥键的双分子偶合产物。
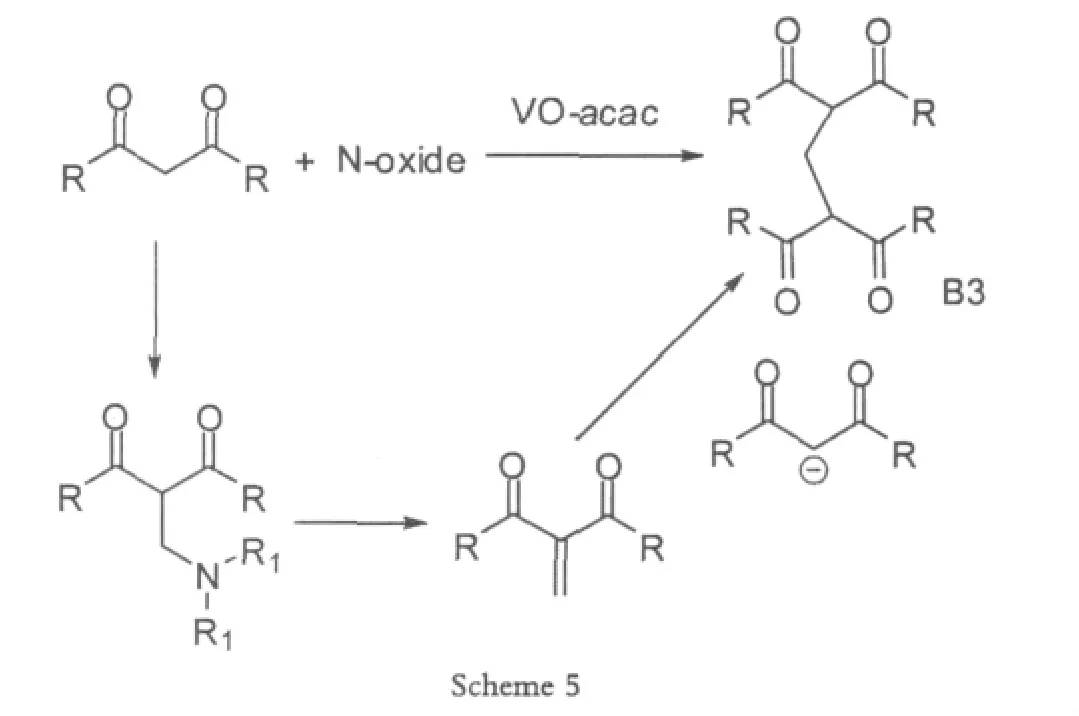
Scheme 5反应中,氮的氧化物的适用范围比较少,只有少数氧化物的产率比较高,在54%~77%之间,不过这里对于VO的使用量比较少,节约催化剂,成本减少,反应条件温和,易于操作。
1.1.3 Co(III)
Nishinaga[7]于2009年使用Co(III)在中性的环境中得到了需要的目标产物,但是这个反应对合成条件的要求比较高,尤其对于温度和时间特别敏感,必须得到高效的控制,比如,反应温度在25℃和反应时间为0.5 h的时候,产率最高可以达到98%。然而温度高于25℃的时候,会有3种以上的不同副产物产生,而且几乎没有期望的产物出现。相对于铁的催化剂来说,Co(III)催化剂的获取比较麻烦,而且比较贵重,不利于大规模的使用。
虽然有比较多的缺点,但是这个反应具有高产率的优点,只要反应操作得当,条件优化合适,产率几乎可以达到100%。
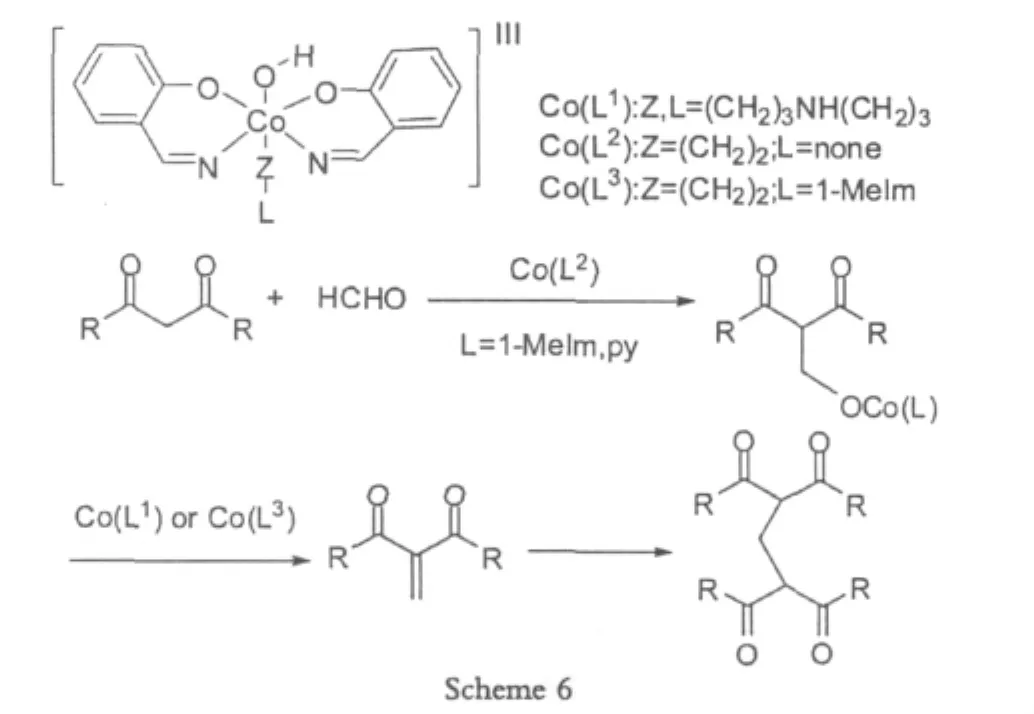
总之,使用金属合成亚甲基桥键的bis-1,3二羰基化合物,金属配体比较难以获取,成本较高,反应条件稍微复杂,而且不利于大规模的使用。
不过,在此之外,有人使用无金属参与模式以及更简便和易于操作的反应条件。
1.2 无金属参与的合成方法
1.2.1使用甲醛的合成方法
在这个过程中,利用甲醛做为亚甲基桥键的来源,但是,需要注意的是这个带有亚甲基桥键的中间体非常活泼,极易与其它活泼基团发生多种反应,如Scheme 7所示,这就对1,3-二羰基化合物的取代基提出了相对高的要求[8],要求避免大量副产物的生成,有利于提高产率。
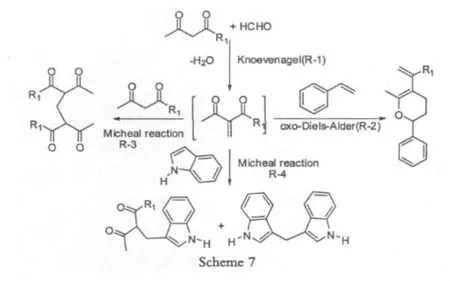
由于成本低廉,和无金属参与,利用甲醛的反应在合成中受到广泛的应用。2008年为了合成N-胺基化的Hantzsen反应产物Studer[9-11]使用甲醛做为碳源合成bis-1,3-二羰基化合物(Scheme 8)。
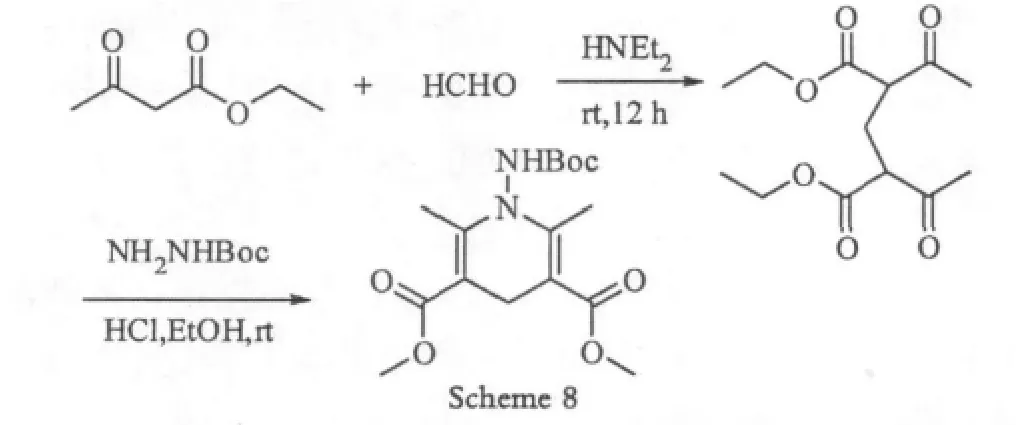
从Scheme 8中可以看出,利用甲醛作为反应关键底物,反应时间需要12 h左右,但是反应只需要在室温即可进行,原料简单易得,成本较低,因此常常做为合成中的参考路线之一。
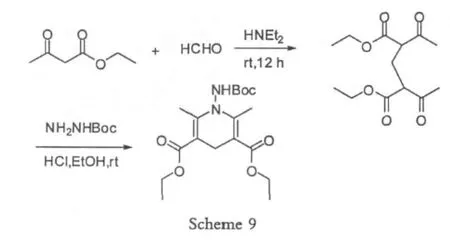
在甲醛的使用过程中,对于溶剂的选择非常重要,不同的溶剂环境,导致不同的反应产物[12],选择DMSO或者DMF的时候产率较好,可能是因为它们极性较强的缘故。
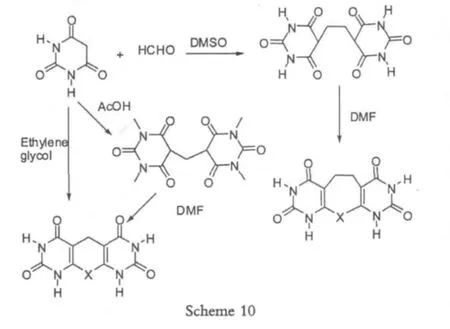
因此许多研究员对于甲醛的反应条件做过较多的研究,寻找更加优化的反应条件。1994年Hamelin[13-14]在微波辐射中,几分钟之内完成了bis-1,3-二羰基化合物的合成,这也是目前为止反应时间最短的条件,但是最大的缺点就是反应产率比较有限。2005年Li[15]使用超声波,以水为反应介质,利用甲醛和1,3-二羰基化合物,合成了亚甲基桥键的自偶合产物,但是由于超声波的使用,使得这个反应条件得不到大规模的使用,而且使用的范围也有限。2003年Schmeyers[16]在无溶剂条件下,先后经历Kno-evenagel condensation reaction和Michael addition reaction,得到目标产物,但是该实验操作相对而言比较复杂,产率不是很高。2009年Jerod[17]进一步完成了离子液体中对于这个结构的合成,最大的优势就是产率的提升,但是需要离子液体,所以比较成本高。
1.2.2亚甲基卤化物
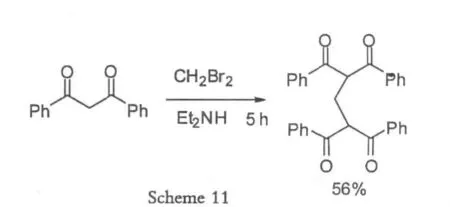
2003年Hon[18]在微波辐射条件下,使用二溴甲烷做为碳源,以一锅煮的形式完成了bis-1,3-二羰基化合物的合成,反应条件温和,易于操作,而且微波辐射可以极大的缩短反应时间,由常规的十几个小时降低为一个小时左右,并且二溴甲烷和二乙胺的化学计量数比值也降低了,因此在实验室合成中得到有效应用,成本较低。
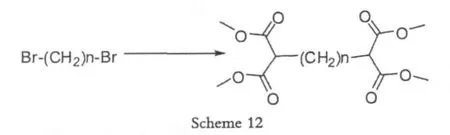
1990年Baker[19]在合成聚合物的过程中,使用二溴N烷(N=1~13),成功得到bis-1,3-二羰基结构的聚合物。
相比较而言,产率不如使用甲醛那么高。但是无论是甲醛,还是二溴甲烷,均需要对反应条件做比较多的优化,而且不利于中试以及放大生产,比较适合实验室合成。
1.2.3环六亚甲基四胺
Singhal[20]等人研究了环六亚甲基四胺和二苯甲酰甲烷在甲醇、乙醇、水等条件下的反应,得到亚甲基双(二苯甲酰甲烷),反应收率达到100%。
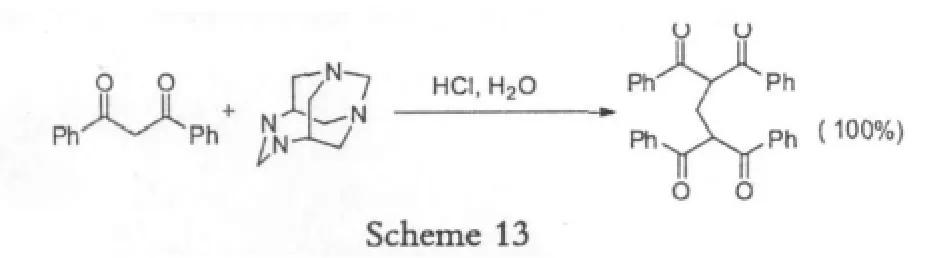
这里对于溶剂的要求比较低,产率高,而且无金属参与,因此在合成中得到比较多的应用。
2 新的探索
到目前为止,还没有出现经由自由基反应合bis -1,3-二羰基化合物,比如通过形成插入卡宾的方式形成亚甲基桥键,或者通过光催化合成等,因此可以做为一种合成思路,进行一定程度的尝试和探索。另外,对于催化剂的选择,如果能寻找到一种合适的微量催化剂,可以快速降低反应成本,并且基于原子经济性和绿色化学的要求,寻找到合适的非金属的、高产率的绿色催化剂也比较重要。
3 结论
本文对几种常用的合成bis-1,3-二羰基化合物的方法进行了总结和比较,希望能为其他人进一步的研究bis-1,3-二羰基化合物提供一定的理论依据。
[1]Hono T,Nishiguchi I,Komamura T,et al.Novel synthesis of alpha-methylene carbonyl compounds [J].J.Am. Chem.Soc,1979,101:984-987.
[2]Nicholas K M,Bayer M.Synthetic applications of transition-metal-stabilized carbenium ions.Selective alkylation of ketones and ketone derivatives with (propargyl)dicobalt hexacarbonyl cations[J].J.Am.Chem.Soc,1980,102:2508-2510.
[3] (a).Narayanan V Florida.Scientist[M].Florida Academy of Sciences,1993,4:202-203.(b).Priya N P, Arunachalam S V, Jayabalakrishnan C. Catalytic and antimicrobial studies of binuclear ruthenium(III)complexes containing bis-β-diketones[J].Transition.Met.Chem,2009,34: 437-445.
[4](a).Li H,He Zh,Guo X,et al.Iron-catalyzed selective oxidation of N-methyl amines:highly efficient synthesis of methylene-bridged bis-1,3-dicarbonyl compounds[J].Org.Lett, 2009,18:4176-4179.(b).Heller S,Natarajan S R.A highly regioselective synthesis of 1-aryl-3,4,5-substituted pyrazoles based on the condensation of 1,3-diketones with arylhydrazines proceeds at room temperature in N,N-dimethylacetamide and furnishes pyrazoles in good yields[J].Org.Lett,2006,8:2675.
[5](a).Lecomte V,Bolm C.Adv.Synth.Catal[M].John Wiley&Sons,2005,347:1666-1672.(b).Blaser F,Deschenaux P,Kailimopoulos T.The (-)-(2S)-diethyl 2-hydroxyhexanedioate,a new chiral building block for enantioselective synthesis[J].Helv.Chim.Acta,1991,74:141-145.(c).Hubert A J,StarcherP S.The baeyer-villigeroxidation ofalkyl oxocyclohexanecarboxylates[J].J.Chem.Soc,1968:2500.
[6](a).Wang D H,Uang B.A modified mannich-type reaction catalyzed by VO(acac)2[J].Org.Lett,2002,3:463-466. (b).Singhal S,Jain S,Sain B.An efficient aerobic oxidative cyanation oftertiary amines with sodium cyanide using vanadium based systems as catalysts[J].Chem.Commun,2009: 2371-2372.
[7](a).Maruyama K,Kubo K,Toda Y,et al.Highly selective aldol reaction of dibenzoylmethanes with formaldehyde catalyzed by cobalt schiff base complex under neutral conditions [J].Tetrahedron.Letters,1995,36:5609-5612.(b).Maruyama K, Kubo K,Toda Y,et al.Highly selective aldol reaction of dibenzoylmethanes with formaldehyde catalyzed by cobalt Schiff base complex under neutral conditions[J].Tetrahedron Lett, 1995,36:5609-5612.
[8](a).Tan J,Lia H,Gu Y.Water mediated trapping of active methylene intermediates generated by IBX-induced oxidation of Baylis-Hillman adducts with nucleophiles[J].Green. Chem,2010,12:1772-1782.(b).Gu Y,Sousa R,Frapper G, Barrault J.Catalyst-free aqueous multicomponent domino reactions from formaldehyde and 1,3-dicarbonyl derivatives[J]. Green.Chem,2009,11:1968-1972.(c).Gu Y,Barrault J. Trapping of active methylene intermediates with alkenes,indoles or thiols:towards highly selective multicomponent reactions[J]. Adv.Synth.Catal,2009,351:3269-3278.(d).Tietze L F. Synthesis of the deoxyaminosugar(+)-d-forosamine via a novel domino-knoevenagel-hetero-diels-alder reaction[J].Org.Lett, 2009,11:2948-2950.(e).Tietze L F,Beifuss U.Sequential transformations in organic chemistry:a synthesis strategy with a future[J].Angew.Chem,1993,32:131-163.
[9](a).Blakemore P,Kilner C,Norcross N.A practical synthesis of(±)-α-isosparteine from a tetraoxobispidine core[J]. Org.Lett,2005,7:4721-4724.(b).Breuing M,Hein D.Aflexible route to chiral 2-endo-Ssubstituted 9-oxabispidines and their application in the enantioselectiveoxidation of secondary alcohols[J].J.Org.Chem,2009,74:1407-141.
[10](a).Guin J,Studer A.Thiolkatalysierte stereoselektive transferhydroaminierung von olefinen mit N-aminierten dihydropyridinen[J].Angew.Chem.Int.Ed,2008,47:779-782.(b). VKatritzky A J,Katritzky J W.N-oxides and related compounds: The synthesis of N,N′-linked bi(heteroaryls)[J].Tetrahedron, 1975,31:1549.
[11](a).Alcarazo M,Lassaletta J M.Synthesis,structure and electronic properties of N-dialkylamino-and N-alkoxy-1,2, 4-triazol-3-ylidene ligands[J].J.Organomet.Chem,2005,690: 5979-5988.(b).Hedge J,Kruse C,SnyderH.Some condensation reactions of isopropylidene malonate[J].J.Org. Chem,1961,26:3166-3170.
[12]Sachar A, Gupta P, Gupta Sh,et al.A novel approach towards the synthesis of tricyclic systems based on pyridine,pyran,thiopyran,azepine,oxepin,thiepin,and pyrimidine rings under different solvent conditions[J].Can.J. Chem,2010,88:478-484.
[13]Ayoubi S,Boullet F,Hamelin J.Minute Synthesis of electrophilic alkenes under microwave irradiation [J]. Tetrahedron Lett,1997,43:7563-7564.
[14]Michaud D,Hamelin J.Michael monoaddition of nitromethane on gem-diactivated alkenes in dry media coupled with microwave irradiation[J].Synthesis,1994:258-260.
[15]Du J,Li L.Ultrasound promoted condensation of aldehydes and meldrum's acid in aqueous media[J].Chemistry (Rajkot,India),2005,2:85-88.
[16]Kaupp G,Jamal M,Schmeyers J.Solvent-free knoevenagel condensations and michael additions in the solid state and in the melt with quantitative yield[J].Tetrahedron, 2003:3753-3760.
[17]Tahmassebi D,Wilson L,Jerod M.Knoevenagel condensation of aldehydes with meldrum's acid in ionic liquids [J].Synthetic Communications1,2009,39:2605-2613.
[18]Hon Y,Hsu T,Chen Ch,et al.Dibromomethane as one-carbon source in organic synthesis:microwave-accelerated α -methylenation of ketones with dibromomethane and diethylamine[J].Tetrahedron,2003,59:1509-1520.
[19]George R,BakerG,AraiS.Synthesis and characterization of two-directional cascade molecules and formation of aqueous gels[J].J.Am.Chem.Soc,1990,112: 8458-8465.
[20]Singhal S,Jain S.An efficient aerobic oxidative cyanation oftertiary amines with sodium cyanide using vanadium based systems as catalysts[J].Chem.Commun,2009: 2371-2372.
Methods to Produce Methylene-bridged Bis-1,3-dicarbonyl Derivatives
WANG Bing-nan
(Zhejiang University of Technolgy,Hangzhou 310014,China)
Methylene-bridged bis-1,3-dicarbonyl derivatives are widely used in pharmaceuticals,and have also been paid much attentions in synthetic chemistry and biochemistry due to their special structural characteristics.We summarized the reported methods for the synthesis of methylene-bridged bis-1,3-dicarbonyl derivatives,which provided a theoretical basis and support for their further research.
1,3-dicarbonyl compounds;methylene-bridged;synthetic methods
1006-4184(2012)07-0008-05
2011-12-27
王兵南(1986-),男,安徽安庆人,硕士,主要从事有机合成研究。
