成膜基质对氟化物涂膜抑制釉质早期龋的效果
2012-09-20桂亚婕赵信义侯绍杰李雅萍张文彦
桂亚婕,赵信义,侯绍杰,李雅萍,张文彦
(第四军医大学口腔医院,陕西西安710032)
氟化物涂膜(fluoride varnish)又称为氟涂膜或氟涂漆,是一种含有较高浓度氟的局部用缓释氟防龋材料,常用于儿童或龋病高发人群。涂在牙齿表面后,氟化物涂膜可粘附于牙面一段时间,此期间能缓慢释放较高浓度的氟离子,部分氟离子进入釉质中与羟基磷灰石的羟基置换,使羟基磷灰石转换为氟磷灰石,后者具有更强的抗酸蚀性能,从而提高釉质的抗龋损性能[1-2]。氟化物涂膜的这种性能与其缓释氟性能密切相关,而后者又与其载体—成膜基质密切相关[3]。
本研究通过釉质表面定量光诱导荧光分析、表面显微硬度测定和截面显微偏光观测等方法,分析比较成膜基质对氟化物涂膜抑制釉质早期龋的效果,以期为研制新型氟化物涂膜提供实验基础。
1 材料和方法
1.1 实验材料、仪器和相关试剂配制
1.1.1 主要材料和仪器
渗透型丙烯酸树脂(Eudragit RL100,Evonik Röhm GmbH,德国);珂巴树脂(Copal resin,杭州奥圆工贸有限公司);聚合松香(福建武平林产化工厂);聚乙烯醇缩丁醛(成都市科龙化工试剂厂);甲基丙烯酸乙酯共聚树脂(上海九龙精细化工有限公司);市售氟化物涂膜:Duraphat(含50 g/L氟化钠,Colgate Oral Pharmaceuticals,UK);SYJ-150A低速金刚石切割机(沈阳科晶设备制造有限公司);X-1000型显微硬度计(上海秦明光学仪器公司);Leica DM6000B研究级显微镜和所带Las AF软件(德国);XP-330C偏光显微镜(上海蔡康光学仪器有限公司)。
1.1.2 氟化物涂膜材料配制
分别称取定量的渗透型丙烯酸树脂、珂巴树脂、聚合松香、聚乙烯醇缩丁醛、甲基丙烯酸乙酯共聚树脂,各加于分散有定量氟化钠(分析纯)的乙醇中,制成5种含氟化钠5wt%、相应成膜基质20 wt%的溶剂挥发快干型氟化钠涂膜材料,使用前需充分摇匀[3]。
1.1.3 脱矿液和再矿化液(pH循环液)的配制
参照文献[4]配制。脱矿液:2.0 mmol/L Ca(NO3)2·4H2O、2.0 mmol/L NaH2PO4·2H2O、0.075 mol/L 醋酸缓冲液、0.04 mg/L F-,用浓盐酸调 pH 值至 4.7。再矿化液:1.5 mmol/L Ca(NO3)2·4H2O、0.9 mmol/L NaH2PO4·2H2O、0.15 mol/L KCl、0.02 mol/L 二甲砷酸盐缓冲液、0.05 mg/L F-,用浓盐酸调 pH 值至 7.0。
1.2 方法
1.2.1 釉质试样的制备和相关指标基线的测定
选择近1个月拔除的釉质发育正常、无缺损、隐裂的牛上颌切牙,切除牙根,取牙冠充分清洁后,用低速金刚石切割机切割成5 mm×5 mm×3 mm的小块,分别用自凝树脂包埋并暴露唇面釉质。然后分别用#800、#1200、#2000碳化硅水砂纸在注水下依次磨抛釉质面,最后用粒度为1.0 μm的金刚石抛光膏抛光至镜面状,超声清洗,在体视显微镜下确认釉质表面无裂纹后将每个釉质块表面划分为4个区域(图1)。a区域为阳性对照区域,试验过程中仅接受pH循环处理;b区域为试验区域,pH循环前应用氟涂膜;c区域为阴性对照区域,试验过程中表面覆盖指甲油涂膜。
将上述制备的所有样本分别用显微硬度计,以维氏压头在载荷25 g,保荷10s[5]的条件下测定各釉质块表面显微硬度(surface microhardness,SMH)。每个釉质块表面每个区域测3个点,各点相距100~200 μm,结果取平均值,记为SMH0。然后从中挑选SMH 值在330~390 kg/mm2[6]范围的釉质块90个,分别置荧光显微镜下,以波长355~425 nm的紫外光照射釉质表面,并以曝光250、饱和度100、亮度5、增益系数5、多色带通滤光镜255 nm、吸收滤光片270 nm等参数拍摄釉质表面荧光图像;通过系统自带软件(Las AF,德国)成图并测量各试样表面各区域的平均灰度值F0(gray values)。
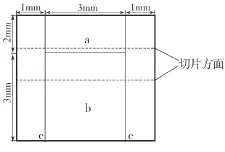
图1 釉质试样块表面分区示意图
1.2.2 不同成膜基质,氟化物涂膜对釉质早期龋的抑制效果
1.2.2.1 釉质试样块的试验分组和处理
将经基线检测的90个釉质试样块按不同氟化物涂膜材料随机分成6组,每组15个,并在各组每个试样块表面的a、c区域涂布两层抗酸指甲油,吹干后再在各组试验区域(b区)用小毛刷按分组涂布相应的氟化物涂膜材料,涂布后立即置37℃、100%湿度环境中。12 h后取出,用无脂棉签蘸丙酮液彻底溶解除去氟化物涂膜和指甲油涂膜,超声清洗并吹干后,重新在c区域表面涂布两层抗酸指甲油。然后将所有试样块置pH循环液中循环7 d,前5 d每天先浸泡于脱矿液6 h后,再浸泡于再矿化液17 h;最后2 d全部浸泡于再矿化液中。pH循环在37℃恒温振荡水浴箱中进行,单位面积(mm2)釉质暴露面需脱矿液 2.22 mL,再矿化液 1.11 mL[7],每天更换 1 次新的 pH 循环液,每次换液前和循环结束后均用去离子水彻底冲洗各试样表面。
1.2.2.2 pH循环结束后釉质试样的荧光值、显微硬度值和脱矿深度的测定
pH循环结束后,用丙酮液去除所有样本表面指甲油涂膜,大量去离子水冲洗并干燥后,分别置荧光显微镜下再次观测表面各区域的平均灰度值F1(观测参数同前)。以每个釉质试样块同一区域pH循环前后两次测得的灰度值之差表示各区域的荧光损失量,并由下式计算平均荧光损失率之后再按前述相同的方法测定每个釉质表面各区域的显微硬度,记为SMH1,并由下式计算各区域pH循环后表面显微硬度的下降率
最后将每个试样于a、b区域分界处垂直切开,分别用自凝塑料包埋切开的两块釉质试样并暴露剖面后,用硬组织切片机制备厚100 μm的釉质切片(图1)。每个釉质块制备3张切片,用中性树脂胶封片后于偏光显微镜下观察并拍照,在电脑上用测量软件(DL-3000,上海蔡康光学仪器有限公司)测量釉质表层下脱矿的深度,每个切片测量5个点取均值。
1.3 统计学分析
采用SPSS 13.0统计软件进行统计分析,釉质块各个区域pH循环前后釉质表面灰度值、SMH比较用配对t检验;各组△F%、△SMH%和脱矿深度采用单因素方差分析,组间多重比较采用LDS-t检验,检验水准 α =0.05。
2 结果
2.1 pH循环前后各组釉质表面荧光值和荧光损失量的比较(图2,表1)
pH循环前各组基线灰度值(F0)基本一致,组间均无统计学差异(P>0.05);pH循环后,除阴性对照区域(c区)外,各组阳性对照区域(a区)和试验区域(b区)荧光值(F1)均较基线显著下降,差异有统计学意义(P<0.05);不同组间荧光损失率(△F%)相比,各组试样的阴性对照区域均显著小于阳性对照区域和试验区域(P<0.05);而且各组试验区域均显著小于阳性对照区域(P<0.05),说明pH循环能够使釉质发生脱矿,在釉质表面应用氟化物涂膜,能够显著提高釉质的抗脱矿能力。
6种成膜基质氟化物涂膜材料组间△F%相比,以渗透型丙烯酸树脂基质组的荧光损失率最小,与其他5组相比差异均有统计学意义(P<0.05);而Duraphat组、珂巴树脂组、聚乙烯醇缩丁醛组和聚合松香组次之,甲基丙烯酸共聚树脂组的平均荧光损失量最大,但5组间均无统计学差异(P >0.05)。
表1 pH循环前后各组试样各区域平均荧光值和荧光损失率的比较(s)
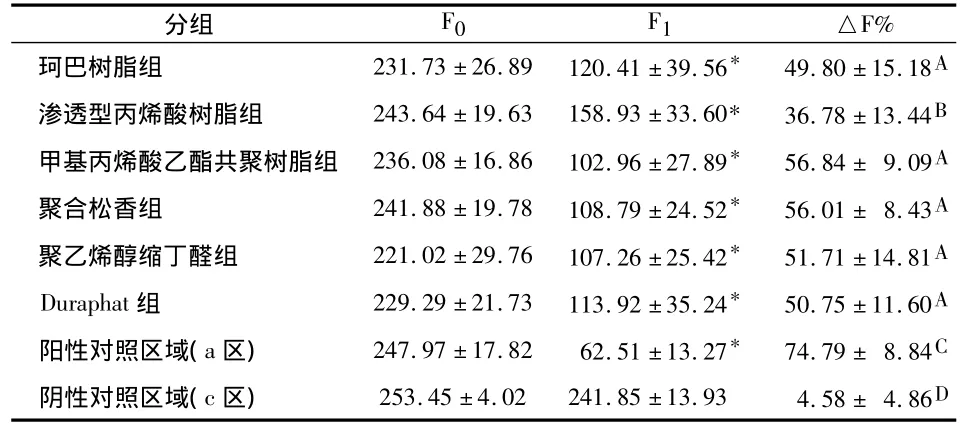
表1 pH循环前后各组试样各区域平均荧光值和荧光损失率的比较(s)
*与同一组pH循环前相比P<0.05;不同字母为各组间荧光损失率相比P<0.05
F%珂巴树脂组 231.73 ±26.89 120.41 ±39.56* 49.80 ±15.18分组 F0 F1 △A渗透型丙烯酸树脂组 243.64 ±19.63 158.93 ±33.60* 36.78 ±13.44B甲基丙烯酸乙酯共聚树脂组 236.08 ±16.86 102.96 ±27.89* 56.84 ± 9.09A聚合松香组 241.88 ±19.78 108.79 ±24.52* 56.01 ± 8.43A聚乙烯醇缩丁醛组 221.02 ±29.76 107.26 ±25.42* 51.71 ±14.81A Duraphat组 229.29 ±21.73 113.92 ±35.24* 50.75 ±11.60A阳性对照区域(a区)247.97 ±17.82 62.51 ±13.27* 74.79 ± 8.84C阴性对照区域(c区)253.45 ±4.02 241.85 ±13.93 4.58 ± 4.86D
2.2 pH循环前后各组釉质表面显微硬度的比较(表2)
pH循环前,各组基线显微硬度值(SMH0)基本一致,组间均无统计学差异(P>0.05);pH循环后,除阴性对照区域(c区)外,各组阳性对照区域(a区)和试验区域(b区)硬度值(SMH1)均较基线明显下降,差异有统计学意义(P<0.05);不同组间显微硬度下降率(△SMH%)相比,相对于阴性对照区域,阳性对照区域和试验区域的硬度值虽均有明显下降(P<0.05),但各组试验区域的下降率均明显小于阳性对照区域(P<0.05),说明氟化物涂膜对釉质有明显的保护作用。
6种成膜基质氟化物涂膜材料组间△SMH%相比,渗透型丙烯酸树脂氟涂膜组的△SMH%最小,甲基丙烯酸共聚树脂组最大,各分别于其他5组相比差异均有统计学意义(P<0.05);Duraphat组、珂巴树脂组、聚合松香和聚乙烯醇缩丁醛组之间相比差异均无统计学意义(P>0.05)。
表2 pH循环前后各组试样各区域表面显微硬度比较(kg/mm2s)

表2 pH循环前后各组试样各区域表面显微硬度比较(kg/mm2s)
*与同一组pH循环前相比P<0.05;不同字母为各组间△SMH%相比P<0.05
SMH%珂巴树脂组 354.32 ±8.57 157.08 ±36.95* 55.62 ±10.55分组 SMH0 SMH1 △A渗透型丙烯酸树脂组 351.18 ±11.23 188.17 ±32.30* 49.28 ± 9.91B甲基丙烯酸乙酯共聚树脂组 355.13 ±11.24 135.62 ±29.70* 61.76 ± 8.60C聚合松香组 350.00 ±8.71 147.59 ±36.69* 57.90 ±10.08A聚乙烯醇缩丁醛组 350.30 ±15.52 147.20 ±35.69* 57.88 ±13.19A Duraphat组 351.61 ±8.67 153.63 ±38.00* 56.38 ±10.38A阳性对照区域(a区)352.51 ±14.23 49.83 ±12.02* 85.95 ± 3.50D阴性对照区域(c区)351.62 ±15.22 346.98 ± 9.45 2.30 ± 1.68E
2.3 pH循环后各组脱矿深度的比较(表3)
偏光显微镜下可见正常釉质呈负性双折射(透光)(图3A);试验区域和阳性对照区可见以表层下脱矿为主要特征的病理改变,呈负性双折射的表层和紧接下面呈正性双折射(不透光)的病损体部;与阳性对照区相比,试验区域脱矿深度相对较浅,病损体部出现负性双折射的再矿化干涉条带,部分切片还可观察到呈负性双折射的透明层(图3B-H)。脱矿深度测量结果显示:各组试验区域(b区)的脱矿深度均显著小于阳性对照区域(a区)(P<0.05);不同成膜基质氟涂膜处理釉质表面脱矿深度相比,渗透型丙烯酸组的脱矿深度显著小于其他涂膜组(P<0.05);甲基丙烯酸共聚树脂组与聚合松香组的脱矿深度无显著性差异(P>0.05),但均显著大于其他涂膜组(P <0.05);Duraphat组、珂巴树脂组和聚乙烯醇缩丁醛组的脱矿深度介于中间,且三者间无显著性差异(P>0.05)。
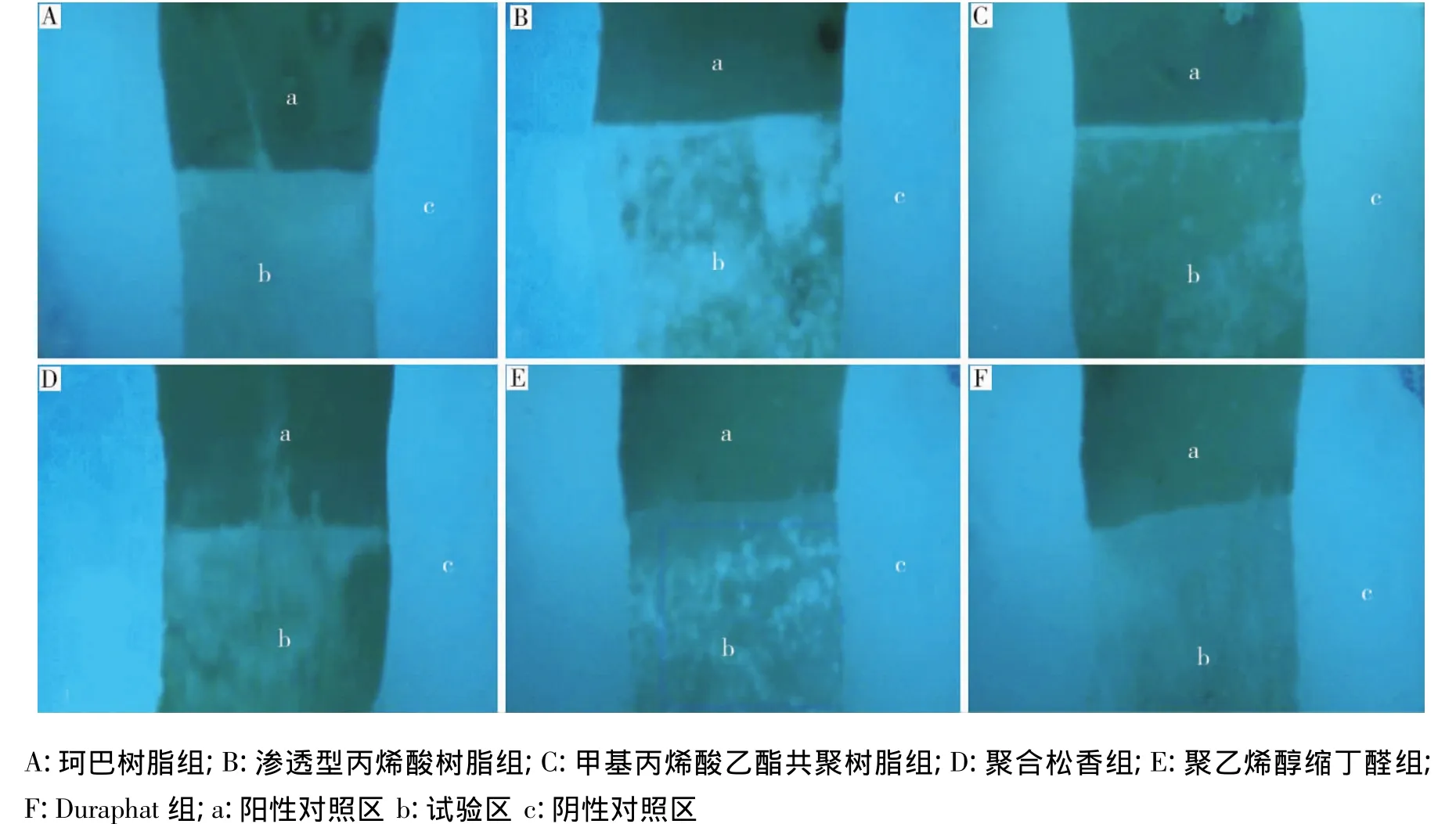
图2 6组试样块pH循环后的荧光图像

图3 各组试验区域和阳性对照区域釉质表面典型早期龋的显微偏光图像
表3 pH循环后各组釉质表面脱矿深度比较(μms)
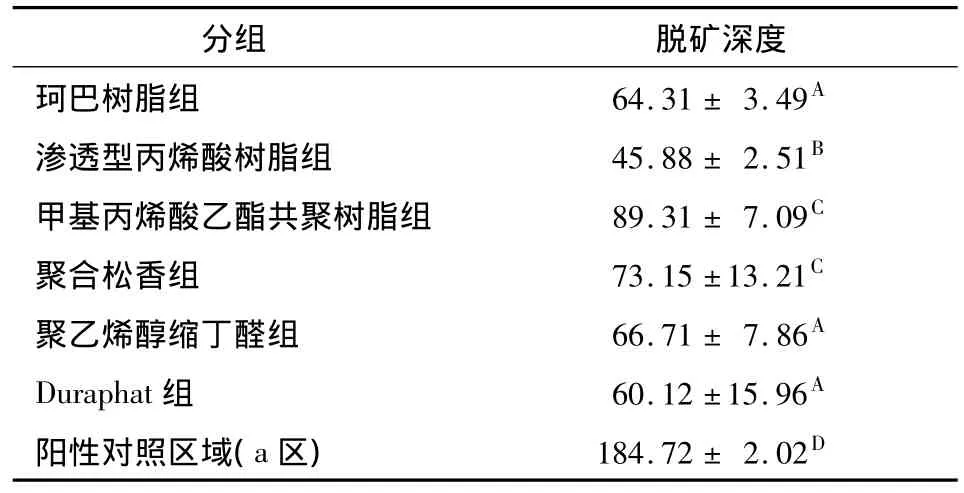
表3 pH循环后各组釉质表面脱矿深度比较(μms)
不同字母组间P<0.05
分组 脱矿深度珂巴树脂组 64.31 ± 3.49A渗透型丙烯酸树脂组 45.88± 2.51B甲基丙烯酸乙酯共聚树脂组 89.31± 7.09C聚合松香组 73.15 ±13.21C聚乙烯醇缩丁醛组 66.71± 7.86A Duraphat组 60.12 ±15.96A阳性对照区域(a区)184.72± 2.02D
3 讨论
口腔环境中釉质龋的形成过程是脱矿与再矿化的动态失衡过程,所形成的釉质早期龋仅局限于釉质表层内,尚未造成釉质实质性缺损,其典型病理特征是釉质表面层损坏极少而相对完整,表面层下方釉质脱矿明显。本研究采用体外pH循环法模拟口腔内釉质龋损的形成过程,结果显示,所形成的龋损符合釉质早期龋的病理特征,说明体外pH循环法能有效形成与体内相似的龋损形成环境。
牙齿硬组织具有自发荧光性,即在某些波长的光线照射后能够发出荧光,而且其荧光强度与硬组织中的矿物质含量具有一定的正相关关系,因此,测定釉质表面的荧光强度,可定量反映釉质脱矿程度[8-9]。根据这一原理,实验所使用的 Leica DM6000B研究级显微镜采用高压汞灯为激发光源,配备有精确控制激发光强度的控制系统,以保证每次进行荧光测定时各种条件的一致性;同时还配有高过滤光镜和吸收滤光片,不仅能消除所选波段外其他光源的干扰,还可有效过滤反射光,以确保测定结果的准确性,并且还配备有适用于荧光拍照的单色高分辨率冷CCD,能够精确记录釉质荧光图像。该方法测定快速、简便;重复性、量化性好;测定区域大;结果的代表性强;不破坏试样[10];且所得结果与传统显微X线透射法有高度的一致性。
显微硬度和釉质截面显微偏光观测都是经典的釉质脱矿观测方法。本研究发现:虽然早期釉质龋表面为“完整表层”,但所测定的龋损表面显微硬度值明显降低。这可能是由于釉质表面在菌斑作用下发生早期溶解,矿物质丧失,而产生孔隙并不断扩大所导致的表层组织疏松的缘故[11]。结果与荧光显微镜相符,说明此时表面层已发生病理性破坏。
显微偏光观测根据其具有非均质性超显微结构的矿物质或晶体都具有双折射的特性,不仅可以测量龋损的深度,同时还可反映龋损的范围和形态[12]。本研究测定结果显示:pH循环液能导致釉质表层下约184.72 μm深度范围内脱矿,使用氟化物涂膜后仅41.45~103.09 μm 深度不等的脱矿,脱矿深度以渗透型丙烯酸组最浅(P<0.05),即其抗脱矿效果最好。
本研究在实验设计上采用自身对照,同一个釉质试样块上既有阴性对照区也有阳性对照区,可事先对影响实验的因素加以控制,使之尽可能均衡,减少误差,从而保证了结果的可靠性。同时运用自身配对,即以同一试样在实验前后两次结果的差值,并换算出其变化率作为统计分析指标,避免了不同试样之间的不均一性对结果的干扰,增强了组间可比性。实验发现,所用5种氟化物涂膜均能有效提高釉质抗脱矿性能。虽然其氟化物含量均相同,但提高釉质的抗脱矿性能却不同,说明成膜基质对氟化物的抗脱矿效果有明显影响。我们先前的研究结果表明[3]:成膜基质对氟化物的释放性能有明显影响,不同成膜基质氟化物涂膜的短期(24 h内)释氟率的顺序与本研究测定的提高釉质抗脱矿能力的顺序基本吻合。说明氟化物涂膜的释氟性能是影响其提高釉质抗脱矿能力的重要因素。
氟化物涂膜主要由氟化物、成膜基质和挥发性溶剂组成,其中成膜基质是氟化物的缓释载体,通常要求成膜基质有一定的强度和吸水性,以便吸水后能缓慢释放防龋活性物质,其主要作用就是使涂膜粘附于釉质表面和赋予氟离子的缓慢释放[13]。
从涂膜基质的化学结构和性能来看,渗透型丙烯酸树脂是一种醇溶性药用缓释高分子材料,其化学结构中含有强亲水性基团-季胺盐基团[14],不溶于水,但在水中可溶胀,形成一种亲水性骨架型缓释系统,渗透性强。珂巴树脂是一种由热带树木分泌的天然树脂,在水中有一定的溶解性和良好的溶胀性,在溶胀过程中吸收水分导致所含的氟化物溶解,释放氟离子[15]。聚乙烯醇缩丁醛是一种醇溶性树脂,不溶于水,但其分子结构上含有一定量的亲水性基团羟基,形成不溶性缓释骨架系统,且具有优良的粘附性,能在牙齿表面保留较长时间。聚合松香是松香的低聚物,主要成分是枞酸型树脂酸的二聚体[16],亲水性基团较少,性能稳定。甲基丙烯酸乙酯共聚树脂是甲基丙烯酸乙酯与甲基丙烯酸的低分子量共聚物,亲水性基团少,水中渗透性也较小,属于疏水性缓释骨架材料[14]。Duraphat是一种糊状氟涂膜材料,其有效成分为50 g/L氟化钠,并以中性松香树脂作为成膜材料,松香树脂在分子结构上具有共轭双键和典型羧基,有一定的亲水性。由此可见,不同成膜基质在化学结构上的差异,可能会导致其渗透吸水性的不同,从而影响涂膜中氟化物的溶解和氟离子的释放。最终导致相同氟含量不同成膜基质的氟化物涂膜抗脱矿效果的差异。
综上所述,氟化物涂膜对于抑制釉质早期龋的能力与其成膜基质密切相关,本实验选用的6种氟涂膜虽均能促进釉质再矿化,抑制早期龋的形成和发展,但效果不同,以渗透型丙烯酸树脂为基质的氟涂膜效果较好。
[1]Beltran-Aguilar ED,Goldstein JW,Lockwood SA.Fluoride varnishes:a review of their clinical use,cariostatic mechanism,efficacy and safety[J].J Am Dent Assoc,2000,131(5):589-596.
[2]郭媛珠,凌均启,李成章.氟与口腔医学[M].北京:科学技术文献出版社,2000:73.
[3]王佳琼,赵信义,古林娟,等.不同成膜材料对氟化物涂膜的释氟特性的影响[J].牙体牙髓牙周病学杂志,2010,20(3):156-159.
[4]Amaechi BT,Higham SM,Edgar WM.Factors affecting the development of carious lesions in bovine teeth in vitro[J].Arch O-ral Biol,1998,43(8):619-628.
[5]Vieira AE,Delbem AC,Sassaki KT,et al.Fluoride dose response in pH-cycling models using bovine enamel[J].Caries Res,2005,39(6):514-520.
[6]Magalhães AC,Comar LP,Rios D,et al.Effect of a 4%titanium tetra?uoride(TiF4)varnish on demineralisation and remineralisation of bovine enamel in vitro[J].J Dent,2008,36(2):158-162.
[7]Bjelkhagen H,Sundstrom F,Angmar-Mansson B,et al.Early detection of enamel caries by the luminescence excited by visible laser light[J].Swed Dent J,1982,6(1):1-7.
[8]Emami Z,Al-Khateeb S,De Josselin de Jong E,et al.Mineral loss in incipient caries lesions quantified with laser fluorescence and longitudinal microradiography[J].Acta Odontol Scand,1996,54(1):8-13.
[9]De Josselin de Jong E,Sundstrom F,Westerling H,et al.A new method for in vivo quantification of changes in initial enamel caries with laser fluorescence[J].Caries Res,1995,29(1):2-7.
[10]李玉晶,仇新全.釉质早期龋损表面的特征[J].中华口腔医学杂志,1990,25(1):35-37.
[11]Schmit JL,Staley RN,Wefel FS,et al.Effect of fluoride varnish on demineralization adjacent to brackets bonded with RMGI cement[J].Am J Orthod Dentofacial Orthop,2002,122(2):125-134.
[12]Anderson AM,Kao E,Gladwin M,et al.The effects of argon laser irradiation on enamel decalcification:an in vivo study[J].Am J Orthod Dentofacial Orthop,2002,122(3):251-259.
[13]Fiset L,Grembowski D,Del Aguila M.Third-party reimbursement and use of fluoride varnish in adults among general dentists in Washington State[J].J Am Dent Assoc,2000,131(7):961-968.
[14]郑俊民.药用高分子材料学[M].北京:中国医药科技出版社,2000:145-149.
[15]Umekar MJ,Yeole PG.Characterization and evaluation of natural copal gum-resin as film forming material[J].Int J Green Pharm,2008,2(1):37-42.
[16]哈成勇,沈敏敏,刘志猛.天然产物化学与应用[M].北京:化学工业出版社,2003:29-30.
