新型盐酸米诺环素缓释凝胶对牙周致病菌的缓释抑菌作用
2012-09-20靳趁心刘俊义梁晓飞王永兰
支 敏,靳趁心,刘俊义,梁晓飞,常 津,王永兰
(天津:1.天津医科大学口腔医院牙周科,300070;2.天津大学材料学院纳米生物技术研究所,300072)
牙周病是以厌氧菌感染为主的慢性感染性疾病,牙周致病菌的破坏作用和宿主对抗病原菌的免疫反应是造成牙周组织破坏和骨吸收的主要原因。临床治疗牙周病的关键是菌斑控制,常规治疗方法有洁、刮治术,但对于牙周组织破坏严重、牙周袋较深且结构复杂的牙周炎以及伴有糖尿病等全身性疾病的患者则需辅以全身和局部用药。牙周袋局部用药能够提高牙周袋内药物浓度,减少用药总量,较全身用药具有更多的优势,特别是近年发展起来的缓控释给药系统,可进一步延长药物作用时间,具有重要的临床意义。
盐酸米诺环素是半合成四环素类抗生素,有较强的杀菌、抑菌活性及调节宿主反应的作用:可抑制胶原酶活性,阻止牙槽骨吸收,有利于破坏的牙周组织获得再附着。将其制成缓释凝胶局部使用可避免全身用药的副作用,同时延长制剂的停留时间,并能以最小的剂量达到最大的疗效,从而减少用药总量。
本实验以羧甲基壳聚糖十八烷基季铵盐(OQCMC)作为乳化剂与PLGA和羟乙基纤维素复合构建一种多功能的缓释微球体系,并选择卡波姆将其制备成凝胶制剂;通过滤纸片扩散法观察其对牙周可疑致病菌(Pg、Fn、Av、Pi)的缓释抑菌作用,为临床应用提供实验室依据。
1 材料和方法
1.1 主要材料和仪器
牙龈卟啉单胞菌(Porphyromanus gingivalis,Pg)ATCC33277、中间普氏菌(Prevotella intermedia,Pi)ATCC25611、粘性放线菌(Actinomyces Viscosus,Av)ATCC19246、具核梭形杆菌(Fusobacterium nucleatum,Fn)ATCC10953(首都医科大学口腔医学研究所);盐酸米诺环素(MINO,华北制药厂);聚乙二醇-羧甲基壳聚糖十八烷基季铵盐(PEG-OQCMC)(天津大学材料学院纳米生物技术研究所提供);CDC厌氧血琼脂培养基、胰蛋白胨大豆肉汤琼脂培养基(天津市金章科技发展有限公司);电子天平(赛多利斯天平仪器厂),超声波细胞粉碎机(上海新芝生物技术研究所)旋转蒸发器(上海振捷实验设备有限公司),厌氧缸及厌氧产气袋(Oxoid公司,英国),细菌电子比浊仪(法国生物梅里埃公司),游标卡尺(广州广精精密仪器有限公司)。
1.2 方法
1.2.1 盐酸米诺环素缓释凝胶和非缓释凝胶的制备
1.2.1.1 盐酸米诺环素缓释凝胶的制备
分别称取适量盐酸米诺环素、乳化剂OQCMC、胆固醇(Chol)和PEG-OQCMC溶于0.5 mL去离子水中,作为内水相;将一定分子量的乳酸-羟基乙酸共聚物(PLGA)溶于1.5 mL二氯甲烷中,作为油相;称取一定量的羟乙基纤维素(HEC)溶于10 mL水中,作为外水相。然后在超声条件下,先将内水相加入到油相中,待形成稳定初乳后,再将外水相加入到初乳液中使之形成复乳,并通过搅拌使溶剂完全挥发,水洗3次,干燥得固化的复合载药缓释微球(整个过程中避光),最后分级离心、洗涤、冻干,低温避光保存备用。
用电子天平分别准确称取一定质量的PEG-OQCMC/OQCMC/Chol复合载药缓释微球和卡波姆(CP)一并置于容器中,加入一定质量的水在磁性搅拌器上边溶解边搅拌,使两者混合均匀并充分溶解后,滴加一定质量的甘油隔夜处理以使CP充分的溶胀,然后再在搅拌的条件下,滴加0.1 mol/L的氢氧化钠液至混合物变为中性,最终得到淡黄色凝胶体,冰箱冷藏备用。
1.2.1.2 盐酸米诺环素非缓释凝胶的制备
用电子天平分别准确称取一定质量的卡波姆和盐酸米诺环素,加入一定质量的水在磁性搅拌器上边溶解边搅拌,使两者混合均匀并充分溶解后,加入一定质量的甘油隔夜处理以使卡波姆充分的溶胀,然后再在搅拌的条件下,滴加0.1 mol/L的氢氧化钠液至混合物变为中性,最终得到淡黄色凝胶体,冰箱冷藏备用。
1.2.2 盐酸米诺环素缓释凝胶和非缓释凝胶的体外释放
用电子天平分别称取一定质量的盐酸米诺环素缓释凝胶和非缓释凝胶,分别放入盛有3 mL PBS(pH=7.9)的透析袋(MW=12 000)中,再将透析袋放入含有12 mL PBS的离心管中一并置于恒温水浴摇床上,在避光条件下以恒定的速度进行释放实验。分别于实验后 1、3、5 h 和 1、3、5、7 d 每个时间点从离心管中各取出2.5 mL PBS用于后述实验。每次取样后均再向离心管中补入相同体积的PBS。
1.2.3 盐酸米诺环素缓释凝胶和非缓释凝胶的缓释抑菌实验
1.2.3.1 药敏纸片的制备
以打孔器将Wattman3号滤纸制成直径6 mm的圆形滤纸片置于玻璃器中,高压灭菌后分别于每个滤纸片上滴加一种不同凝胶不同时间点的PBS缓释液各10 μL(含药量30 μg),待药物均匀分配在滤纸片上,35℃干燥,-20℃冰箱保存备用。
1.2.3.2 细菌复苏
分别取牙龈卟啉单胞菌(Pg)、具核梭杆菌(Fn)、中间普氏菌(Pi)、粘性放线菌(Av)标准菌株用0.2 mL无菌生理盐水溶解后,接种于厌氧环境下预还原的CDC厌氧血琼脂平皿上,放入加有厌氧产气袋的厌氧罐中,37℃,厌氧条件(800 mL/L N2、100 mL/L CO2、100 mL/L H2)下培养 48 h。
1.2.3.3 体外药敏实验
用无菌接种环挑取生长在平板上的各被检菌落,以无菌生理盐水溶解制成菌悬液,并用细菌电子比浊仪调细菌液浓度为0.5麦氏单位(1.5×108/mL)。然后用灭菌棉拭子蘸取各菌液(先在管壁上旋转挤压1~2次,去掉过多的菌液),在CDC厌氧血琼脂平皿表面划动3次,每次划动时平板转动60°使菌悬液均匀涂布,最后沿平皿周边绕两周,保证均匀涂布整个培养皿表面。待平板上的水分被琼脂完全吸收后,将药敏纸片均匀贴在琼脂表面,并做好标记,置于厌氧罐(800 mL/L N2、100 mL/L CO2、100 mL/L H2)中,37 ℃培养。48 h后分别用卡尺测量各含药滤纸片周围圆形无细菌生长区的大小,即抑菌环直径(mm),以肉眼未见细菌明显生长的区域为抑菌环边缘,抑菌环内有很难辨认的少数细小菌落不计在内。实验重复5次,取均值。
1.3 统计学分析
2 结果
2.1 载药微球及缓释凝胶的理化性
本实验所制的载药缓释凝胶为淡黄色凝胶体,其粒径比较均一,大约在100 nm左右,形貌基本为球形;且可看出有明显的核壳结构(图1~2)。

图1 载药缓释凝胶

图2 载药微球的透射电镜照片
2.2 缓释及非缓释凝胶的抑菌作用比较
缓释凝胶组的缓释液对Pg、Fn、Av、Pi的抑菌作用均可持续到7 d,而非缓释组的抑菌作用除对Pi可持续5 d外,对其他3种菌株只能持续3 d(图3~4)。2种凝胶不同时间释放液对各菌株的抑菌直径相比,1 h时非缓释组对各菌株的抑菌直径均大于缓释组,除 Av外,差异均有统计学意义(P<0.05);此后,缓释组各时间点对各菌株的抑菌直径均大于非缓释组,其中Fn在1 h和1、3、5、7 d时,Pg 和Pi在1、3、5、7 d 时,Av在3、5、7 d 时两组的差异均有统计学意义,(P<0.05)(表1)。表明本实验制备的载药缓释凝胶具有较好的缓释抑菌效果。
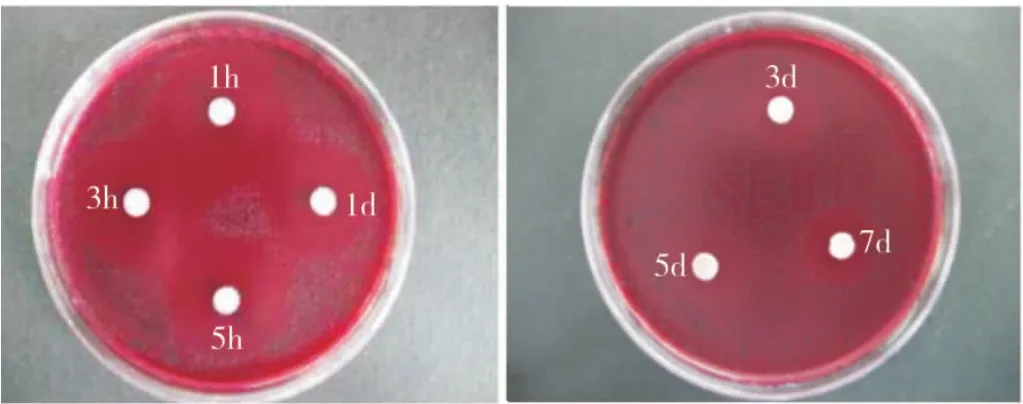
图3 缓释凝胶不同时间释放液对Pi的抑菌环
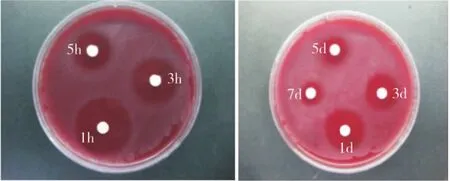
图4 非缓释凝胶不同时间释放液对Pi的抑菌环
表12 种凝胶各时间释放液对各菌株的抑菌直径比较(mms)
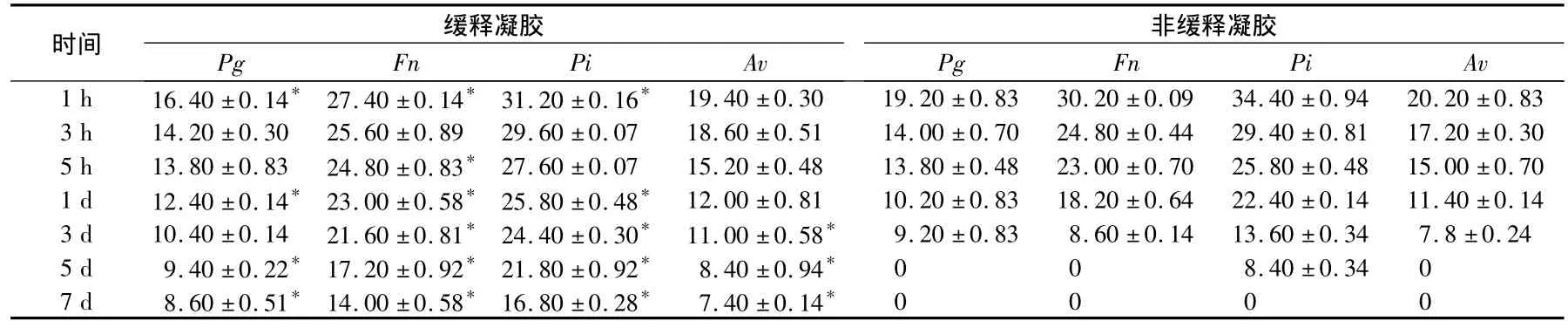
表12 种凝胶各时间释放液对各菌株的抑菌直径比较(mms)
*与非凝胶组相比P<0.05
时间 缓释凝胶非缓释凝胶Pg Fn Pi Av 1 h 16.40 ±0.14* 27.40 ±0.14* 31.20 ±0.16* 19.40 ±0.30 19.20 ±0.83 30.20 ±0.09 34.40 ±0.9 Pg Fn Pi Av 4 20.20 ±0.83 3 h 14.20 ±0.30 25.60 ±0.89 29.60 ±0.07 18.60 ±0.51 14.00 ±0.70 24.80 ±0.44 29.40 ±0.81 17.20 ±0.30 5 h 13.80 ±0.83 24.80 ±0.83* 27.60 ±0.07 15.20 ±0.48 13.80 ±0.48 23.00 ±0.70 25.80 ±0.48 15.00 ±0.70 1 d 12.40 ±0.14* 23.00 ±0.58* 25.80 ±0.48* 12.00 ±0.81 10.20 ±0.83 18.20 ±0.64 22.40 ±0.14 11.40 ±0.14 3 d 10.40 ±0.14 21.60 ±0.81* 24.40 ±0.30* 11.00 ±0.58* 9.20 ±0.83 8.60 ±0.14 13.60 ±0.34 7.8 ±0.24 5 d 9.40 ±0.22* 17.20 ±0.92* 21.80 ±0.92* 8.40 ±0.94* 0 0 8.40 ±0.34 0 7 d 8.60 ±0.51* 14.00 ±0.58* 16.80 ±0.28* 7.40 ±0.14*0000
3 讨论
牙周炎是以厌氧菌感染为主的慢性感染性疾病,但细菌对牙周组织的直接破坏作用是有限的,而由细菌激发的宿主免疫反应才是造成牙周组织破坏的主要原因。研究[1]表明,牙周病并非由单一细菌导致,而至少是多种微生物或整个菌斑生态系共同作用的结果。近年来,随着厌氧培养技术不断改进,对厌氧菌的检出率大大提高[2],大量的研究证实Pg、Fn、Pi、Av等厌氧菌是牙周病的优势病原菌,其中Pg在成人牙周炎的龈下菌斑中检出率最高[3],尤其是成人慢性牙周炎病变或活动部位最主要的优势菌,随着高分子材料学和药剂学的发展,局部应用缓控释制剂在牙周病治疗中显示出较好的优势,成为牙周病药物治疗的主要用药方式。由于其具有给药次数少,减少全身用药的不良反应,局部药物浓度高,持续时间长,胃肠道刺激轻,安全等优点越来越受到临床的重视。从19世纪70年代起各种抗生素药物以冲洗液、含漱液、膜剂、棒剂、凝胶等不同给药方式广泛地应用于牙周炎的治疗,均取得了较好疗效[4]。
药物载体是药物释放体系的重要组成部分,可以直接影响药物的各种释放行为。壳聚糖及其衍生物具有保护或稳定药物中成分、帮助药物送达靶器官、延缓或控制药物释放、促进药物吸收等多种优势,是一种良好的药物控释载体[5-7]。其中,壳聚糖季铵盐因其具有良好的水溶性、絮凝性、生物相溶性、吸湿保湿性和抗菌性以及优良的黏膜渗透性和高的Zeta电位并可作为基因载体而备受研究者的青睐。羧甲基壳聚糖是一种水溶性的壳聚糖衍生物,其分子中含有带负电荷的羧基和带正电荷的氨基,是一种两性聚合物。在羧甲基壳聚糖上引入长链烷基季铵盐制备OQCMC可使水溶性壳聚糖具有更好的亲脂性,从而扩大羧甲基壳聚糖的使用范围。OQCMC有乳化、分散的作用,由于其在水、油介质中的良好溶解性,可使微球体系同时适用于对水溶性药物的包载,可明显地提高微球体系对盐酸米诺环素的载药率[8-10];OQCMC表面带正电,为做基因载体提供了可能,通常不用阳离子表面活性剂时所制备的PLGA微球带负电,而OQCMC可对PLGA微球进行表面修饰以提供官能团,使药物在缓释过程中突释较小,释放时间较长;同时OQCMC可提供多种官能团,使微球可连接叶酸等不同的靶向试剂。本实验通过在PLGA纳米粒表面包裹由壳聚糖季铵盐制备的脂质体层形成复合载药纳米粒,再制备成微球的方法,是目前国外牙周病缓释制剂的主要研究方向。本课题组与天津大学材料学院纳米生物技术研究所合作,首先制备水油两溶性的OQCMC,然后将其作为乳化剂与PLGA和羟乙基纤维素复合构建一种多功能的缓释微球体系。并经体外缓释实验证明该微球体系的突释现象并不明显;由于OQCMC的加入减小了微球体系的粒径,并提高了微球对水溶和油溶性物质的包裹能力;微球表面带正电并富含多种官能团,可连接基因和不同的靶向物质,在药物传递、基因治疗和生物检测方面具有非常好的应用前景。
常用的药物敏感方法有琼脂扩散法、稀释法、电阻抗法以及联合药敏实验和杀菌实验等,其中以琼脂扩散法和稀释法更为常用。琼脂扩散法主要包括纸片扩散法;挖沟扩散法及打孔扩散法等;稀释法包括液体稀释法和琼脂稀释法等。本实验采用琼脂纸片扩散法(K-B法)进行体外抑菌实验,可用于测定药物体外抑制细菌生长的效力,与琼脂稀释法、液体稀释法一并被美国国立临床实验标准化委员会(National Committee for Clinical Laboratory Standards,NCCLS)推荐为三种主要药物敏感实验方法。
本研究采用超声乳化法制备20 g/L盐酸米诺环素缓释凝胶及非缓释凝胶,采用琼脂纸片扩散法分别检测其对牙周主要可疑致病菌 (Pg、Fn、Pi、Av)的抑菌效果,结果显示,盐酸米诺环素缓释凝胶对牙周主要可疑致病菌有较强的抗菌活性,并且其抑菌作用可持续7 d以上,缓释抑菌作用明显优于非缓释凝胶组。说明盐酸米诺环素纳米复合微球凝胶能释放出足够浓度的盐酸米诺环素,达到抑制细菌的作用,不仅可以避免全身给药的不良反应,而且可提高疗效,减少日益严重的细菌耐药性的发生,有一定的临床应用价值,值得进一步的研究开发。
[1]Nishihara T,Koseki T.Microbial etiology of periodontitis[J].Periodontol,2004,36(1):14 -26.
[2]Salari MH,Kadkhoda Z.Rate of cultivable subgingival periodontopathogenic bacteria in chronic periodontitis[J].J Oral Sci,2004,46(3):157 -161.
[3]Estrela CR,Pimenta FC,Alencar AH,et al.Detection of selected bacterial species in intraoral sites of patients with chronic periodontitis using multiplex polymerase chain reaction[J].J Appl Oral Sci,2010,18(4):426 -431.
[4]Trombelli L,Tatakis DN.Periodontal disease:current and future indications for local antimicrobial therapy[J].Oral Disease,2003,9(S1):11 -15.
[5]蒋挺大.壳聚糖[M].2版.北京:化学工业出版社,2006:4-14:347-352.
[6]孙冀平.壳聚糖及其应用[J].中国食品添加剂,2005,(5):83-86.
[7]Issam ST,Adele MG,Adele CP,et al.Chitosan polymer as biative coating and film against aspergillus niger contamination[J].J Food Science,2005,70(2):100 -104.
[8]李世迁,姚评佳,魏远安,等.羧甲基壳聚糖季铵盐的制备及其抑菌性能研究[J].化学与生物工程,2006,23(11):22-24.
[9]Kelly HM,Deasy PB,Ziaka E,et al.Formulation and preliminary in vivo dog studies of a novel drug delivery system for the treatment of periodontitis[J].Int J Pharm,2004,274(1 -2):167-183.
[10]梁晓飞,王汉杰,常津,等.生物降解多功能缓释微球的制备与表征[J].化学学报,2008,66(19):2178 -2183.
