增殖期糖尿病视网膜眼病的动态增强MRI初步研究
2012-09-19许庆刚陈青华鲜军舫王振常
许庆刚,陈青华,鲜军舫,王振常
糖尿病视网膜病变是糖尿病眼病不可逆盲的最严重的并发症。增殖期糖尿病视网膜眼病(proliferative diabetic retinopathy, PDR)主要为视网膜内微循环的异常,血管通透性增加,血管内的液体成分深入组织内,最终可出现血-视网膜屏障(blood-retina barrier, BRB)破坏,导致黄斑水肿。然而,目前评价BRB破坏的金标准荧光素血管造影术(fluoroangiography, FA)法有很多局限性。随着功能MRI技术的发展,动态增强MRI (dynamic contrast enhancement MRI, DCE-MRI)检查逐渐地进入了该研究领域,且已得到了广泛地应用。该法采用小分子对比剂,具有体内不易代谢、不能从玻璃体主动转运至血管、不能与血浆蛋白结合的特性,而且仅仅当细胞间紧密连接破坏后才可跨越BRB,因此可用来准确地监测BRB的变化[1]。同时,DCE-MRI可不受研究介质的影响,具有非创伤性,可对对比剂渗漏处病变进行二维观察,其观察数据与FA具有可比性[2],更重要的是其具有广泛的临床前期及临床应用价值。
迄今为止,有关视网膜DCE-MRI的研究多见于动物实验和临床反馈[1,3-5]。而关于活体视网膜DCEMRI的变化却鲜有报道[6]。基于MRI对动物研究的实验结果,笔者假设:增殖期糖尿病视网膜眼病在DCE-MRI表现为视网膜前玻璃体的信号强度明显升高;DCE-MRI能够评价增殖期糖尿病视网膜病变BRB的破坏,且可以成为诊断该病的有效工具。
1 材料与方法
1.1 研究对象
参照糖尿病眼病国际临床分类标准[7],前瞻性选取2组病例:对照组(C组)和PDR组,所有入选患者均经眼底镜检查(fundus photography, FP)和(或)FA诊断、分期及分级,其中PDR组为糖尿病眼病国际临床分类Ⅴ期患者。
所有受试对象均对检测项目知情同意,本研究经过首都医科大学附属北京同仁医院伦理委员会批准。
病例组受试者排除标准:(1)其他原因所致的眼部疾病或伴有眼部并发症的全身系统疾病;(2)6个月内有眼眶手术史者(包括白内障手术)及12个月内有视网膜散光凝固法照射治疗的患者;(3)背景期糖尿病眼病患者。
15例健康受试者和10例PDR患者自愿参加此次检查。但是,随后因为在检查过程中1例健康受试者和3例PDR患者因眼球运动过多,影响了信号强度的细微变化,其数据不可用、丢弃。因此,14例健康受试者和7名PDR患者最终完成数据采集。其中健康受试者男7例,女7例,年龄31~76岁,平均(50±15)岁,扫描16只眼;PDR患者男3例,女4例,年龄33~72岁,平均(54±14)岁,Ⅱ型糖尿病,病史3~15年,平均(9±4)年,扫描14只眼。
1.2 研究方法
应用GE 1.5 T超导型MR扫描仪(Signa Twinspeed;GE Healthcare, Milwaukee, Wisconsin),采用标准发射-接收眼表面线圈或8通道相控阵头线圈置于受试者眼部中心,受试者仰卧平躺、固定头部。为减少扫描过程中过多的眼球运动,扫描前指导、训练受试者盯着置于正上方的固定点注视,同时使用人工泪液滴眼以减少瞬目。在此扫描期间,图像采集始终对准眼球中心视乳头层面,并确保眼球扫描野范围相对固定不变。
采用三维(3D)快速扰相梯度回波序列进行动态增强扫描,采集解剖和功能数据,参数:TR 8.4 ms,TE 4.0 ms; 反转角15°;FOV 14 cm×14 cm (眼表面线圈)和18 cm×18 cm (头线圈); 层厚3 mm;矩阵256×160;激励次数为1;带宽为22.7 kHz,共采集12个时相,每一个时相扫描时间和间歇时间均为13 s,扫描时间约为5 min,延迟至10~30 min不等。
对比剂使用Gd-DTPA (0.1 mmol/kg, Magnevist;Bayer Schering Pharma, Berlin, Germany),浓度为469 mg/ml。采用高压注射器经上臂静脉注射,注射流率为2.5 ml/s,在第一个时相扫描结束时同时注射。
扫描中心定位于视神经和晶状体,扫描间期可行瞬目休息,然后接着完成扫描。这种不瞬目-瞬目的采集模式可减少受试者的眼部不适,可更好地减少眼球运动所致伪影[8]。
1.3 数据分析
1.3.1 MRI数据
所有受试者的扫描图像用于视网膜BRB破坏情况的分析。首先,为了纠正不同时期同一扫描范围的运动偏差,图像偏移,所有扫描图像均在AFNI软件上进行空间位置校正,随后利用NIH image软件进行数据分析(http://rsb.info.nih.gov/nih-image)。

对于视网膜前玻璃体的每个像素而言,选取注射对比剂后时间-信号强度变化的最大斜率值来间接反映视网膜BRB的破坏情况。最大斜率值的计算公式如下。
最大斜率值=(SIpeak- SIpre)/(SIpre× Tpeak)[9]
SIpre为注射对比剂前的信号强度值,SIpeak为注射对比剂后达到峰值时的信号强度值,Tpeak为SIpeak对应的时间。
1.3.2 ROI的选取
基于Trick等的研究[10],首先,沿视网膜-脉络膜复合体和玻璃体交界处画一曲线,其厚度界定为1个像素大小,并设定为黑色。随后,在这一黑色曲线前视网膜前玻璃体内再画“1个像素厚度的曲线”,该曲线即为计算BRB破坏情况的ROI(图1A)。这种ROI的选择方法尽可能地减少了视网膜-脉络膜复合体对分析结果的干扰,并可确保每个ROI的选择都是大致相同的[10]。
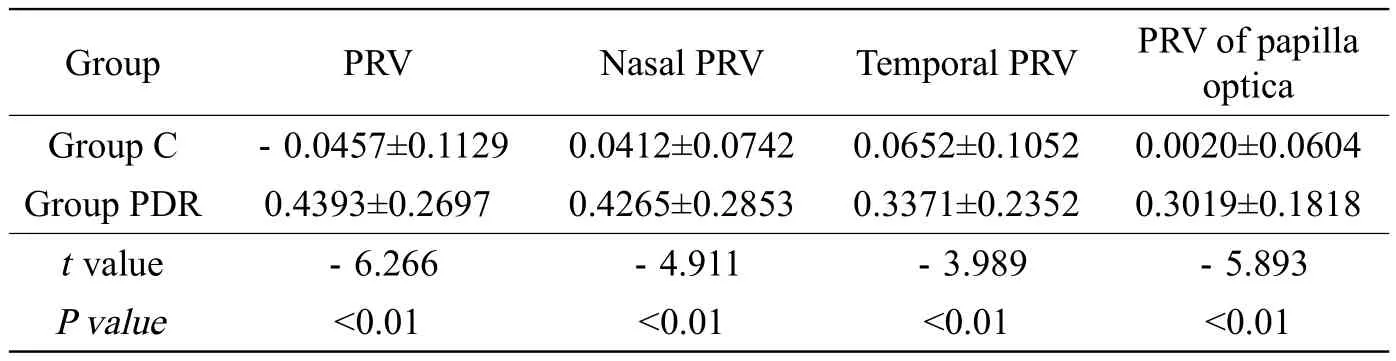
表1 对照组(C组)与增殖期糖尿病眼病(PDR)组不同区域最大斜率值的比较Tab.1 Comparison of slope (max) in different ROI between group C and group PDR
为了便于测量,规定以通过眼球中心视乳头层面晶状体中点与视乳头中心连线为轴,整个视网膜区为2~10点钟方向弧形曲线ROI,鼻侧为2~5点钟方向弧形曲线ROI,颞侧为7~10点钟方向弧形曲线ROI,视乳头区为5~7点钟方向弧形曲线ROI(图1A~D)。
1.3.3 统计分析
采用SPSS 13.0软件包进行统计学分析,最大斜率值以表示。采用两样本t检验比较两组的最大斜率平均值,P<0.05认为差异有统计学意义。
2 结果
在对照组,DCE-MRI可清楚地显示视网膜-脉络膜复合体、睫状体及虹膜等正常组织解剖结构,在玻璃体内未见明显异常。
PDR组受试者BRB破坏区域视网膜前玻璃体内的信号强度升高,表现为斑片状高信号影,且随着时间的延长范围逐渐扩大(表1,图2~4)。
对照组视网膜前玻璃体区在注射对比剂后整个视网膜区、鼻侧、颞侧及视乳头区的时间-信号强度变化的最大斜率的平均值显著高于对照组,差异有统计学意义(P<0.05)。
在延迟扫描相,BRB破坏处可清楚地显示视网膜前区玻璃体腔内高信号的顺磁性对比剂,且随着时间的延长范围逐渐扩大(图3)。而在糖尿病视网膜眼病动态增强曲线图上可见BRB破坏区前方玻璃体内的时间-信号曲线呈持续上升型(图4)。
3 讨论
增殖期糖尿病视网膜眼病所致视网膜内微循环异常,导致微小血管病变区氧分子的弥散受阻,弥散至视网膜前玻璃体的氧分子减少。而视网膜小动脉和小静脉渐进性扩张,视网膜色素上皮和血管内皮之间屏障(BRB)破坏,对比剂渗漏至视网膜前玻璃体间隙内。对于糖尿病性视网膜病而言,BRB破坏,Gd-DTPA不是渗漏到玻璃体腔内,而是进入到玻璃体间隙内,进而影响周围自旋质子的弛豫率,这一作用与Gd-DTPA的浓度成正比。因此,MRI玻璃体内T1WI号强度的改变可作为BRB破坏的标志。
本研究是利用DCE-MRI 监测增殖期糖尿病视网膜眼病视网膜前玻璃体内的信号强度变化来检测视网膜BRB的破坏情况,研究结果揭示了增殖期糖尿病视网膜眼病视网膜前玻璃体信号强度最大斜率值升高,明显高于对照组,反映出进展期糖尿病视网膜病变会出现血管通透性增加,BRB破坏,最终可能会发展成视网膜黄斑水肿及视网膜脱离,与Sander等[11]采用荧光测定法测量的结果一致。视网膜血管通透性增加及黄斑水肿的原因是视网膜色素上皮和血管内皮之间屏障(即BRB)的破坏。水分子跨越BRB主要是两种运动方式,被动转运(双向)和从视网膜到血液方向的主动转运。糖尿病黄斑水肿主要为BRB破坏,被动转运增加;而作为代偿性的主动转运可吸收积液,减轻水肿,但是其作用有限。这些研究结果充分表明DCE-MRI能够评价增殖期糖尿病视网膜BRB的破坏,且可以成为诊断该病的有效工具。另外,本方法成功率高,不受研究介质的影响,具有非创伤性,可对对比剂渗漏处进行二维观察,且MR扫描仪普及广泛,因此,DCE-MRI用来监测视网膜BRB的破坏情况有着非常广阔地应用前景。但是,因为MRI对视网膜的分辨率有限,尚不能明显区分视网膜各层的厚度,因此,笔者认为DCE-MRI目前尚不能取代FA、光学相干断层成像术等传统检查方法,只有这些方法相互补充、取长补短,才能更好地发挥作用。
本研究只是对活体糖尿病视网膜BRB的破坏情况作一些初步的研究,其更广泛地应用尚需进一步研究。Berkowitz等[12]采用DCE-MRI方法分别检测小鼠模型玻璃体内注射人类血清蛋白、血管内皮生长因子(VEGF)和糖尿病模型的表面积透过产物(blood retinal barrier permeability surface area product, BRB PS),研究发现VEGF注射和病程为8个月的糖尿病小鼠模型其BRB PS较对照组明显升高,且差异具有统计学意义。进一步定量分析表明,DCE-MRI 可检测BRB PS>3.9×10-5cm3/min的微小变化。相对于本研究所监测视网膜前玻璃体的渗漏最大斜率值而言,这种病理性变化早于视网膜脱离和临床症状[6,13],因此有望成为活体内监测病变进展的可靠参考指标。
DCE-MRI还可用来评价药物治疗糖尿病视网膜病变的疗效。Berkowitz等[14]利用高分辨锰增强MRI研究发现未治疗组糖尿病小鼠模型其视网膜受体摄取离子低于正常状态,而类脂酸可纠正这种异常。进一步说明MRI可指导临床进行药物干预治疗,并可提供客观、可靠的依据[15-16]。
本研究验证了DCE-MRI能够评价增殖期糖尿病视网膜病变BRB的破坏,且可以成为诊断该病的有效工具。随着这项技术的不断深入完善,有望将会成为研究BRB破坏机制及药物、手术干预治疗的有效评价方法。
[1]Berkowitz BA, Roberts R, Luan H, et al.Dynamic contrast-enhanced MRI measurements of passive permeability through blood retinal barrier in diabetic rats.Invest Ophthalmol Vis Sci, 2004, 45(7): 2391-2398.
[2]Freeman ML, Barnes WE, Eastman G, et al.Radionuclide detection of blood-retinal barrier disruption in diabetes mellitus.Semin Nucl Med, 1984, 14(1): 16-20.
[3]Berkowitz BA, Bissig D, Ye Y, et al.Evidence for diffuse central retinal edema in vivo in diabetic male sprague dawley rats.PLoS One, 2012, 7(1): e29619.
[4]Kern TS, Tang J, Berkowitz BA.Validation of structural and functional lesions of diabetic retinopathy in mice.Mol Vis, 2010, 19(16): 2121-2131.
[5]Manfre L, Midiri M, Giuffre G, et al.Blood-ocular barrier damage: use of contrast-enhanced MRI.Eur Radiol, 1997,7(1): 110-114.
[6]Trick GL, Liggett J, Levy J, et al.Dynamic contrast enhanced MRI in patients with diabetic macular edema:initial results.Eye Res, 2005, 81(1): 97-102.
[7]Wilkinson CP, Ferris FL 3rd, Klein RE, et al.Proposed international clinical diabetic retinopathy and diabetic macular edema disease severity scales.Ophthalmology,2003, 110(9):1677-1682.
[8]Berkowitz BA, McDonald C, Ito Y, et al.Measuring the human retinal oxygenation response to a hyperoxic challenge using MRI: eliminating blinking artifacts and demonstrating proof of concept.Magn Reson Med, 2001,46(2): 412-416.
[9]Yabuuchi H, Fukuya T, Tajima T, et al.Salivary gland tumors: diagnostic value of gadolinium-enhanced dynamic MR imaging with histopathologic correlation.Radiology,2003, 226(2): 345-354.
[10]Trick GL, Edwards P, Desai U, et al.Early supernormal retinal oxygenation response in patients with diabetes.Invest Ophthalmol Vis Sci, 2006, 47(4): 1612-1619.
[11]Sander B, Larsen M, Moldow B, et al.Diabetic macular edema: passive and active transport of fl uorescein through the blood-retina barrier.Invest Ophthalmol Vis Sci, 2001,42(2): 433-438.
[12]Berkowitz BA, Roberts R, Luan H, et al.Dynamic contrast-enhanced MRI measurements of passive permeability through blood retinal barrier in diabetic rats.Invest Ophthalmol Vis Sci, 2004, 45(7): 2391-2398.
[13]Alikacem N, Yosbizawa T, Nelson KD, et al.Quantitative MR imaging study of intravitreal sustained release of VEGF in rabbits.IOVS.2000, 41(6): 1561-1569.
[14]Berkowitz BA, Roberts R, Stemmler A, et al.Impaired apparent ion demand in experimental diabetic retinopathy:correction by lipoic acid.Invest Ophthalmol Vis Sci, 2007,48(10): 4753-4758.
[15]Tofts PS, Porchia A, Jin Y, et al.Toward clinical application of manganese-enhanced MRI of retinal function.Brain Res Bull, 2010, 81(2-3): 333-338.
[16]Berkowitz BA, Bissig D, Patel P, et al.Acute systemic 11-cis-retinal intervention improves abnormal outer retinal ion channel closure in diabetic mice.Mol Vis, 2012, 18:372-376.
