Graves眼病眼外肌受累特点的MR动态增强研究
2012-09-19王振常鲜军舫艾立坤
姜 虹,王振常*,鲜军舫,李 静,艾立坤
Graves眼病(Graves ophthalmopathy, GO)是成人最常见的眼眶病之一[1],且眼外肌最常受累[2-3]。有研究利用超声、CT及MRI通过测定眼外肌体积或横截面积发现眼外肌受累并不均等[4-7]。近年来,MR动态增强成像(dynamic contrast-enhanced MRI, DCEMRI)开始用于评估GO眼外肌受累情况,但多着重于对眼外肌的整体进行研究[8]。笔者通过分析GO患者眼外肌DCE-MRI参数在不同侧别、节段及眼外肌之间的差异,探讨GO眼外肌受累特点,为进一步研究眼外肌发病规律提供依据。
1 材料与方法
1.1 研究对象
自2010年8月至2011年5月在我院就诊的50例GO患者(男25例,女25例,45~55岁,中位年龄51岁)被纳入实验组,病程为4~72个月(平均35个月)。患者入组标准:有甲状腺机能亢进史;符合GO的Mourits诊断标准[9];符合实验室检查(促甲状腺激素抗体、抗微粒蛋白抗体、抗甲状腺球蛋白抗体升高);MRI检查发现眼外肌肥大。排除标准:无甲状腺机能亢进病史;患者接受过免疫抑制治疗。
30例健康志愿者(男15名,女15名,43~58岁,中位年龄52岁)被纳入对照组,所有志愿者均无眼眶疾病病史,且无任何可以引起眼部不适的全身疾病,眼科检查均显示正常。
本研究通过医学伦理委员会批准,研究对象均签署知情同意书。
1.2 MRI扫描
MRI扫描采用3.0 T扫描仪(Signa HDx; General Electric Healthcare, Milwaukee, WI, USA)及8通道头线圈。患者仰卧位,头部用海绵垫固定。在整个扫描过程中,嘱被检者不动且闭双目,以减少扫描过程中运动伪影的产生。
1.2.1 T2WI
冠状面脂肪抑制FSE T2WI参数:TR 3480 ms,TE 118.3 ms,矩阵512×256,激励次数(NEX) 2,FOV 20 cm×15 cm,层厚 3.0 mm,层间距 0.3 mm。扫描范围包括双侧眼眶,自晶状体后缘至眶尖区共16层图像。
1.2.2 DCE-MRI
冠状面DCE-MRI采用脂肪抑制三维快速扰相梯度回波(3D-FSPGR)序列,扫描参数:TR 8.4 ms,TE 4.0 ms,矩阵256×224,NEX 1,FOV 18 cm×16 cm,层厚3.0 mm,层间距0.3 mm。扫描范围包括双侧眼眶,自晶状体后缘至眶尖区共16层图像。一次采集时间为15~17 s,间隔9~11 s,12个时相共采集约5 min。对比剂使用Gd-DTPA,剂量为0.1 mmol/kg,采用高压注射器经头静脉注射,注射流率2.5 ml/s,在第二个时相扫描开始时同时注射,随后以相同的流率注入20 ml生理盐水。
1.3 图像分析

将所有图像传至AW442 (General Electric Healthcare, Milwaukee, WI, USA)后处理工作站进行分析。
1.3.1 眼外肌横截面积测定
自眼球-视神经交界层面至眶尖区连续测量双侧上直肌、下直肌、内直肌、外直肌及上斜肌的横截面积,定义最大横截面积层面为Smax,前一个层面为Spre,后一个层面为Spost。
1.3.2 眼外肌DCE-MRI参数测定
分别在DCE-MRI图像的Spre、Smax和Spost三个节段评估眼外肌的强化特点。利用Functool软件将感兴趣区(region of interest, ROI)置于5条眼外肌的肌腹,ROI面积尽量大并避免将眶内脂肪置于其内(图1)。选定ROI后自动生成时间-信号强度曲线(图2)。由于上直肌与提上睑肌不易区分,故本文研究的上直肌指的是上直肌与提上睑肌的复合体。
由时间-信号强度曲线可以测得SIpre,SImax,SIpeak和SI 5 min[10]。SIpre为平扫时的信号强度。SImax为注入对比剂后的最大信号强度。SIpeak为第一个满足不等式的信号强度 SI>[0.9(SImax-SIpre)]+SIpre。SI 5 min为在扫描第5分钟时的信号强度。由此,计算以下3个参数:达峰时间(time to peak enhancement,Tpeak)定义为SIpeak所对应的时间;强化率(enhancement ration, ER)定义为(SImax-SIpre)/SIpre×100 (%);流出率(washout ratio, WR)定义为[(SImax-SI 5 min)/(SImax-SIpre)]×100 (%)。动态增强参数见图2。
图像均经2名有经验的放射科医师盲法分析。眼外肌横截面积及DCE-MRI参数取两者的均值。
1.4 .统计学分析
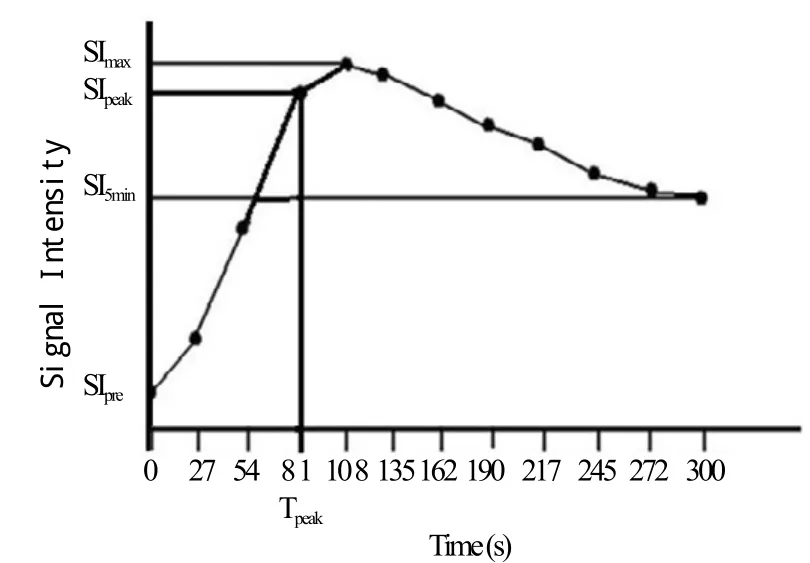
图2 时间-信号强度曲线图及各参数Fig.2 The time-intensity curve and the parameters.

表1 正常对照组及GO组临床资料Tab.1 Clinical data of subjects in normal and GO groups
采用SPSS13.0软件包。计算横截面、Tpeak、ER及WR的均值、标准差。以Tpeak、ER、WR值为因变量,侧别、节段、眼外肌为自变量,进行多元线性回归分析,多分类变量(节段、眼外肌)引入哑变量。与对照组的比较采用两独立样本t检验。运用Spearman秩相关分析比较GO眼外肌横截面积与Tpeak、ER及WR的相关性。P<0.05为差异有统计学意义。
2 结果
2.1 研究对象临床资料
年龄及性别在对照组、GO组之间差异无统计学意义(t=0.56, χ2=2.87, P>0.05;表1)。
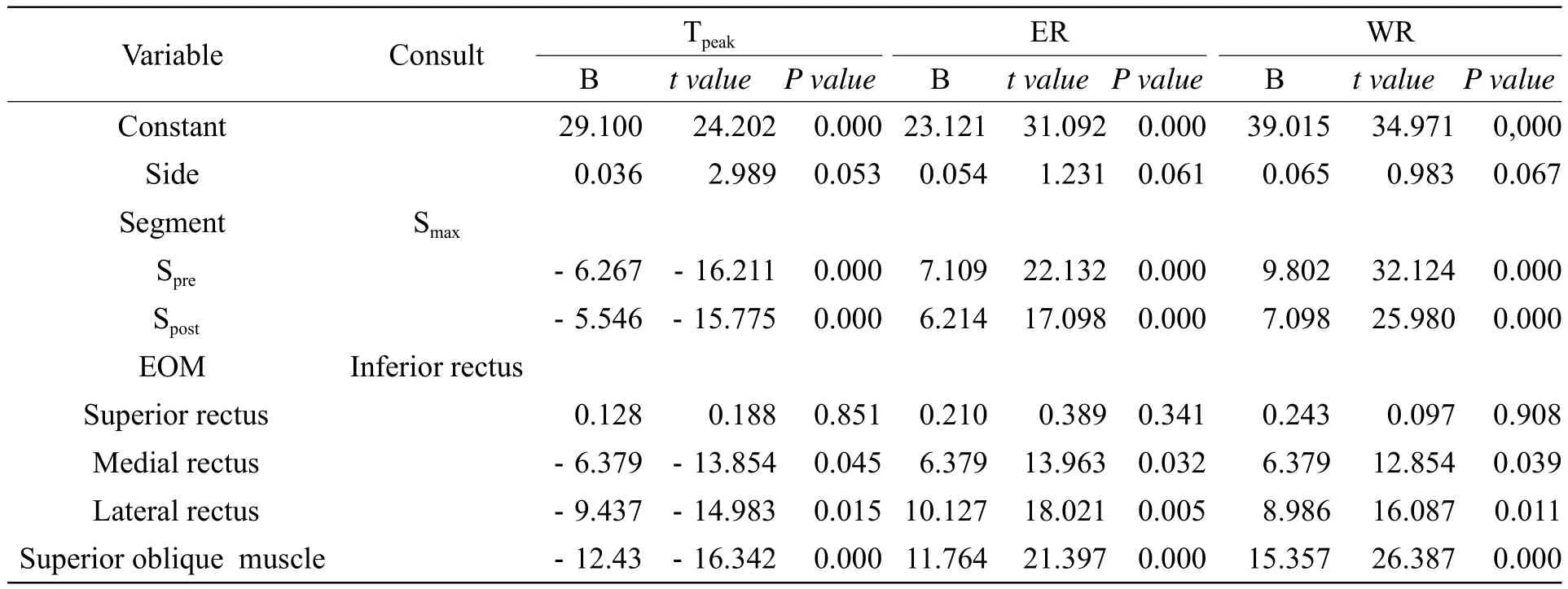
表2 眼外肌Tpeak值、ER值、WR值与侧别、节段、眼外肌的多元线性回归分析结果Tab.2 Results of multiple linear regression in EOMS Tpeak, ER, WR
2.2 GO眼外肌Tpeak、ER、WR值与侧别、节段、眼外肌的多元线性回归分析结果
结果见表2。眼外肌Tpeak、ER、WR值与侧别无关(P>0.05),故取均值行进一步比较。Smax节段的Tpeak值显著高于Spre、Spost节段(P<0.05),ER、WR值显著低于Spre、Spost节段(P<0.05)。上直肌与下直肌的Tpeak、ER、WR值差异无统计学意义(P>0.05),内直肌、外直肌、上斜肌的Tpeak值显著低于下直肌(P<0.05),ER、WR值显著高于下直肌(P<0.05)。
2.3 GO眼外肌各节段Tpeak、ER及WR值与对照组比较结果
结果见表3~5。对照组Tpeak、ER、WR值左、右侧之间差异无统计学意义(P>0.05),故取均值行进一步比较。与对照组相比,5条眼外肌各节段的Tpeak值显著增加(P<0.05),ER、WR值显著降低(P<0.05)。

表3 Smax节段GO眼外肌Tpeak (s)、ER 、WR (%)与对照组比较结果Tab.3 Comparison of Tpeak (s), ER, and WR (%) in Smax between normal and GO group

表4 Spre节段GO眼外肌Tpeak (s)、ER 、WR (%)与对照组比较结果Tab.4 Comparison of Tpeak (s), ER, and WR (%) in Spre between normal and GO group

表5 Spost节段GO眼外肌Tpeak (秒)、ER 、WR (%)与对照组比较结果Tab.5 Comparison of Tpeak (s), ER, and WR (%) in Spost between normal and GO group
2.4 GO眼外肌横截面积与Tpeak、ER及WR的相关性分析结果
结果见表6。Tpeak与眼外肌横截面积呈显著线性正相关(P<0.01),ER、WR与横截面积呈显著线性负相关(P<0.01)。

表6 眼外肌横截面积与Tpeak、ER及WR的相关性分析Tab.6 Correlation analysis between EOM area and Tpeak, ER, and WR
3 讨论
本研究结果提示DCE-MRI能够早期评估眼外肌的受累情况,且GO患者下直肌及上直肌的最大横截面积节段受累最严重。了解GO眼外肌受累特点有助于深入研究GO发病规律。以往的研究多是通过形态学测量研究眼外肌受累特点[4-5],很少有研究通过分析眼外肌微循环变化探讨其发病情况。
DCE-MRI是较为成熟的一种MRI检查方法,它是通过静脉内团注对比剂后动态观察组织的强化方式和程度,以反映组织的灌注情况、细胞外间隙体积及血管通透性等[11-12]。DCE-MRI在全身各系统均有广泛的应用,对于良、恶性肿瘤的诊断及鉴别诊断有一定的价值[13-14]。在眼外肌研究方面,2000年,Taoka等[15]首次利用DCE-MRI研究正常人眼外肌的强化特点。2005年,Taoka等[8]用此方法评价GO慢性期患者眼外肌微循环受损及间质纤维化的情况。2012年,Jiang等[16]用此方法评价了活动期及非活动期GO患者眼外肌的微循环状态。但以上研究均是对眼外肌整体进行的研究,并没有关注侧别、节段及眼外肌对GO发病的影响。
本研究结果示GO患者眼外肌Tpeak值显著高于对照组,ER、WR值显著低于对照组,与以前研究GO眼外肌微循环受损的结果相似[8,16-17]。Tpeak与微血管数密切相关,且微血管数反映组织血供[10]。GO患者眼外肌Tpeak延长的原因可能为眼外肌脂肪浸润、大量水肿及纤维化造成眶内压增大,眼外肌的灌注降低导致血供减少[8,18]。ER与微血管数不相关[10],但在本研究中发现GO患者眼外肌的ER值降低,推测其可能的原因为以上所述病理变化造成组织灌注压降低,而不是像肿瘤研究中一样为微血管数的减少[18-19]。WR反映细胞-间质比,当细胞外间隙内含大量纤维间质时会使对比剂存留一段时间,因此,细胞-间质比降低会导致WR降低[10,18]。本研究中,WR降低可能是由于眼外肌纤维化、细胞浸润、结缔组织增生或水肿导致间质增多,细胞外间隙体积缩小造成的。
本研究结果显示GO患者眼外肌Tpeak与横截面积呈显著正相关,ER、WR与横截面积呈显著负相关,提示眼外肌横截面积越大,微循环受损越严重。有研究证实GO眼外肌肥大是由肌纤维内炎性细胞浸润及黏多糖沉积造成的[14,20-21],故眼外肌横截面积越大,表明炎性渗出越显著,微循环受损越严重,与上述病理变化一致。
本研究结果示GO眼外肌Tpeak、ER、WR值侧别间差异无统计学意义,与以前评估眼外肌横截面积侧别间差异的研究结果相似[5,22]。此外,本研究结果显示GO患者下直肌、上直肌微循环受损最严重,其次为内直肌、外直肌、上斜肌,与以前研究GO眼外肌肥大的结果相似[5]。推测可能的原因为下直肌、上直肌肥大最显著[20],造成微循环受损较其他眼肌严重。本研究将上直肌与提上睑肌一并研究,故上直肌复合体肥大显著,导致微循环受损显著。很少有研究比较眼外肌不同节段之间受累的差异,本研究结果显示眼外肌横截面积最大节段微循环受损最严重,推测可能的原因为横截面积最大节段的眼外肌由于炎性细胞浸润、黏多糖沉积最严重。笔者发现眼外肌Spre、Smax、Spost节段横截面积无差异,而Tpeak、ER、WR值在不同节段间的差异有统计学意义,提示眼外肌微循环受损早于形态学改变,且DCE-MRI能够早期评估眼外肌微循环受损情况。
总之,DCE-MRI能够早期评估GO眼外肌受累情况。GO眼外肌受累与侧别无关,且不同节段、眼外肌之间受累亦不均等,为深入研究GO眼外肌发病规律提供了客观依据。
[1]Weber AL, Dallow RL, Sabates NR.Graves' disease of the orbit.Neuroimaging Clin N Am, 1996, 6(1): 61-72.
[2]Bahn RS.Pathophysiology of Graves’ ophthalmopathy:the cycle of disease.J Clin Endocrinol Metab, 2003, 88(5):1939-1946.
[3]Liu C.The diagnosis and treatment of Graves ophthalmopathy.Clin Med J (China), 2004, 21(6): 363-367.刘超.Graves眼病的诊断和治疗.临床内科杂志, 2004,21(6): 363-367.
[4]Kahaly GJ.Imaging in thyroid-associated orbitopathy.Eur J Endocrinol, 2001, 145(2): 107-118.
[5]Lennerstrand G, Tian S, Isberg B, et al.Magnetic resonance imaging and ultrasound measurements of extraocular muscles in thyroid-associated orbitopathy at different stages of the disease.Acta Ophthalmol Scand,2007, 85(2): 192-201.
[6]Souza AD, Ruiz EE, Cruz AA.Extraocular muscle quantification using mathematical morphology: a semiautomatic method for analyzing muscle enlargement in orbital diseases.Comput Med Imaging Graph, 2007, 31(1):39-45.
[7]Fledelius HC, Zimmermann-Belsing T, Feld-Rasmussen U.Ultrasonically measured horizontal eye muscle thickness in thyroid-associated orbitopathy: cross-sectional and longitudinal aspects in a Danish series.Acta Ophthalmol Scan, 2003, 81(2): 143-150.
[8]Taoka T, Sakamoto M, Nakagawa H, et al.Evaluation of extraocular muscles using dynamic contrast enhanced MRI in patients with chronic thyroid orbitopathy.J Comput Assist Tomogr, 2005, 29(1): 115-120.
[9]Mourits MP, Koornneef L, Wiersinga WM, et al.Clinical criteria for the assessment of disease activity in Graves'ophthalmopathy: a novel approach.Br J Ophthalmol, 1989,73(8): 639-644.
[10]Yabuuchi H, Fukuya T, Tajima T, et al.Salivary gland tumors: diagnostic value of gadolinium-enhanced dynamic MR imaging with histopathologic correlation.Radiology,2003, 226(2): 345-354.
[11]Oostendorp M, Post MJ, Backes WH.Vessel growth and functin: depiction with chontrast-enhanced MR imaging.Radiology, 2009, 251(2): 317-333.
[12]Choyke PL, Dwyer AJ, Knopp MV.Functional tumor imaging with dynamic contrast-enhanced magnetic resonance imaging.J Magn Reson Imaging, 2003, 17(5):509-520.
[13]Shih TT, Hou HA, Liu CY, et al.Bone marrow angiogenesis magnetic resonance imaging in patients with acute myeloid leukemia: peak enhancement ratio is an independent predictor for overall survival.Blood, 2009, 113(14):3161-3167.
[14]Chawia S, Kim S, Loevner LA, et al.Prediction of diseasefree survival in patients with squamous cell carcinoma of the head and neck using dynamic contrast-enhanced MR imaging.Am J Neuroradiol, 2011, 32(4): 778-784.
[15]Taoka T, Iwasaki S, Uchida H, et al.Enhancement pattern of normal extraocular muscles in dynamic contrastenhanced MR imaging with fat suppression.Acta Radiol,2000, 41(3): 211-216.
[16]Jiang H, Wang Z, Xian J, et al.Evaluation of rectus extraocular muscles using dynamic contrast-enhanced MR imaging in patients with Graves’ ophthalmopathy for assessment of disease activity.Acta Radiol, 2012, 53(1):87-94.
[17]Cakirer S, Cakirer D, Basak M, et al.Evaluation of extraocular muscles in the edematous phase of Graves ophthalmopathy on contrast-enhanced fat-suppressed magnetic resonance imaging.J Comput Assist Tomogr,2004, 28(1): 80-86.
[18]Liao ZQ, Xia RN, Fang QX.Histology research of Graves ophthalmopathy.Ophthalmopathy Research, 1994, 12(1):258-261.廖志强, 夏瑞南, 方谦逊.眼型Graves病眼外肌的组织病理学研究.眼科研究, 1994, 12(1): 258-261.
[19]Hatton MP, Rubin PA.The pathophysiology of thyroidassociated ophthalmopathy.Ophthalmol Clin North Am,2002, 15(1): 113-119.
[20]Aydin K, Gijven K, Sencer S, et al.A new MRI method for the quantitative evaluation of extraocular muscle size in thyroid ophthalmopathy.Neuroradiol, 2003, 45(3): 184-187.
[21]Char DH.Thyroid eye disease.2nd ed.New York:Churchill Livingstone, 1990: 223-230.
[22]Villadolid MC, Yokoyama N, Izumi M, et al.Untreated Graves’ disease patients without clinical ophthalmopathy demonstrate a high frequency of extraocular muscle (EOM)enlargement by magnetic resonance.J Clin Endocrinol Metab, 1995, 80(9): 2830-2833.
