刺参机体酵母菌组成及其拮抗活性的研究
2012-09-19李明马悦欣刘志明杨志平包鹏云宋坚
李明,马悦欣,刘志明,杨志平,包鹏云,宋坚
(1.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023;2.大连汇新钛设备开发有限公司,辽宁大连116000)
刺参Apostichopus japonicus是中国北方地区重要的海珍品之一,具有较高的营养价值、经济价值和药用价值,目前已形成较大的产业规模。随着养殖密度的增加以及海水污染程度的日益严重,各种疾病也随之而来,病害已成为限制刺参养殖业发展的重要因素。刺参的病害主要是由细菌引起的,如刺参育苗期的烂边病、烂胃病、化板症,稚参培育阶段的细菌性溃烂病,幼体培育及养成阶段的皮肤溃烂病和急性口围肿胀症等,已报道的刺参病原生物主要有弧菌属的细菌,还有假单胞菌属、假交替单胞菌属和希瓦氏菌属的细菌[1-4]。目前,对于刺参疾病,传统的防治方法是使用抗生素,这容易使细菌产生抗药性[5],不仅干扰水生动物肠道正常微生物区系[6],还可能造成水产品中药物残留,并对人类健康产生不利的影响。已有研究表明,从健康动物体内分离病原菌的拮抗菌是筛选益生菌的有效途径[7-8]。不同种类的酵母菌存在于不同水生动物的肠道、体表等部位[9-11]。本研究中,作者在对刺参机体酵母菌种群组成研究的基础上,以刺参病原菌为指示菌对酵母菌的拮抗活性进行测定,旨在为进一步筛选防治刺参病害的益生菌提供参考。
1 材料与方法
1.1 材料
刺参样品于2010年5月和2010年11月分别采自大连柏岚子和黑石礁自然海域。
1.2 方法
1.2.1 酵母菌的分离 将从海底取回的新鲜刺参用无菌海水冲洗后,取一定面积的表皮,以无菌解剖法取出其肠道和呼吸树,将肠道内的内容物去除,分别在低温下将各组织匀浆,与适量的无菌海水充分混匀,稀释,取适宜的稀释液0.1 mL涂布于PDA、YPD和MEA培养基上,于20℃下恒温培养3~5 d,选取形态不同的菌落,经划线纯化后进行鉴定。
1.2.2 酵母菌的鉴定 酵母菌DNA的提取参照文献[12]中的方法,用引物NL-1/NL-4[13]对提取的DNA进行PCR扩增。反应体系共50 μL,包含10×PCR Buffer 3 μL,dNTPs 2 μL,MgCl2(25 mmol/L)3 μL,上、下游引物 (10 mmol/L)各 1 μL,Taq酶 (5 U)0.25 μL,DNA 模 板 2 μL,ddH2O 37.75 μL。反应程序为:94℃下预变性2 min;94℃下变性30 s,55℃下退火30 s,72℃下延伸1 min,共进行35个循环;72℃下再延伸5 min。用10 g/L琼脂糖凝胶电泳检测PCR产物,将PCR产物送生工生物工程 (上海)有限公司进行测序。将各菌株序列在GenBank数据库中进行检索,从Blast比对结果中取相似性最高的序列,用Mega 4.0进行统计和聚类分析[14]。采用邻接法获得分子系统树,并通过自举分析 (boostrap)进行置信度检测,自举数据集为1 000次。
1.2.3 酵母菌拮抗活性的测定 采用双层琼脂扩散法,将活化后的酵母菌菌株接种于PDA平板上培养2 d,然后覆盖含有指示菌菌悬液 (培养过夜)的2216E半固体培养基,20℃下培养24 h后测定其抑菌圈直径(Di)和菌落直径(Dc),通过两者的比值(Di/Dc)确定其拮抗活性。指示菌为刺参溃烂病和急性口围肿胀症的病原菌,编号分别为BP12(Pseudomonas sp.)、HSX31(Vibrio sp.)、HSX32(Vibrio sp.)[1]、AP629(Shewanella marisflavi)[4]、NB13(Vibrio splendidus)、NB14(Vibrio sp.)、KW21(Marinomonas dokdonensis)和KW22(Vibrio splendidus)[2]。
1.2.4 拮抗物质的性质研究 取从肠道分离的C11、C14和C21菌株的发酵上清液,加入不同饱和度的硫酸铵进行沉淀,将沉淀溶解后用透析袋透析,将粗提物以灿烂弧菌NB13为指示菌,采用纸片法测定其抑菌活性。
将粗提物在70、80、90℃下处理1 h,分别取20 μL处理液进行抑菌活性的测定,以未作处理的粗提液的抑菌圈直径作为对照,其抑菌活性设为100%。
在粗提液中分别加入蛋白酶K至终浓度为200 μg/mL,然后在37℃下处理1 h。分别取20 μL处理液进行抑菌活性的测定,以未作处理的粗提液的抑菌圈直径作为对照,其抑菌活性设为100%。
所有处理均设3个重复。
2 结果
2.1 刺参机体酵母菌的组成
从大连柏岚子海域不同刺参的体表、肠道和呼吸树共分离出13株酵母菌,分别记为T11~T13,C11~C15,H11~H15;从大连市黑石礁海域不同刺参的肠道和呼吸树共分离出10株酵母菌,分别记为C21~C22,H21~H28。依据菌株的26S rDNA序列同源性及系统发育分析,将其鉴定为红酵母属Rhodotorula spp.、梅奇酵母属 Metschnikowia sp.、丝孢酵母属Trichosporon spp.、德巴利酵母属Debaryomyces spp.、假丝酵母属Candida spp.、有孢汉逊酵母属Hanseniaspora sp.和毕赤酵母属Pichia sp.(表1),各菌株DNA序列的系统发育树见图1。

表1 刺参机体酵母菌菌株26S rDNA序列的Blast结果Tab.1 The Blast analysis of the 26S rDNA sequences in yeaste strains
2.2 酵母菌的抗菌活性
23株酵母菌中17株具有抗菌活性,拮抗率达到73.9%,其拮抗活性见表2。从表2可见:从体表分离出的3株菌中只有1株有拮抗活性,拮抗率为33.3%,从呼吸树中分离出的13株中有9株有拮抗活性,拮抗率为69.2%,而从肠道分离出的7株酵母菌均具有拮抗活性,拮抗率达100%;C11菌株对7株指示菌有拮抗活性,C12、H12、C21和H23菌株对4株指示菌有拮抗活性;C11菌株 (红酵母属)的拮抗活性最强,对5株指示菌的拮抗活性 (Di/Dc)均在2以上,该菌株对指示菌NB13菌株的抑制作用见图2,H23菌株 (假丝酵母属)和C21(有孢汉逊酵母属)菌株的拮抗活性次之。

图1 刺参机体酵母菌菌株26S rDNA序列的系统发育树Fig.1 Phylogenetic tree of the yeast strains based on partial sequences of 26S rDNA sequences by Neighbor-joining method
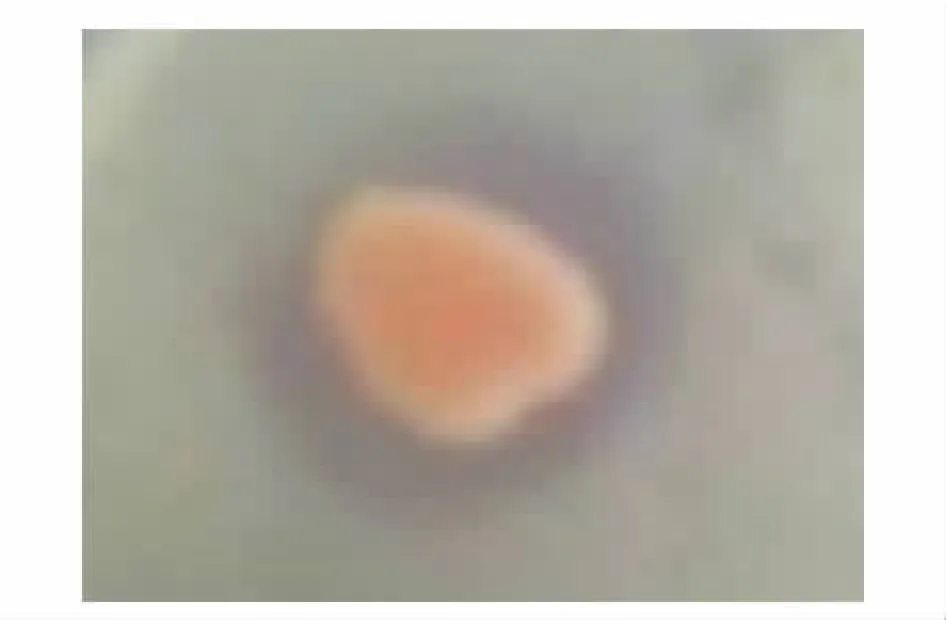
图2 C11菌株对指示菌NB13菌株的抑制作用Fig.2 Inhibition of strain C11 to indicator the yeast strain NB13
2.3 拮抗物质的性质
拮抗菌C11和C21菌株胞外产物经35%~65%硫酸铵沉淀,C14菌株胞外产物经45%~75%硫酸铵沉淀后,获得的粗提物均对指示菌NB13菌株有拮抗活性(图3)。将C14菌株粗提物在70℃下水浴1 h,其抑菌活性仅保留25%,在80℃和90℃下水浴1 h,其失去拮抗活性。该粗提物经蛋白酶K处理后失去对NB13菌株的拮抗活性,说明该粗提物对酶比较敏感,由此可证实C14菌株的拮抗物质为蛋白质。

图3 C14菌株胞外产物经65%硫酸铵沉淀获得的粗提物对NB13菌株的抑制作用Fig.3 Antibacterial activity of the extracellular product precipitated with 65%ammonium sulfate in the yeast strain C14
3 讨论
目前对刺参酵母菌区系的研究报道很少,孙奕等[9]从灵山岛、威海以及青岛沿岸海区刺参的消化管和表皮上分离得到的酵母菌属于球拟酵母属Torulopsis、红酵母属 Rhodotorula、隐球酵母属Cryptococcus和德巴利酵母属Debaryomyces。本试验中从大连柏岚子海域刺参机体中分离到红酵母属、梅奇酵母属和丝孢酵母属的酵母菌;从黑石礁海域刺参机体中分离到红酵母属、德巴利氏酵母属、假丝酵母属、有孢汉逊酵母属和毕赤酵母属的酵母菌。

表2 酵母菌菌株对刺参病原菌的抗菌活性Tab.2 Antibacterial activities of yeasts to pathogens in sea cucumber Apostichopus japonicus
假丝酵母Candida spp.和红酵母Rhodotorula spp.可从巴西东南部红树林生态系统中的食碎屑蟹(Sesarma rectum和Uca spp.)、杂食性蟹(Aratus pisonii和Goniopsis cruentata)、船蛆(Neoteredo reynei)、蛤(Anomalocardia brasiliana和 Tagelus plebeius)中分离到[15]。假丝酵母 Candida spp.、丝孢酵母Trichosporon sp.、德巴利酵母Debaryomyces sp.和红酵母Rhodotorula spp.是凡纳滨对虾Penaeus schmitti肠道的优势酵母菌属[16];红酵母常常可从海水鱼的肠道分离出[11,17],汉逊德巴利酵母、红酵母和假丝酵母是虹鳟肠道中的优势种类[11,17]。池振明等[10]从天津大港区半滑舌鳎肠道和体表中以及山东荣成石岛带鱼消化道中分离到汉逊德巴利酵母;从山东荣成石岛马面鲀消化道和鳃中以及鲅鱼肠道和体表中分离出克鲁弗毕赤酵母Pichia kluyveri;从山东荣成石岛的鲅鱼体表和肠道中分离出假丝酵母。因此,不同海水动物、不同海域同一动物体中的酵母菌组成有一定的差异,可能与其食物来源和组成及环境条件不同有关。
Wang等[18]以梭子蟹“乳化病”的病原菌梅奇酵母Metchnikowia bicuspidata WCY作为指示菌,对从海水、海泥、海水鱼肠道中和海藻中分离的多株酵母菌进行拮抗活性的测定,结果发现其中5株嗜杀活性较高,并将其鉴定为土星拟威尔酵母Williopsis saturnus(WC91-2)、季也蒙毕赤酵母Pichia guilliermondii(GZ1)、异常毕赤酵母 P.anomala(YF07b)、汉逊德巴利酵母D.hansenii(HCX-1)和出芽短梗霉 Aureobasidium pullulans(HN2.3)。Andlid等[17]从虹鳟胃肠道分离的汉逊德巴利酵母(HF1)体外可抑制鱼病原菌杀鲑气单胞菌Aeromonas salmonicida和鳗弧菌Vibrio angiullarum。
从表2可见,本试验中分离出的C11菌株、H23菌株和C21菌株对指示菌都有较好的抑制作用。从刺参肠道分离的拮抗菌C11、C21和C14菌株胞外产物经硫酸铵沉淀后获得的粗提物均对指示菌NB13菌株有拮抗活性;C14菌株的粗提物经80℃和蛋白酶处理后失去拮抗活性,说明该菌株产生的胞外蛋白可抑制刺参病原菌的生长。薛德林等[19]研究表明,当海洋胶红酵母 (质量浓度为1×1010cfu/mL)日投量为10 mL/m3(水体)时,刺参幼体烂胃病的发病率显著低于对照组;在刺参成参养殖中,应用海洋胶红酵母和光合细菌能够提高刺参产量14.3%~16.4%,并可以有效地减少由弧菌引起的海参周身腐烂等病害。本实验室后续的攻毒试验表明,拮抗活性较高的菌株对刺参无致病性,有关这些菌株在刺参养殖过程中的应用效果正在研究中。
[1]马悦欣,徐高蓉,常亚青,等.大连地区刺参幼参溃烂病细菌性病原的初步研究[J].大连水产学院学报,2006,21(1):13-17.
[2]马悦欣,徐高蓉,张恩鹏,等.仿刺参幼参急性口围肿胀症的细菌性病原[J].水产学报,2006,30(3):378-382.
[3]王印庚,荣小军,张春云,等.养殖海参主要疾病及防治技术[J].海洋科学,2005,29(3):1-7.
[4]Li H,Qian G,Li Q,et al.Biological characteristics and pathogenicity of a highly pathogenic Shewanella marisflavi infected sea cucumber(Apostichopus japonicus)[J].Journal of Fish Diseases,2010,33:865-877.
[5]Sahul Hameed A S,Rahaman K H,Alagan A,et al.Antibiotic resistance in bacteria isolated from hatchery-reared larvae and postlarvae of Macrobrachium rosenbergii[J].Aquaculture,2003,217:39-48.
[6]Verschuere L,Rombaut G,Sorgeloos P,et al.Probiotic bacteria as biological control agents in aquaculture[J].Microbiology and Molecular Biology Review,2000,64(4):655-671.
[7]周慧慧,马洪明,张文兵,等.仿刺参肠道潜在益生菌对稚参生长、免疫及抗病力的影响[J].水产学报,2010,34(6):775-783.
[8]张玲,谭北平,麦康森,等.中国对虾体内1株益生菌的筛选与初步鉴定[J].中国海洋大学学报,2008,38(2):225-231.
[9]孙奕,陈騳.刺参体内外微生物组成及其生理特性的研究[J].海洋与湖沼,1999,20(4):300-307.
[10]池振明,居靓,王祥红,等.在海洋环境中的酵母菌分布与多样性[J].中国海洋大学学报,2009,39(5):955-960.
[11]Gatesoupe F J.Live yeasts in the gut:natural occurrence,dietary introduction,and their effects on fish health and development[J].Aquaculture,2007,267:20-30.
[12]萨姆布鲁克J,拉塞尔D W.分子克隆实验指南[M].黄培堂,译.北京:科学出版社,2002:485-487.
[13]O'Donnell K.Fusarium and its near relatives[C]//Reynolds D R,Taylor J W.The Fungal Holomorph:Mitotic,Meiotic and Pleomorphic Speciation in Fungal Systematics.Wallingford:CAB International,1993:225-233.
[14]Tamura K,Dudley J,Nei M,et al.Mega 4:Molecular evolutionary genetics analysis(Mega)software version 4.0[J].Molecular Biology and Evolution,2007,24(8):1596-1599.
[15]De Araujo F V,Soares C A,Hagler A N,et al.Ascomycetous yeast communities of marine invertebrates in a southeast Brazilian mangrove ecosystem[J].Antonie van Leeuwenhoek,1995,68(2):91-99.
[16]Pagnocca F G,Mendonca-Hagler L C,Hagler A N.Yeasts associated with the white shrimp Penaeus schmitti,sediment,and water of Sepetiba Bay,Rio de Janeiro,Brasil[J].Yeast,1989,5:S479-S483.
[17]Andlid T,Juarez R V,Gustafsson L.Yeast colonizing the intestine of rainbow trout(Salmo gairdneri)and turbot(Scophthalmus maximus)[J].Microbial Ecology,1995,30:321-347.
[18]Wang L,Yue L X,Chi Z M,et al.Marine killer yeast active against a yeast strain pathogenic to crab Portunus trituberculatus[J].Diseases of Aquatic Organisms,2008,80(3):211-218.
[19]薛德林,胡江春,王国安,等.海洋胶红酵母、光合细菌、生化黄腐酸在海参育苗和养成中的应用效果[J].腐殖酸,2009(4):19-24.
