浓缩方法及保存条件对小球藻藻膏脂肪酸的影响
2012-09-19陈炜王秀芬白永安李晓东邢殿楼
陈炜,王秀芬,白永安,李晓东,邢殿楼
(1.大连海洋大学水产与生命学院,辽宁大连116023;2.盘锦光合水产有限公司,辽宁盘锦124200;3.大连海洋大学农业部北方海水增养殖重点实验室,辽宁大连116023)
小球藻Chlorella sp.是水产经济动物幼体的优质天然饵料。在实际生产中,因天气、季节等因素的影响,常常使得小球藻培养量不稳定,导致育苗中鲜藻液供给不足,因此,需要储备一定量的浓缩藻液或藻膏,以备鲜藻液缺乏时使用。
小球藻在浓缩和保存过程中,其营养成分的变化情况是一个值得关注的问题。小球藻的营养价值主要与其多不饱和脂肪酸 (PUFA)有关。目前,浓缩单胞藻的方法主要有物理浓缩法和化学浓缩法,研究多集中于浓缩效果及保存条件对单胞藻存活的影响方面[1-5],而关于浓缩方法及保存条件对单胞藻脂肪和脂肪酸的影响方面,仅见王培磊等[6]、朱葆 华 等[7]、Montaini 等[8]、Grima 等[9]、宫庆礼等[10]分别对球等鞭金藻 Isochrysis galbana、扁藻Tetraselmis suecica、小球藻和绿色巴夫藻Pavlova viridis的浓缩藻液进行过少量报道。为此,作者详细研究了不同浓缩方法对小球藻粗脂肪和脂肪酸组成以及保存温度、时间对小球藻脂肪酸含量的影响,以期为小球藻浓缩方式、保存条件、贮存时间等的确定提供参考资料。
1 材料与方法
1.1 材料
试验用蛋白核小球藻Chlorella pyrenoidesa取自盘锦光合水产有限公司三角洲养殖场。
1.2 方法
1.2.1 小球藻的培养 将蛋白核小球藻在室外敞池培养,接种后及加水扩种后施用无机肥 (w(碳酸氢铵)∶w(过磷酸钙)=2∶1),全池均匀泼洒。适时进水和施肥。取样前两天每天施肥一次,保证试验池中营养充足。每天监测试验池的藻细胞密度和水化学指标。培养期间主要水化学指标:水温为10.0~12.5℃,盐度为19~21,pH为8.55~9.33,溶解氧为 15.2~20.0 mg/L,氨态氮为24.29~70.95 mg/L,活性磷为0.71~2.37 mg/L,透明度为11~18 cm。
1.2.2 浓缩方法
1)离心法 抽取新鲜藻液,经GF-105型管式高速分离机 (16 000 r/min)离心得到浓缩藻膏(简称离心组)。重复3次。
2)絮凝法 分别采用明矾、壳聚糖/海藻酸钠混合溶液进行絮凝试验。试验容器体积为50 L塑料桶。每种絮凝方式设3个重复组。根据文献[1-2,5-6]和预试验结果确定絮凝剂的使用量和配比,根据投入絮凝剂后藻液中的细胞密度(分光光度法)确定取样时间。
明矾絮凝浓缩组 (简称明矾组) 按80 mg/L的浓度向藻液中添加明矾母液,充分搅匀,静置12 h。采用虹吸法除去上清液,收集絮凝沉积的样品。
壳聚糖/海藻酸钠混合溶液絮凝浓缩组 (简称壳/海组) 按6 mg/L的总浓度向藻液中先添加壳聚糖母液 (含体积分数为5%的醋酸溶液),搅匀后再添加海藻酸钠母液,按同一方向搅匀,使w(壳聚糖)∶w(海藻酸钠)=9∶1。静置12 h后去除上清液,收集絮凝沉积的样品。
1.2.3 保存方法 将离心得到的新鲜藻膏用小瓶(3~5 g/瓶)盛装后分成3组,每组为10瓶,分别置于常温 (14.5~18.5℃)、冷藏 (4℃)和冷冻 (-24℃)条件下保存。常温组于试验开始后的第1、2、3周取样测定;冷藏组于试验开始后第2、8周取样测定,直至观察到样品酸败腐臭时终止试验;冷冻组于试验开始后的半年、1年取样测定,当样品脂肪酸明显氧化时终止试验。每次取2瓶进行分析,每瓶重复测定两次。
1.2.4 脂肪酸的测定方法和色谱条件 依改进的Folch法[11]提取粗脂肪。将所得粗脂肪用 KOH-甲醇于70℃下皂化1 h后,采用BF3催化法[12]制备脂肪酸甲酯,最后转移浓缩到石油醚中供色谱分析。
用日本岛津GC-2010型气相色谱仪进行脂肪酸分析。色谱条件:色谱柱为FFAP抗氧化交联石英毛细管柱 (中国科学院大连化学物理研究所生产),规格为30 m×0.25 mm×0.3 μm;进样口温度为260℃,分流比为100∶1;高纯N2为载气,柱流量为1 mL/min,柱温由160℃以2℃/min的速度升至230℃,并保持至出峰完毕;FID检测器,温度为230℃。色谱峰的鉴定采用部分脂肪酸甲酯标准样品 (SIGMA公司和上海试剂一厂生产)与ECL值相结合的方法[13-15],采用面积归一化法进行定量分析。
1.3 数据处理
采用SPSS 17.0统计软件进行单因素方差分析,试验数据用平均值±标准差表示。
2 结果与分析
2.1 不同浓缩方法制得的小球藻藻膏中粗脂肪和脂肪酸的含量
采用3种浓缩方式制得的藻膏中,离心组、壳/海组和明矾组粗脂肪的质量分数(干物质)分别为(23.38±0.99)%、(14.12±0.38)%、(4.17±0.11)%,且3组的粗脂肪含量之间均存在显著差异 (P<0.05)。
从表1可见,用不同浓缩方式得到的小球藻藻膏中脂肪酸的种类一致,质量分数超过10%的脂肪酸均为16∶0、16∶1、20∶5n-3。但离心组与絮凝组藻膏之间的脂肪酸含量存在一定差异,离心组与壳/海组之间有5种脂肪酸含量差异显著 (P<0.05),与明矾组之间有8种脂肪酸含量差异显著(P<0.05)。明矾组多不饱和脂肪酸的含量仅为离心组的76%,这主要是由于20∶5n-3(EPA)的含量显著降低所致;而饱和脂肪酸却比离心组增加了56%,主要是由于16∶0的含量增加所致。
2.2 不同保存条件下小球藻藻膏的脂肪酸含量
常温 (14.5~18.5℃)下保存的小球藻藻膏中脂肪酸的含量见表2。从表2可见,小球藻藻膏在常温下保存3周期间,除18∶3n-6和20∶3n-6的含量有所波动之外,其余脂肪酸的含量均无显著变化。但在试验期间,藻膏的颜色、气味等外观特征变化非常大:当保存一周后,藻膏逐渐产生异样腥味,并随着保存时间的延长,腥臭味渐浓;保存4周时,藻膏由绿色变为墨黑色,膏体变稀,产生刺鼻的腐臭气味,已经明显腐败,故试验终止。
冷藏 (4℃)条件下保存的小球藻藻膏中脂肪酸的含量见表3。从表3可见,在冷藏8周期间,脂肪酸种类没有变化,几乎所有脂肪酸 (除14:1外)的含量均无显著变化。此外,在冷藏条件下保存6周时,藻膏开始产生异样腥味,至8周时腥臭气味渐浓,腐败迹象明显。
在冷冻 (-24℃)条件下保存的小球藻藻膏中脂肪酸的含量见表4。从表4可见,藻膏在冷冻条件下保存1年期间脂肪酸种类保持不变,与此同时,各脂肪酸相对含量随着冷冻时间的延长而逐渐发生变化。在冷冻条件下保存半年时,除14:1和18:1n-9之外,各脂肪酸含量与新鲜藻膏之间的差异并不显著;保存至一年时,多不饱和脂肪酸含量由占总脂肪酸含量的50.87%明显减少至47.84%(主要是由于20:5n-3的减少所致),单不饱和脂肪酸含量则由初始时占总脂肪酸含量的27.54%明显增加至30.20%。
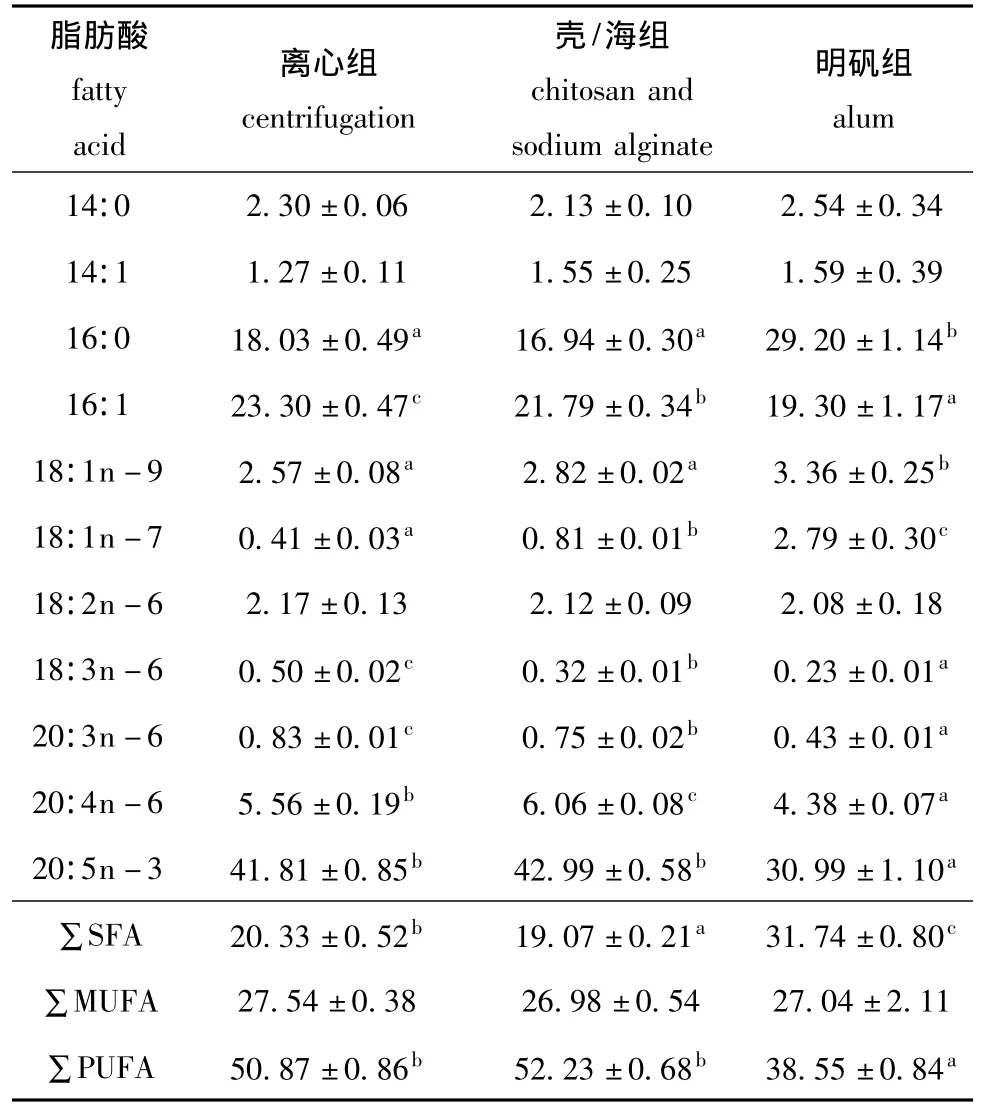
表1 不同浓缩方式下小球藻脂肪酸的含量Tab.1 Content of fatty acids in Chlorella pyrenoidesa concentrated by different methods w/%
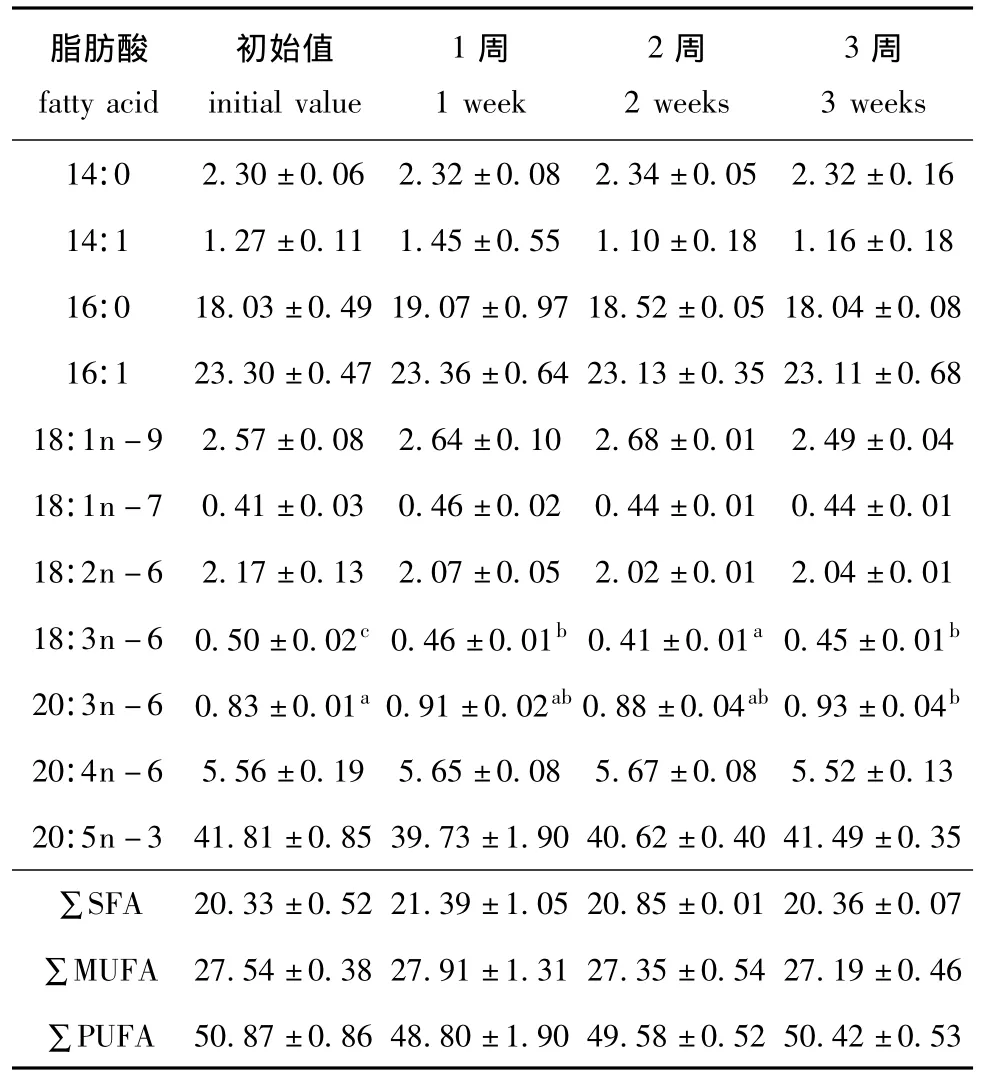
表2 常温下保存的小球藻藻膏中脂肪酸的含量Tab.2 Content of fatty acids in Chlorella pyrenoidesa paste stored at room temperature w/%
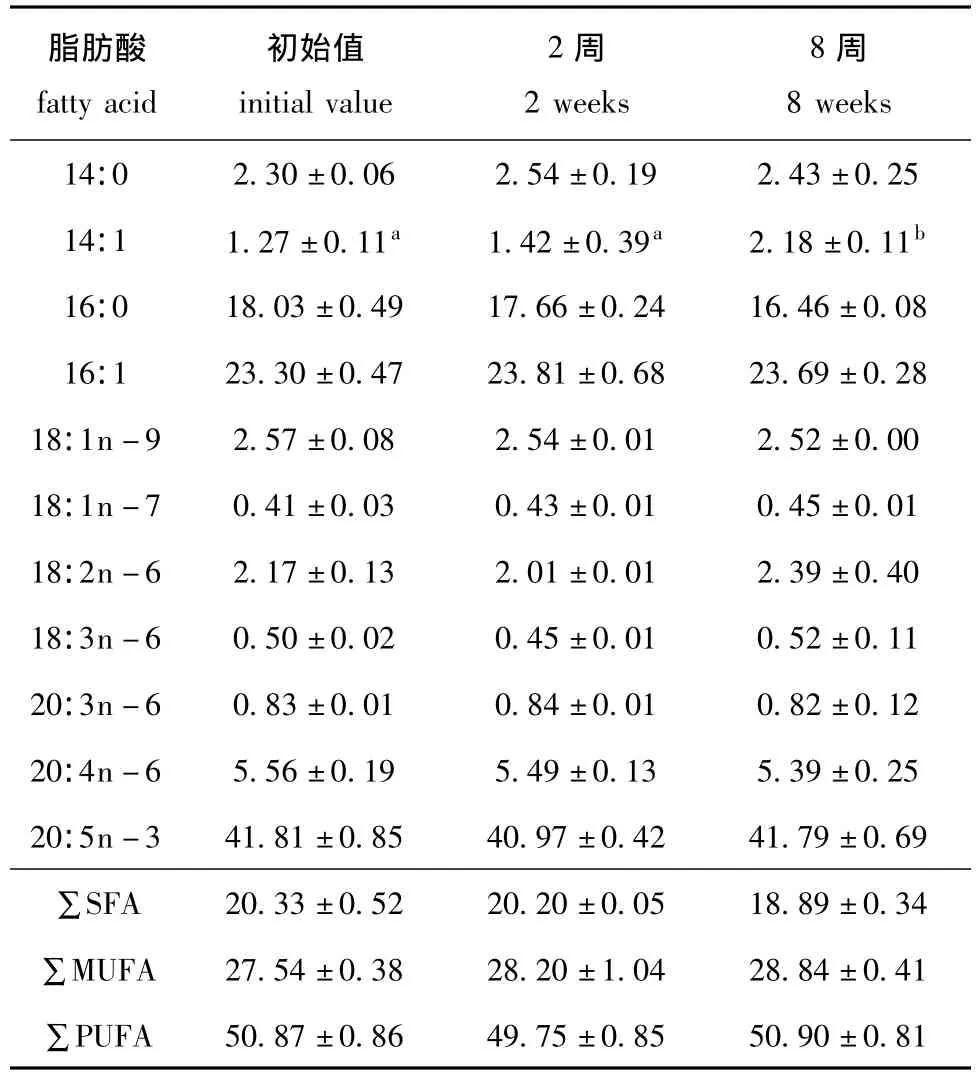
表3 4℃下保存的小球藻藻膏中脂肪酸的含量Tab.3 Content of fatty acids in Chlorella pyrenoidesa paste stored at 4℃ w/%
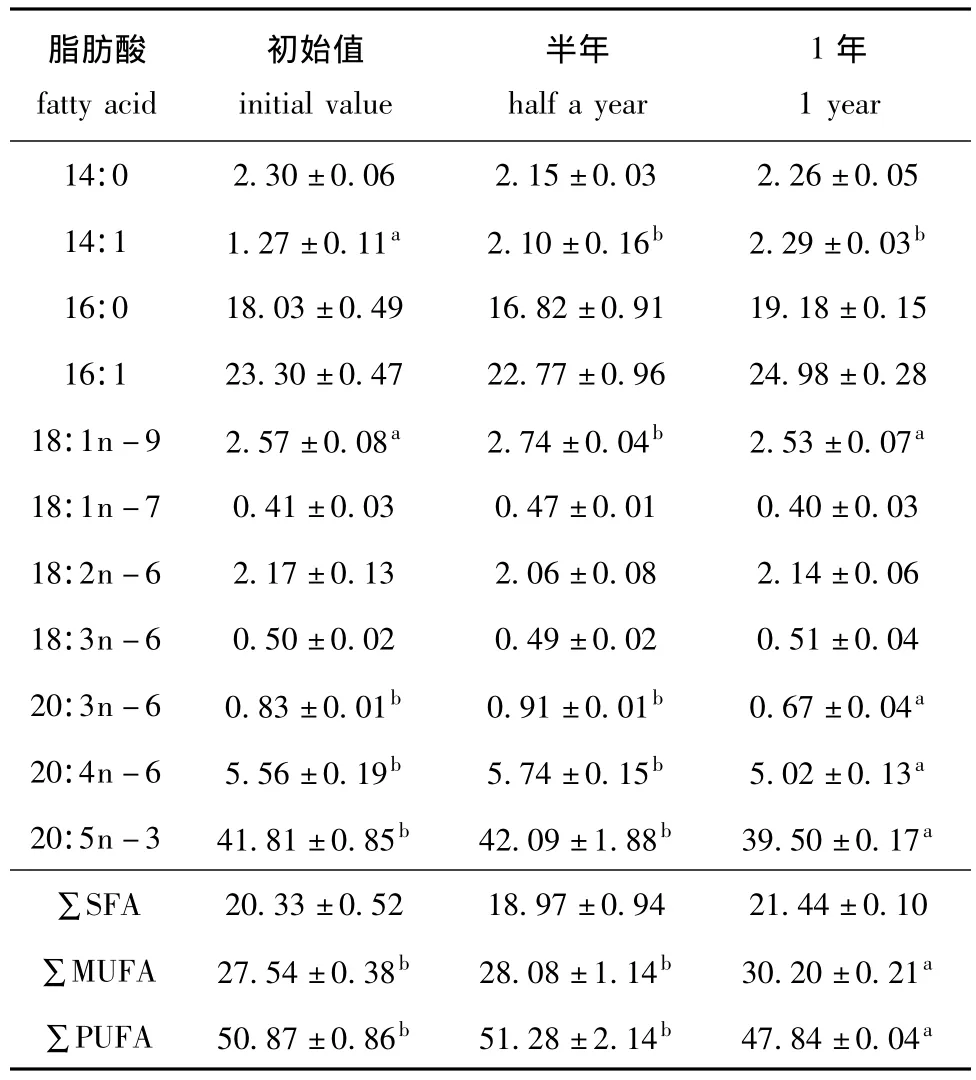
表4 -24℃下保存的小球藻藻膏中脂肪酸的含量Tab.4 Content of fatty acids in Chlorella pyrenoidesa paste stored at-24℃ w/%
综上所述,小球藻在保存过程中,脂肪酸的种类保持不变,各脂肪酸的含量因保存温度和保存时间而异。藻膏分别在常温 (14.5~18.5℃)下保存3周、4℃下保存8周、-24℃下保存半年时,大部分脂肪酸的含量无明显变化;但在-24℃下保存至1年时,20:5n-3和PUFA的百分含量显著减少 (P<0.05)。因此,藻膏在14.5~18.5℃下保存不宜超过1周,冷藏 (4℃)下不宜超过6周,冷冻下 (-24℃)不宜超过半年。
3 讨论
3.1 不同浓缩方法对小球藻粗脂肪和脂肪酸含量的影响
本试验中,离心组藻膏的粗脂肪含量明显高于两组絮凝组。这是由于通过絮凝方式得到的藻膏中的絮凝剂无法与藻体分离,使絮凝剂在样品中占有一定的比例,导致絮凝组藻膏的粗脂肪相对含量偏低。絮凝剂使用量越大,则粗脂肪相对含量越低。
宫庆礼等[10]采用超滤技术浓缩小球藻的研究表明,浓缩前后小球藻的总脂肪含量和脂肪酸成分均未见显著变化。在本试验的3种浓缩方法中,离心浓缩方式效果最好,浓缩效率高,不存在絮凝剂残留问题,但成本较高;壳聚糖和海藻酸钠作为絮凝剂,安全性高,浓缩效果尚可,脂肪酸含量与离心组比较接近;采用明矾浓缩方式的生产成本最低,但藻膏中的不饱和脂肪酸 (尤其是EPA)含量显著下降。此外,在试验中还观察到,明矾组藻液颜色发黄,沉淀的小球藻分散性差,细胞变性,说明明矾对小球藻的毒害作用较大。这与孙建华等[1]的研究结果一致。
综上所述,絮凝方式不仅使藻膏粗脂肪明显降低,而且使部分脂肪酸含量改变,其中明矾组的多不饱和脂肪酸含量比离心组减少约24%,表明采用明矾絮凝方式降低了小球藻的营养价值。
3.2 保存条件对小球藻藻膏脂肪酸含量的影响
在常温下,藻细胞代谢旺盛,加之藻密度极大(泥膏状),藻细胞死亡后酸败,产生一些胺类、脂肪聚合物、醛、酮、过氧化氢和烃类等物质,发出一种刺鼻的腥臭气味。王培磊等[6]在试验中亦观察到相同的现象。
不同学者在藻浓缩液冷藏保存过程中得到的脂肪酸变化规律的研究结果也不尽相同。Grima等[9]研究了冷藏 (4℃下保存30 d)条件下对球等鞭金藻浓缩液活性和脂肪酸分布的影响,发现虽然脂肪酸分布不受存贮时间的影响,多不饱和脂肪酸几乎保持不变,但饱和脂肪酸和单不饱和脂肪酸却有明显降低。朱葆华等[7]在研究温度对绿色巴夫藻和球等鞭金藻保存效果的影响时发现,4℃下保存45 d时,球等鞭金藻中饱和脂肪酸的含量明显降低,而不饱和脂肪酸含量基本保持不变;绿色巴夫藻中饱和脂肪酸的含量先降低再略升,不饱和脂肪酸亦基本保持不变。Montaini等[8]将扁藻浓缩液于4℃下保存90 d后发现其脂肪酸组成没有变化。王培磊等[6]将小球藻和球等鞭金藻浓缩液于0~4℃下保存5个月后,观察到其脂肪酸无显著变化。由此可见,不同研究者得出的“脂肪酸的分布和种类不随保存条件和时间的变化而变化”的结论是一致的,而在脂肪酸含量的变化规律上存在差异。这可能与藻的种类、浓缩液密度、保存条件以及取样截取时间点等不同有关。
小球藻藻膏在冷冻保存1年期间脂肪酸种类不变,这与Montaini等[8]对扁藻 (-18℃下保存21个月)以及Grima等[9]对金藻 (-20℃下保存30 d)的研究结果一致。不同类型脂肪酸被氧化的速率不同,当某种脂肪酸被氧化速率比总脂肪酸平均氧化速率快时,其在总脂肪酸中的相对含量将减小,反之则增大。本试验中,当藻膏在-24℃下冷冻保存1年时,PUFA由初始的50.87%减少至47.84%,MUFA由初始的27.54%增加至30.20%,说明PUFA被氧化的速率比总脂肪酸平均氧化速率快,而MUFA被氧化的速率比总脂肪酸平均氧化速率慢。朱葆华等[7]在对金藻和绿色巴夫藻的试验中发现,绿色巴夫藻于-22℃下保存45 d时,SFA有所减少。本试验中,SFA含量在冷冻保存半年时也略有减少,当冷冻至1年时又稍有增加。这可能是由于SFA开始时被氧化的速率略高于总脂肪酸的平均氧化速率,而后又略低于总脂肪酸的平均氧化速率所致。
总之,藻膏在不同温度下脂肪酸变化的内在机制比较复杂,存活的藻细胞仍有一定的代谢能力,死亡细胞则逐渐腐败。此外,随着保存时间的延长,同时也存在脂肪酸被氧化的问题。因此,有必要通过脂肪酸含量的变化规律来进一步研究脂肪酸变化的内在机理。
致谢:试验过程中得到大连海洋大学雷衍之教授和李永函教授的悉心指导和热情帮助,在此表示衷心感谢!
[1]孙建华,王如才,田传远,等.海产单胞藻沉淀方法的研究[J].海洋科学,1997(3):9-13.
[2]蒋霞敏,朱艺峰,王志铮,等.单胞藻浓缩、保藏及应用技术的初步研究[J].浙江水产学院学报,1993,12(2):81-91.
[3]梁德海,彭树杰.浓缩小球藻低温保藏技术的研究[J].海洋科学,1999(2):21-24.
[4]项文钰,吴玉梁,沈颂东.微藻冷冻保藏的研究[J].水利渔业,2004,24(3):23-24.
[5]郑必胜,蔡妙颜,郭祀远,等.壳聚糖在小球藻采收中的应用[J].海湖盐与化工,2003,32(1):7-9.
[6]王培磊,宫庆礼,麦康森,等.两种海洋单胞藻浓缩与保存效果的研究[J].海洋湖沼通报,2001(4):12-19.
[7]朱葆华,潘克厚,林黎明.温度对2种饵料金藻保存效果的影响[J].海洋科学,2006,30(10):70-74.
[8]Montaini E,Zittelli C,Tredici M R,et al.Long-term preservation of Tetraselmis suecica:influence of storage on viability and fatty acid profile[J].Aquaculture,1995,134:81-90.
[9]Grima E M,Sanchez Perez J A,Camacho F G,et al.Preservation of the marine microalga,Isochrysis galbana:influence on the fatty acid profile[J].Aquaculture,1994,123:377-385.
[10]宫庆礼,崔建洲,潘克厚,等.超滤技术在单胞藻浓缩中的应用[J].海洋科学,2004,28(1):5-7.
[11]Christie W W.Lipid Analysis[M].Oxford:Pergamon Press,1982:22.
[12]Metcalfe L D,Schmitz A A,Peaka J R,et al.Rapid preparation of fatty acids esters from lipids for gas chromatographic analysis[J].Analyt Chem,1966,38:514-515.
[13]Ackman R G.Analysis of oils and fats[M].London:Elsevies Appl Sci Pub,1986:137-206.
[14]Ackman R G.Simplification of analyses of fatty acids in fish lipids and related lipid samples[J].Acta Med Scand,1987,222:99-103.
[15]Christie W W.Equivalent chain-lengths of methyl ester derivatives of fatty acids on gas chromatography:A reappraisal[J].J Chromat,1988,447:305-314.
