中间球海胆精子超低温冷冻保存方法的研究
2012-09-19刘志丹李霞秦艳杰
刘志丹,李霞,秦艳杰
(大连海洋大学辽宁省海洋生物资源恢复与生境修复重点实验室,辽宁大连116023)
种质细胞冷冻保存始于20世纪50年代[1],该技术发展至今已取得很大成就。其中哺乳动物精子冷冻保存发展比较成熟,在人类生殖和畜牧业良种生产中已得到广泛应用,如精子库的建立。关于水产动物精子的超低温冷冻保存技术国内外学者也进行了研究,报道较多的为鱼类和贝类[2-7]。目前,关于海胆精子超低温保存技术的研究国外已有报道[8-9],而关于中间球海胆 Strongylocentrotus intermedius冷冻保存技术的研究却很少,仅见王笑月等[10]对此进行了初步研究。
中间球海胆的味道鲜美,营养价值较高,因而深受国内外市场的欢迎,现已成为中国北方海水养殖的主要种类之一。自20世纪90年代从日本引进中间球海胆后,由于近亲交配和环境等因素的影响,造成该种质退化并出现病害等问题,所以每年需从原产地引种。然而,大规模的运输带来费用提高、种胆死亡以及繁琐的检疫等一系列问题,而建立海胆精子库则可以解决上述难题,同时对海胆种质资源的保存也有一定的意义。本试验中,作者研究了用超低温冷冻方法保存中间球海胆精子,以期为中间球海胆精子库的建立提供理论依据和技术支持。
1 材料与方法
1.1 材料
种海胆于2009年5—6月取自大连新碧龙海产有限公司,选取性腺发育成熟的中间球海胆,在实验室中暂养,每日换水一次,换水量为1/2。
从中间球海胆围口膜处注射0.075 mol/L KCl 1 mL,然后单个放在50 mL烧杯上,待精卵产出后分别收集。
1.2 方法
1.2.1 不同降温方式对精子存活率和受精率的影响试验 根据预试验结果,将鲜精液与用煮沸消毒海水配制的DMSO(体积分数为10%)冷冻保存液按体积比1∶1混合后装入1.8 mL冻存管中。将冻存管放入冰箱 (4℃)内平衡10 min后,悬于液氮面上方进行预冷,预冷方式分为4组:D1组,于液氮面上方3 cm(约-160℃)处停留8 min;D2组,于液氮面上方15 cm(约-60℃)处停留8 min;D3组,于液氮面上方15、3 cm处分别停留3 min和5 min;D4组,直接浸入液氮(-196℃)中,预冷后将各组冻存管均浸入液氮中,24 h后解冻,观察精子的存活率和受精率。
1.2.2 冷冻保存液的筛选 根据“1.2.1”节的试验结果,以煮沸消毒海水为基础液添加不同浓度的DMSO、甘油、海藻糖配制成不同浓度的冷冻保护液,分别记为对照组、A1~A13组。将不同浓度的冷冻保护液与鲜精液按体积比1∶1混合装入1.8 mL冻存管中,于冰箱 (4℃)内平衡10 min,然后在液氮面上方15、3 cm处分别停留3 min和5 min,最后浸入液氮中保存。24 h后解冻,统计精子的存活率和受精率。冷冻保护液配方见表1。
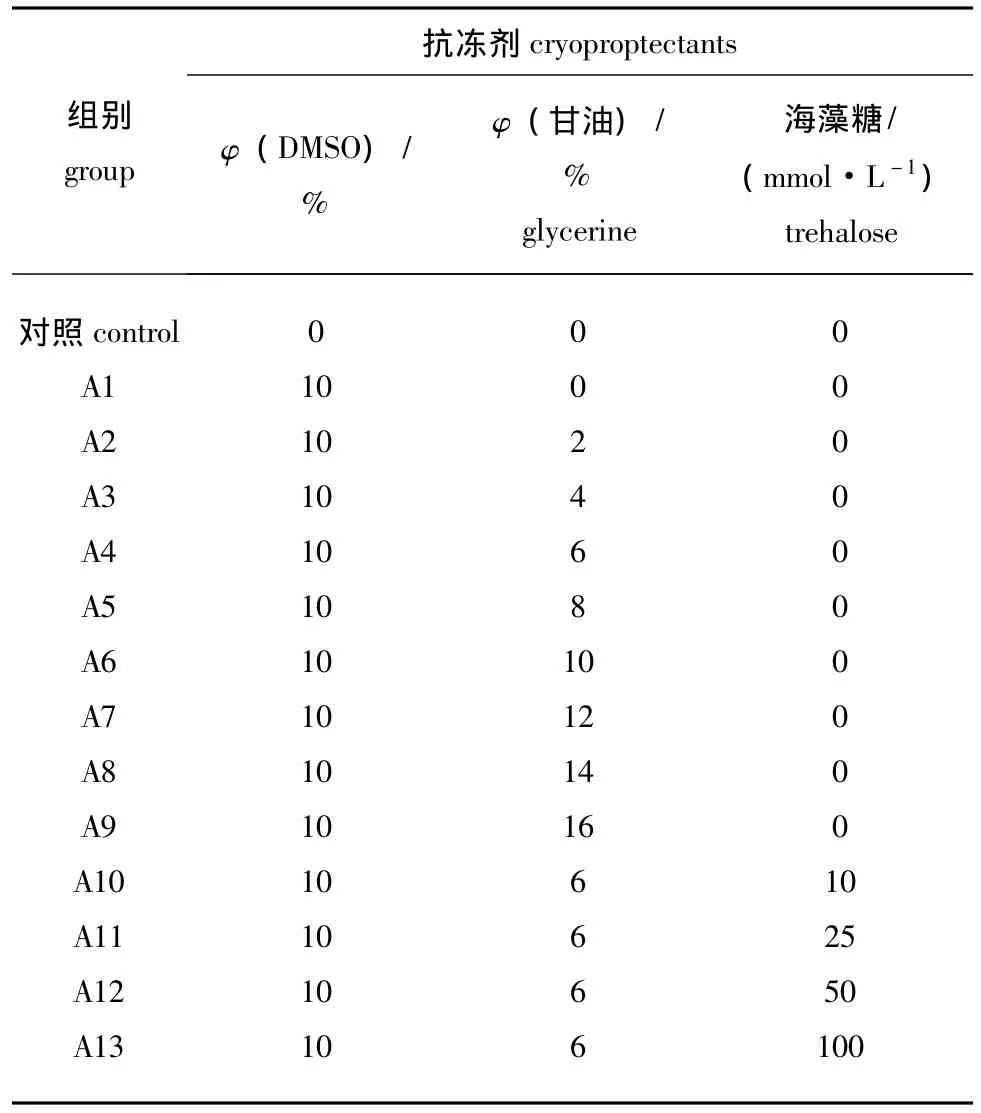
表1 冷冻保护液的配方Tab.1 Formula of antifreezers
1.2.3 平衡时间的选择 将鲜精液与A11冷冻保护液按体积比1∶1混合后装入1.8 mL冻存管中,最终体积为1 mL。将冻存管于冰箱 (4℃)中分别平衡0、5、10、15、20、30 min,取出后在液氮面上方15、3 cm处分别停留3 min和5 min,然后将冻存管浸入液氮中,24 h后取出冻存管解冻,统计精子的存活率和受精率。
1.2.4 葡萄糖对精子受精率的影响 将鲜精液与抗冻液A11按1∶1混合后,于冰箱 (4℃)内平衡15 min,按照“1.2.1”节中D3组的降温方式冷冻,冷冻保存24 h后解冻,统计精子的存活率后进行受精。将精子放入受精海水中,分别加入浓度为0、28、56、112、280 mmol/L的葡萄糖 (分别记为A、B、C、D、E组),统计精子的受精率。
1.2.5 解冻 解冻时将浸入液氮内的冻存管取出,悬于液氮面上方15 cm处平衡5 min,然后迅速放入水浴锅中 (22±2℃)解冻。
1.2.6 存活率、受精率的统计 用5 g/L的台盼蓝于室温下染色15 min,在显微镜下观察精子的存活率。死亡精子的顶体部或核体部呈蓝色,活精子不着色。每次统计200个精子,重复3次[11],计算存活率:

将解冻后的精子与新鲜卵子混合受精,精子与卵子的比例为1 000∶1。每次统计100个卵子,重复3次,计算其受精率。受精率以发育至原肠胚的卵子数占全部统计数的百分比来表示。
上述试验选取新鲜精子的存活率均在90%以上。
1.3 数据分析
采用SPSS 18.0软件对试验结果进行统计分析,用One Way-ANOVA法进行方差分析,若差异显著则采用Ducan's多重比较方法进行组间差异显著性检验。试验数据均用平均数±标准差表示。
2 结果
2.1 降温方式对精子存活率和受精率的影响
从表2可见:采用在液氮面上方15、3 cm处分别停留3 min和5 min(D3组)的降温方式对精子的冷冻效果好于其他组,精子的存活率和受精率分别为24.7%±3.8%和8.3%±2.5%,而直接浸入液氮中 (D4组)的效果最差。

表2 不同降温方式对冷冻精子存活率和受精率的影响(n=3)Tab.2 Effect of different freezing ways on post-thawed sperm survival rate and fertilization rate(n=3)
2.2 冷冻保护液的筛选
本试验结果表明:随着甘油添加量的增加,A1~A9试验组精子解冻后的存活率和受精率先增加后下降,其中A4试验组冻存效果最好,冷冻后精子存活率和受精率分别为48.83%±2.40%和15.37%±10.00%;在A4组冷冻保护液基础上添加适量海藻糖能够提高冷冻后精子的存活率和受精率,海藻糖添加的最佳浓度为25 mmol/L,在添加此浓度的抗冻液 (A11)组中精子的存活率和受精率最高,分别达到54.2%±4.4%和23.0%±3.2%(图1)。
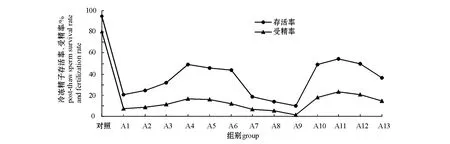
图1 抗冻保护液对冷冻精子存活率和受精率的影响Fig.1 Effect of cryoprptectant type on post-thawed sperm survival rate and fertilization rate
2.3 平衡时间对精子冷冻效果的影响
从表3可见:冷冻精子解冻后的存活率和受精率均随平衡时间的增加先上升后下降,平衡时间为15 min时,精子的存活率和受精率达到最高,分别为58.2%±4.0%和24.7%±2.9%。平衡时间为15 min的冷冻精子与平衡时间为20、40 min的两组冷冻精子相比,解冻后精子的存活率变化不显著(P>0.05),但受精率却显著下降 (P<0.05)。

表3 4℃下平衡时间对冷冻精子存活率和受精率的影响Tab.3 Effect of equilibration time at 4℃on postthawed sperm survival rate and fertilization rate
2.4 添加葡萄糖对冷冻精子受精率的影响
从表4可见:精子冷冻后在受精液中添加适量的葡萄糖有助于提高精子的受精率,其中C组受精率最高 (29.0% ±0.6%),显著高于对照组(A组)(23.0% ±1.0%)(P<0.05),而E组(15.7%±2.1%)却显著低于对照组(P<0.05),其它试验组与对照组差异均不显著(P>0.05)。

表4 葡萄糖对解冻后精子受精率的影响Tab.4 Effect of glucose on post-thawed sperm fertilization rate
3 讨论
3.1 降温方式对精子冻存效果的影响
降温方式从速率上大致分为慢速冷冻和快速冷冻。由于快速冷冻与慢速冷冻相比,不易形成大冰晶,对细胞的损伤较小,现已被多数学者采用[2-6]。杨爱国等[2]采用距液氮表面 25、20、10 cm处各停留8 min的降温方式对扇贝精子进行超低温保存,效果较好。李纯等[3]用程序冷冻仪在超低温保存栉孔扇贝Chlamys farreri精子时发现,以20℃/min的降温速率方式来保存精子,其效果最佳。史东杰等[4]以体积分数为16%的DMSO为抗冻剂,采用五步降温的方式冷冻保存缺帘鱼Bryconcophalus精子并获得成功。本试验中,作者采用分步降温冷冻方式,通过查看液氮面上方不同高度间的温度确定降温方式[5],在液氮面上方15 cm(约-60℃)和3 cm(约-160℃)处分别停留3 min和5 min后浸入液氮中,对精子的保存效果较好。杨培民等[6]在对虾夷扇贝Patinopecten yessonesis进行冷冻保存时也得出类似的结果。
3.2 冷冻保护液的筛选
在精液中加入冷冻保护液后,通过提高精子细胞质的浓度、降低冰点等作用来降低对精子的冷冻损伤。目前常用的冷冻保护剂有DMSO和甘油。DMSO的渗透力强,亲水性好,能快速渗透进精子细胞内,降低精子细胞内电解质的浓度;而甘油可防止细胞脱水,并能保护精子蛋白质的结构。但两者在浓度较高的情况下都会对精子产生一定的毒害作用。陈东华[12]研究发现,在相同浓度下,甘油对精子的损伤程度明显低于DMSO,但随着浓度的增加,DMSO对精子的损伤程度增强。Anchordoguy等[13]研究了用DMSO保存锐脊单肢虾Sicyonia ingentis精子的效果,结果表明,用体积分数为5%的DMSO效果较好。Liliana等[14]的研究表明,在冻存红鲍Halioti rufescens精子时,采用体积分数为10%的甘油对精子的冻存效果要好于体积分数为10%的DMSO。
此外,海藻糖作为一种无毒无害的非特异性保护剂,它的抗脱水、抗高渗保护以及抗冷冻保护作用已逐渐被人们发现。Suzuki等[15]在常用的保护剂中加入海藻糖,当浓度为5~100 mmol/L时,能大大提高冷藏解冻的牛卵母细胞的受精率。Beattie等[16]的研究结果表明,海藻糖对于长期冷藏的人胰岛器官有增强活力和保护的功能。Eroglu等[17]报道了冷冻保存时加入低浓度的海藻糖后,能大大提高哺乳动物细胞的存活率。
目前已有的研究中大多使用单一抗冻液,但单一冷冻保护剂各有优缺点,不能满足精子冷冻保存时对各方面条件的要求。若将各种冷冻保护液有机地结合起来,会达到较好的效果[18]。本试验中将DMSO(10%)、甘 油 (6%)、海 藻 糖 (25 mmol/L)混合组成冷冻保护液,结果表明,解冻后精子的存活率和受精率明显提高,分别达到54.2%和29.0%。
3.3 平衡时间对精子冻存效果的影响
将添加了冷冻保护液的精液在低温条件下平衡,是为了使渗透型抗冻保护剂能充分渗入精子内部,提高细胞内的溶液浓度,降低冰点,减少胞内结冰对细胞的损伤,提高保存材料对低温的耐受能力[19]。但平衡时间过长,则会对精子造成损伤,所以选择合适的平衡时间,对于达到超低温冷冻保存精子的效果是非常重要的。
不同物种精子的渗透能力不同,所需的平衡时间也不尽相同。Bougrier等[20]认为,太平洋牡蛎Crassostrea gigas精子在冷冻保护液中的平衡时间不宜超过3 min,否则精子的受精率就会下降。Basavaraja等[21]的研究结果表明,解冻前平衡10~30 min对印度鲃Mahseer精子的冻存效果没有影响。鲁大椿等[22]认为,对鱼类精子低温冷冻保存时,平衡时间应为10~30 min。本研究结果表明,将中间球海胆精子与冷冻保护液混合后,当平衡时间为15 min时,其冷冻效果较好。
3.4 添加葡萄糖对冷冻后精子受精率的影响
精子的受精率与精子的活力密切相关。要得到高的受精率,精子必须具有较强的活力[23]。有研究发现,外源性葡萄糖能被精子利用,增强精子的活力,延长精子的寿命[23-25]。Urner等[26]研究表明,缺乏葡萄糖会阻碍小鼠精子进入卵中,进而影响精子与卵的融合。精子被激活后,由于精子运动和维持精细胞内外的渗透压平衡均需要消耗能量,这也是冷冻后精子受精率下降的原因之一。本研究中发现:精子被解冻后在进行受精时,在受精海水中添加适量的葡萄糖可以提高精子的受精率,葡萄糖浓度为56 mmol/L时其效果最好;但添加的葡萄糖浓度过高或过低时,都不利于精子受精。
[1]Polge C,Smith A U,Parkes A S.Revival of spermatozoa after vitrification and dehydration at low temperature[J].Nature,1949,164:666.
[2]杨爱国,王清印,孔杰,等.扇贝精液超低温冷冻保存技术的研究[J].海洋与湖沼,1999,30(6):624-628.
[3]李纯,李军,薛钦昭.栉孔扇贝精子超低温保存研究[J].海洋水产研究,2000,21(1):57-61.
[4]史东杰,孙砚胜,孙向军,等.缺帘鱼精子超低温保存的初步研究[J].吉林农业大学学报,2009,31(4):467-471.
[5]刘鹏,庄平,章龙珍,等.人工养殖西伯利亚鲟精子超低温冷冻保存研究[J].海洋渔业,2007,29(2):120-127.
[6]杨培民,杨爱国,刘志鸿,等.虾夷扇贝精子的冷冻保存及其杂交试验应用研究[J].上海水产大学学报,2007,16(4):351-356.
[7]章龙珍,江琪,庄平,等.超低温冷冻对俄罗斯鲟精子抗氧化酶活性的影响[J].大连水产学院学报,2009,24(6):504-508.
[8]Asahina E,Takahashi T.Cryopreservation of sea urchin embryos and sperm[J].Development,Growth and Differentiation,1979,21:423-430.
[9]Adams S L,Hessian P A,Mladenov P V.Cryopreservation of sea urchin(Evechinus chloroticus)sperm[J].Reproductive Aquaculture,2004,25:287-299.
[10]王笑月,周遵春,李华林,等.中间球海胆精子的超低温保存技术[J].水产科学,2002,21(3):1-3.
[11]柯亚夫,蔡难儿.中国对虾超低温保存研究[J].海洋与湖沼,1996,27(2):187-193.
[12]陈东华.中华绒螯蟹(Eriocheir sinensis)精子低温保存的研究[D].长春:东北师范大学,2006.
[13]Anchordoguy T J,Crogwe J H,Griffin F J,et al.Cryopreservation of sperm from the marine shrimp Sicyonia ingentis[J].Cryobiology,1988,25(3):238-243.
[14]Liliana S F,Carmen G P C,Jilla J,et al.Cryopreservation of sperm of red abalone(Haliotis rufescens)[J].Journal of Shellfish Research,2005,24(2):415-420.
[15]Suzuki T,Boediono A,Takagi M,et al.Fertilization and development of frozen-thawed germinal vesicle bovine oocytes by a onestep dilution method in vitro[J].Crytobiology,1996,33:515-524.
[16]Beattie G M,Crowe J H,Lopez A D,et al.Trehalose:a cryoprotectant that enhances recovery and preserves function of human pancreatic islets after long-term storage[J].Diabetes,1997,46(3):519-523.
[17]Eroglu A,Russo M J,Bieganski R,et al.Intracellular trehalose improves the survival of cryopreserved mammalian cells[J].Nature Biotechnology,2000,18:163-167.
[18]丁志丽,桑林华,王杏龙.哺乳动物胚胎冷冻保存的研究进展[J].上海畜牧兽医通讯,2004(2):18-19.
[19]李广武,郑从义,唐兵.低温生物学[M].长沙:湖南科学出版社,1998:41-59.
[20]Bougrier S,Rabenomanana L D.Cryopreservation of spermatozoa of the Japanese oyster,Crassostrea gigas[J].Aquaculture,1986,58:277-280.
[21]Basavaraja N,Hegde S N,Akash N,et al.The fertility of cryopreserved Deccan Mahseer,Torkhodree(Sykes)spermatozoa[J].Asian Fishedes Science,2002,15:193-202.
[22]鲁大椿,刘宪亮,章龙珍.鱼类精液冷冻保存技术操作规程[J].淡水渔业,1997,27(4):13-15.
[23]阮国良,冯家斌,杨代勤.渗透压、pH和温度对泥鳅精子活力及受精率的影响[J].湖北农学院学报,2004,24(1):22-25.
[24]Gardiner D M.Utlisation of extracellular glucose by spermatozoa of two viviprous fishes[J].Comp Biochem Physiol,1978,59(2):165-168.
[25]苏德学,严安生,田永胜.钠、钾、钙和葡萄糖对白斑狗鱼精子存活率的影响[J].动物学杂志,2004,39(1):16-20.
[26]Urner F,Sakkas D.Protein phosphorylation in mammalian spermatozoa[J].Reprod,2003,125:17-26.
