流式细胞仪快速检测鸭茅与多花黑麦草染色体倍性的研究
2012-09-18柳青慕王赟文王小山
柳青慕,王赟文,王小山
(1.中国农业大学动物科技学院草业科学系,北京100193;2.扬州大学动物科技学院,江苏扬州225009)
植物生产层
流式细胞仪快速检测鸭茅与多花黑麦草染色体倍性的研究
柳青慕1,王赟文1,王小山2
(1.中国农业大学动物科技学院草业科学系,北京100193;2.扬州大学动物科技学院,江苏扬州225009)
以鸭茅(Dactylisglomerata)和多花黑麦草(Loliummultiflorum)不同倍性的种质为材料,对流式细胞仪测定牧草多倍体的技术方法和结果进行评价,旨在利用流式细胞仪技术快速确定供试牧草的染色体倍性。采用根尖染色体计数法确定鸭茅‘北绿’品种和多花黑麦草‘Mammoth B’品种为四倍体,以这两个品种的相对核DNA含量和核内DNA复制的平均周期值作为参照,经流式细胞仪检测表明,鸭茅‘早生绿’品种和PI316209种质材料为四倍体,种质PI237602和PI368880为二倍体,PI316209种质的倍性与种质背景信息所提供的倍性存在差异;多花黑麦草‘Musashi’品种为四倍体,‘Tachimasari’和‘WasehopeⅢ’两个品种为二倍体。研究结果为流式细胞仪如何在同一物种范围内检测不同倍性样品提供了依据。
鸭茅;多花黑麦草;染色体;倍性;流式细胞仪
多倍体化在高等植物物种形成过程中具有重要作用,大约70%被子植物起源于多倍体[1]。染色体基数为7~9的植物进化过程涉及到多倍体化[2]。据鲍文奎等[3]对禾本科107个种的研究,71.96%是多倍体。鸭茅(Dactylisglomerata)和多花黑麦草(Loliummultiflorum)是温带丛生型禾本科优良栽培牧草,前者为多年生草本植物,原产欧洲,在欧洲一些国家的牧草生产中占有重要地位,同时也是美国大面积种植的牧草[4],在我国西南各省有野生种质分布[5];后者又叫意大利黑麦草、一年生黑麦草[6],为一年生植物,在我国也有较大范围的栽培[7]。鸭茅属仅含1个种,根据地理分布、染色体倍性和形态学性状又分为20个亚种[8]。根据染色体数目,鸭茅包括二倍体(2n=2x=14)、四倍体(2n= 4x=28)和六倍体(2n=6x=42),其中自然界以二倍体和四倍体为主[9]。多花黑麦草的染色体基数也为7,自然界均为二倍体,目前栽培品种中有一些是经过人工诱导加倍的四倍体多花黑麦草。
染色体计数与组型分析是传统的植物染色体倍性鉴定方法,采用一定时期、一定部位的组织细胞,经染色处理制片后在光学显微镜下测定染色体的数目、染色体外部和内部形态结构特征。植物染色体制片主要包括压片法和去壁低渗-火焰干燥法。要达到可准确鉴别染色体的目的,植物染色体制片对取材时间、部位、染色处理等技术环节的要求较高,特别是同时对大量的样品进行染色体倍性鉴定时,这种传统的染色体观测方法就表现出明显的局限性。流式细胞术(Flow Cytometry,FCM)是20世纪70年代发展起来的一项技术,它集计算机技术、激光技术、流体力学、细胞化学、细胞免疫学于一体。可以定量地测定某一细胞中的DNA、RNA或某种特异蛋白的含量,以及细胞群体中上述成分含量不同的细胞数量。随着倍性的增加,DNA含量呈倍性增加趋势,据此可快速鉴定细胞的倍性水平。流式细胞术不受植物取材部位和细胞所处时期的限制,制样简单、灵敏度、分辨率及准确性较高,数据的可重复性好,测试速度快,并且DNA含量变异可在分布图上直观地表现出来,特别适用于样品较多的倍性检测分析。此外,通过测定细胞核内的DNA含量,流式细胞术还可以比较不同植物或同一植物不同组织细胞的基因组变异程度[10]。
虽然目前流式细胞仪已普遍用于植物倍性研究,国内在菊花(Dendranthemamorifolium)[11]和辣椒(Capsicumannuum)[12]等植物的倍性研究上已有使用,但是有关牧草多倍体流式细胞术测定还未有研究报道。本研究以鸭茅和多花黑麦草不同倍性的品种为材料,在根尖组织制片显微镜观测确定染色体数目的基础上,对流式细胞仪测定牧草多倍体的技术方法和结果进行评价与比较,为今后利用流式细胞术快速鉴定大批量牧草样品的染色体倍性水平提供技术依据。
1 材料与方法
1.1 试验材料 参试的种质材料共有9个,其中鸭茅种质5个、多花黑麦草种质4个(表1)。除PI编号的种质来自美国植物引种试验站以外,其余的鸭茅和多花黑麦草种质均来自日本草地畜产种子协会饲料作物研究所。将试验材料分别在温室和光照培养箱中育苗和发芽。温室育苗时先将100粒种子在直径30cm,高度25cm的花盆中育苗,待幼苗株高3~5cm时,将单株移植至直径9cm、高度10cm的花盆中继续生长,每个品种移植30个单株,用于根尖染色体计数和流式细胞仪测定。光照培养箱发芽条件为恒温25℃,培养至根长1cm左右。
1.2 试验方法
1.2.1 流式细胞仪检测方法 随机选取鸭茅‘北绿’和多花黑麦草‘Mammoth B’的温室种植单株各6株和培养箱发芽种子6粒,通过压片法[13]进行染色体计数。具体操作为取这两份种质在温室栽培的单株材料和光照培养箱萌发种子的根尖部位0.5cm大小的材料,冰水浴24h后,转入卡诺固定液(甲醇∶冰醋酸=3∶1)固定24h,用蒸馏水冲洗后放入1mol·L-1HCl溶液中,在60℃水浴5~7min,蒸馏水冲洗,改良卡宝品红溶液染色5min,压片法制片,尼康80i生物显微镜镜检、拍照。

表1 供试材料及其来源Table 1 Experimental materials and seed source
取上述根尖染色体计数后的1株温室种植单株为对照材料,流式细胞仪进一步确定另外5株染色体计数后的温室种植单株的染色体倍性水平。具体的操作步骤参照陈斌等[14]的方法,取供试材料的新鲜嫩叶约50mg放入已加入1mL裂解液的培养皿中,用保险刀片切碎,过滤,收集滤液,1 100 r·min-1离心6min后,倒去上清液,向沉降物中加入200μL碘化丙啶(PI)染色液(50μg·mL-1),4℃冰箱中黑暗处理20min后,流式细胞仪对其进行检测。检测中,用已确定染色体数目的对照材料调整流式细胞仪,使对照材料的主峰位于100道附近,由此仪器检测图示当中,50道、150道和200道附近的峰显示的细胞核相对DNA含量分别为100道的1/2、3/2和2倍。
然后以这两个品种已经确定染色体倍性的单株为对照材料对其他供试材料进行流式细胞仪检测。流式细胞仪检测中其他种质材料每份材料随机检测6个温室种植单株,并记录检测值的变异系数。
研究中使用的流式细胞仪均为北京市农林科学院蔬菜研究中心提供的美国BD公司的FACSCalibr流式细胞仪,同为BD公司的CellQuest软件获取数据,所得数据用美国Yerity Software House公司的ModFit软件进行分析。
1.2.2 流式细胞仪检测中的数据处理 根据流式细胞仪检测结果利用下列公式[15]计算每个供试样本的周期值(Cycle alue),以确定被检测植物器官的染色体倍性水平。

式中,n2C、n4C、n8C、…、nXC分别为核相对DNA含量2C、4C、8C、…、XC的细胞核数。式中所得的周期值可以表示每个细胞核核内复制的平均周期数,当检测一个植物器官时所得周期值大于0.1,则可认为其是混倍体或内源多倍体(Endoployploidy),即该植物器官是由多种不同倍性水平的细胞构成。
2 结果
2.1 流式细胞仪校准 对鸭茅‘北绿’品种和多花黑麦草‘Mammoth B’品种供试样本的的根尖细胞染色体计数结果显示二者均为四倍体,即2n=4x=28(图1),确定了其染色体倍性与表1的染色体倍性水平相同。
以经根尖细胞压片法确定为四倍体的鸭茅‘北绿’和多花黑麦草‘Mammoth B’两个品种为参照,将其流式细胞仪检测结果主峰校正在100道,以此为样品的相对核DNA含量4C检测值(图2)。此外,在200道附近还有一个略微明显的峰,这表示在被检测样品中尚有核相对DNA含量8C的细胞存在,而这份对照材料供试样品的DNA复制周期值均小于0.1(表2),表明不存在内源多倍体现象。因此,以流式细胞仪检测位于100道处出现的峰值为供试样本G1期(DNA复制前期)细胞的相对核DNA含量,200道处则是供试样品G2期(DNA复制后期)细胞的相对核DNA含量。
2.2 参试样品流式细胞仪检测

图1 鸭茅‘北绿’和多花黑麦草‘Mammoth B’的压片结果Fig.1 Chromosome count at metaphase stage of root tip cells inDactylisglomerataKitamidori andLoliummultiflorumMammoth B
2.2.1 鸭茅 在利用鸭茅‘北绿’和多花黑麦草‘Mammoth B’两个品种对流式细胞仪检测进行校准的基础上,对其他鸭茅参试材料的倍性检测结果表明,‘早生绿’和PI316209两份材料的检测结果均与‘北绿’品种相同,主峰于100道处,为4C相对核DNA含量的峰(图3),而且被检测样本的周期值都小于0.1(表2),可以确定这两份材料均为四倍体。前者的检测结果与品种信息所提供的倍性水平相一致,而PI316209种质材料则与种质来源说明不同(表1),应为四倍体而不是二倍体。PI368880和PI237602两份材料的流式细胞仪检测结果包括位于50道的主峰和100道的侧峰,分别代表2C和4C相对核DNA含量的峰(图3)。因主峰表示2C相对核DNA含量,且主峰峰值远大于侧峰,可以确定这两份材料均为二倍体。其4C相对核DNA含量的峰可能有3个来源,第一,出于细胞染色体复制时期的G2期的细胞;第二,存在内源多倍体的可能,即在该材料的叶片中不仅有二倍体的细胞还有四倍体的细胞。第三,样品制备过程中,没有形成单细胞状态,存在细胞粘连现象。PI237602检测的6个样品当中,有5个样品的周期值大于0.1(表2),而PI36880的检测样品中,周期值小于0.1的有2个,大于0.1的为4个(表2),检测结果的重复性较好,不排除叶片中存在内源多倍体的可能。

图2 对照样品流式细胞仪检测值Fig.2 Flow cytometry values fromD.glomerataKitamidori andL.multiflorumMammoth B,which were used as internal standard

表2 供试样品的周期值Table 2 Cycle values of tested materials
2.2.2 多花黑麦草 参试的3份多花黑麦草材料中,‘Tachimasari’和‘WasehopeⅢ’两份材料的流式细胞仪检测结果都出现了位于50道附近的主峰和100道附近的侧峰(图4),表明叶片中存在2C和4C相对核DNA含量的两种细胞。因为被检测样本位于主峰区段的检测细胞数远远大于侧峰区段,因此,确定这3份多花黑麦草品种材料均为二倍体,检测结果与品种背景信息所提供的染色体倍性水平(表1)相一致。检测结果中4C相对核DNA含量峰的来源与2.2.1分析相似。Tachimasari’品种所有6份检测样品的周期值都大于0.1,而‘WasehopeⅢ’的6个检测样品中,有4份周期值大于0.1(表2),表明它们的叶片细胞中可能存在内源多倍体现象。‘Musashi’品种的检测结果显示在100道和200道附近分别出现主峰和侧峰(图4),且6份检测样品的周期值均小于0.1,确定‘sashi’料为四倍体,与品种材料的背景信息相同。

图3 参试鸭茅样品的流式细胞仪检测值Fig.3 Flow cytometry values of tested samples fromD.glomerata
2.2.3 流式细胞仪检测的变异系数和偏峰现象 在流式细胞仪检测结果中显示出鸭茅PI237602和PI368880这两份材料的变异系数小于品种‘早生绿’和PI316209的变异系数,多花黑麦草‘Tachimasari’和‘WasehopeⅢ’的变异系数小于品种‘Musashi’的变异系数(表3)。表明在流式细胞仪进行倍性检测时,同一物种中,染色体倍性低的试验材料的变异系数要小于染色体倍性高的试验材料的变异系数。
流式细胞仪检测中一些样品的峰位发生了向左或者向右偏移的现象,即偏峰现象(图3),且四倍体材料的偏移大于二倍体材料。
3 讨论
流式细胞仪检测常用的荧光染料包括4’,6-二脒基-2-苯基吲哚(DAPI)、碘化丙啶(PI)和溴化乙锭(EB)等,其中DAPI、EB等与DNA上的G-C碱基对可以发生特异性结合。与这些荧光染料不同,PI与DNA的结合无碱基特异性[16],其荧光可以被488nm的激光器检测到,因此适用于绝大多数流式细胞仪,在使用流式细胞仪进行植物核DNA含量测定时,PI是最常用的荧光染料[17]。核DNA含量和染色体数之间存在着线性关系[18],PI染色后,相同植物种的四倍体材料发出的荧光信号强度是二倍体材料的2倍,从而实现不同倍性材料的鉴别,检测的灵敏度较高。本研究进行流式细胞仪检测中,采用的荧光染料为PI,样品前处理采用提取液中保险刀片切碎组织的方法[19-20],处理速度快,平均处理每份材料用时30s。Georgiev等[21]认为流式细胞仪检测的变异系数在9%以内,其检测结果就比较可靠。本研究的检测结果变异系数均小于4%,说明利用流式细胞仪快速检测鸭茅和多花黑麦草叶片细胞的染色体倍性是可行的。
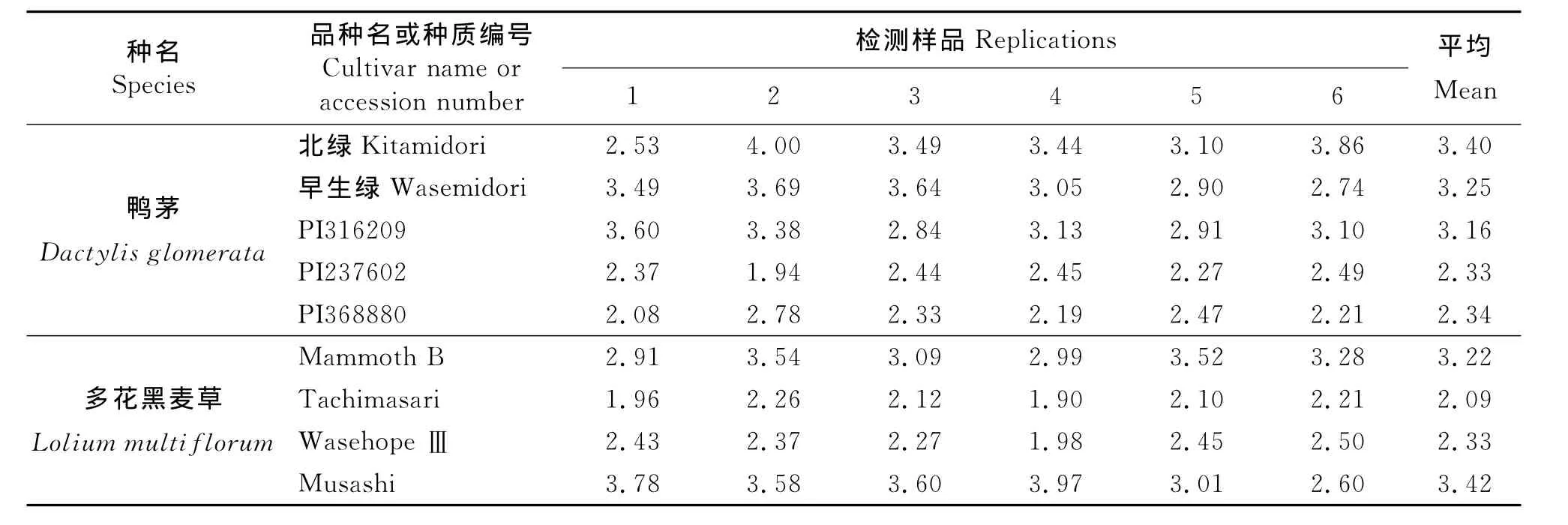
表3 流式细胞仪检测中供试样品的变异系数Table 3 Coefficient of variation values of tested samples by flow cytometry%
Arumuganathan和Earle[22]认为流式细胞仪检测时,单份样品的质量最好不超过50mg,如果样品量过高,则影响检测结果。当对照样品与检测样品属于不同的物种时,为便于结果分析和控制误差,在流式细胞仪测定核DNA含量、细胞周期和植物倍性的研究中,可以将对照样品与待测样品混合后在相同的条件下进行处理和检测[16]。本研究的目的是检测相同物种不同的倍性材料,若将对照样品与待测样品混合后处理和检测,则发生峰位重叠,检测结果难以分析,此外样品量也会相应的提高。因此,检测相同物种不同的倍性材料时,分别检测的效果要优于二者混合处理和检测。
流式细胞仪检测植物材料的研究表明,检测样品的倍性水平对结果的变异系数有一定的影响,同一植物物种中低倍性材料的变异系数小于高倍性材料的变异系数。本研究中,不论鸭茅还是多花黑麦草的四倍体材料变异系数均大于二倍体材料。究其原因,高倍性植物材料的细胞体积较大,细胞内含物较多,在细胞核提取的过程中混入的细胞碎片和杂质会比低倍性的植物材料多。
偏峰现象是流式细胞仪检测中的一种常见现象,属于检测误差。Farnham等[23]认为,样品荧光染色后放置的时间太长就会导致偏峰现象出现,这种现象通过样品的重复检测和缩短荧光染色后样品放置的时间有时可以消除[24]。因本研究采用对照样品与待测样品分开检测的方法,为消除或降低偏峰现象的发生程度,在每检测10个样品后,用对照样品调整峰位,起到了一定的效果。根据流式细胞仪自身的灵敏度和参数特性,通常认为被检测样品的峰位向左、向右偏移10~20道属于正常允许误差范围。当峰位偏移过多,且重复检测及重新调整对照样品峰位也不能消除时,则说明检测结果的差异来自被检测样品的倍性差异。
种子植物中,内源多倍体现象是植物生长发育过程中的一种常见现象[25],它是由植物体细胞的核内复制引起的,核内复制是指细胞核内DNA不断合成而细胞不分裂的现象,这种现象在植物体细胞分化过程中很常见[26-27]。利用流式细胞仪的检测结果计算相应的周期值可以在一定程度上衡量上述现象在植物器官中的发生概率。周期值这一计算公式是根据未经倍性诱导加倍和环境胁迫处理的情况下,同一时间、同一器官中活化分裂期细胞的百分含量来定义的。Barow[27]和Castro等[24]的研究都证明内源多倍体现象在植物中普遍发生,且在不同植物器官中这种现象发生的概率不同,与植物种类有关。本研究的参试材料当中,鸭茅PI237602与PI368880材料,以及多花黑麦草‘Tachimasari’和‘WasehopeⅢ’品种,叶片中可能存在少量不同倍性的细胞,即具有内源多倍体现象。内源多倍体的表象在二倍体材料中发生的机率高于四倍体材料。这种内源多倍体的真实性、发生原因及其生物学作用还有待进一步的研究。
致谢:中国农业大学农学与生物技术学院郭仰东教授、北京市农林科学院蔬菜中心的刘凡、张逸云老师在流式细胞仪检测中提供了帮助,在此致以诚挚谢意。
[1]Jane M.Stomatal size in fossil plants:evidence for polyploidy in majority of angiosperms[J].Science,1994,264(5157):421-424.
[2]Goldblatt P.Polyploidy in angiosperms,monocotyledons[A].In:Levis W H.Polyploidy,Biological Relevance[M].New York:Plenum Press,1980:219-239.
[3]鲍文奎,严育瑞,王崇义.禾谷类作物的多倍体育种方法的研究Ⅲ·加倍小麦-黑麦杂种第一代染色体数的秋水仙精技术[J].作物学报,1963,2(2):161-176.
[4]钟声,杜逸,郑全德,等.野生四倍体鸭茅农艺性状的初步研究[J].草业科学,1998,15(2):20-23.
[5]陈瑞祥,罗绍威,李正林,等.牧草新品种黔草4号鸭茅的选育[J].草业科学,2010,27(12):102-106.
[6]张新跃,李元华,苟文龙,等.多花黑麦草研究进展[J].草业科学,2009,26(1):55-60.
[7]章崇玲,梁祖铎.多花黑麦草生育特性和种子生产性能研究[J].草业科学,1997,14(3):40-45.
[8]Van S E,Sleper D A.Orchardgrass[A].In:Moser L E,et al.Cool-season Grassed[M].Madison,WI:Agronomy Monograph.ASA-CSSA-MSSSA,1996:23-241.
[9]谢文刚,张新全,马啸,等.中国西南区鸭茅种质遗传变异的SSR分析[J].草业学报,2009,18(4):138-146.
[10]Galbraith D W.Flow cytometric analysis of plant genomes[J].Methods Cell Biology,1990,33(48):549-562.
[11]王荣邦,张秀梅,吴忠义,等.菊花染色体倍性鉴定研究[J].安徽农业科学,2010,38(23):12778-12780,12789.
[12]陈斌,耿三省,张小芬,等.辣椒花药培养再生植株染色体倍数检测研究[J].遗传育种,2005(4):28-30.
[13]李懋学,张赞平.植物染色体及其研究技术[M].北京:中国农业出版社,1996:23-40.
[14]陈斌,赵泓,耿三省,等.辣椒花药培养再生株群体染色体倍性构成的多样性[J].华北农学报,2007,22(1):123-128.
[15]Barow M,Meister A.Endopolyploidy in seed plants is differently correlated to systematics,organ,life stategy and genome size[J].Plant Cell Environment,2003,26(4):571-584.
[16]Gray J W,Langlois R G.Chromosome classification and purification using flow cytometry and sorting[J].Annual Review of Biophysics and Biophysical Chemistry,1985,15:195-235.
[17]Dolezel J,Sgorbati G,Lucretti S.Comparison of three DNA fluorochromes for flow cytometric estimation of nuclear DNA content in plants[J].Physiologia plantarum,1992,85(4):625-631.
[18]Eaton T D,Curley J,Williamson R C,etal.Determination of the level of variation in polyploidy among Kentucky Bluegrass cultivars by means of flow cytometry[J].Crop Science,2004,44(6):2168-2174.
[19]Galbraith D W,Harkins K R,Maddox J M,etal.Rapid flow cytometric analysis of the cell cycle in intact plants tissues[J].Science,1983,220(4601):1049-1051.
[20]Dolezel J,Dolezelova M,Novak M J.Flow cytometric estimation of nuclear DNA amount in diploid bananas(MusaacumnataandM.balbisiana)[J].Biologia Plantarum,1994,35(3):351-357.
[21]Georgiev V,Weber J,Bley T,etal.Impoved procedure for nucleas estraction for DNA measurements by flow cytometry of red beet(BetavulgarisL.)hairy roots[J].Journal of Bioscience and Bioengineering, 1994,107(4):439-441.
[22]Arumuganathan K,Earle E D.Estimation of nuclear DNA content of plants by flow cytometry[J].Plant Molecular Biology Reporter,1991,9(3):229-233.
[23]Farnham F W,Caniglia E J,Thomas C E.Efficient ploidy determination of anther-derived broccoli[J]. Hortscience,1998,32(20):323-327.
[24]Castro S,Loureiro J,Rodriguez E,etal.Evaluation of polysomaty and estimation of genome size inPolygalavayredaeandPlcalcareausingflow cytometry[J]. Plant Science,2007,172(6):1131-1137.
[25]Smulders M J M,Ruskortekaas W,Gilissen L J W. Natural variation in patterns of polysomaty among individual tomato plants and their regenerated progeny[J].Plant Science,1995,106(2):129-139.
[26]Siwinska E,Lukaszewska E.Polysomaty in growing in vitro sugar-beet(BetavulgarisL.)seedlings of different ploidy level[J].Plant Science,2005,168(6):1067-1074.
[27]Barow M.Endopolyploidy in seed plants[J].Bioessays,2006,28(3):271-281.
Detection of chromosome ploidy level in Dactylis glomerata and Lolium multiflorumby flow cytometry
LIU Qing-mu1,WANG Yun-wen1,WANG Xiao-shan2
(1.Department of Grassland Science,College Animal Science &Technology of China Agricultural University,Beijing 100193,China;2.College Animal Science &Technology of Yangzhou University,Yangzhou 225009,China)
A practice of detecting chromosome ploidy levels inDactylisglomerataandLoliummultiflorumby a flow cytometry method was reported;and aimed to discuss its application and reliability in forage polyploidy research.In order to investigate the chromosome ploidy levels of 4D.glomeratagermplasms(Wasemidori,PI316209,PI237602and PI36880)and 3L.multiflorumcultivars(Musashi,Tachimasari and WasehopeⅢ)by using the flow cytometry method,two known tetraploidy cultivars,includingD.glomeratacv.‘Kitamidori’andL.multiflorumcv.‘Mammoth B’,were used as control materials. Their chromosome number in root tissue cells were double checked by the optical method and used to set a standard value in a flow cytometry.The results indicated that both of‘Wasemidori’and‘PI316209’inD.glomeratawere tetraploids,but‘PI237602’and‘PI36880’were diploids.For 3testedL.multiflorumcultivars,‘Musashi’was tetraploid,while‘Tachimasari’and‘WasehopeⅢ’were diploids.All chromosome ploidy levels of the tested cultivars or germplasms were confirmed to their known ploidy levels except of‘PI316209’inD.glomerata,which was a tetraploid instead of a diploid.The results provided a good reference to detect various chromosome levels in a same species by the flow cytomety method.
Dactylisglomerata;Loliummultiflorum;chromosome;ploidy level;flow cytometry
WANG Yun-wen E-mail:wyw@cau.edu.cn
S543.03;Q943
A
1001-0629(2012)03-0403-08
2011-04-26 接受日期:2011-07-14
国家“十一五”科技支撑计划课题牧草倍性育种技术研究(2008BADB3B03)
柳青慕(1986-),女,辽宁辽阳人,在读硕士生,研究方向为牧草育种与生物技术。E-mail:290021748@qq.com
王赟文 E-mail:wyw@cau.edu.cn
