CD40L在阿尔茨海默病中的免疫调节作用☆
2012-09-17王宝萍李东风胡方方徐书雯
王宝萍 李东风 胡方方 徐书雯
目前阿尔茨海默病 (Alzheimer's Disease,AD)病因尚不清楚,可能与遗传和环境因素有关。尸检发现AD患者海马及脑叶区存在炎性老年斑,说明β 淀粉样蛋白(amyloid-β,Aβ)诱发的炎症级联反应参与AD的发生发展。近来国外研究发现肿瘤坏死因子受体超家族成员CD40与其同源配体CD40L相互作用使Aβ1-42纤维体诱导的小胶质细胞异常活化、炎性反应扩大、加重对神经元细胞的损伤[1],国内对CD40-CD40L信号介导的慢性炎症反应与AD的关系方面研究甚少。目前认为Aβ1-42寡聚体对神经元的毒性作用最强,在介导炎症反应方面是否也是最强尚不清楚,本文通过体外建立AD的炎性反应模型,探讨CD40-CD40L信号在AD炎症反应中的作用,寻找治疗AD的可能的靶点,为后续试验提供依据。
1 材料与方法
1.1 细胞培养
1.1.1 原代小胶质细胞培养 新生乳鼠(3 d内)购自中山大学实验动物中心 (许可证号:SCXK(粤)2009-0011)无菌条件下取出大脑皮质,放入预冷、D-Hanks液清洗2次,小心剥离脑膜和血管,0.125%的胰酶消化,终止后过滤,离心,计数,接种(DMEM/F12高糖培养基,含1%青霉素、链霉素,20%胎牛血清)。24 h后全量换液、之后3 d换液一次,至7~9 d胶质细胞分层。上层细胞为圆形或椭圆,主要是小胶质细胞、少突胶质细胞,下层细胞连成片主要是神经元、星形胶质细胞。轻轻摇晃培养瓶5 min,收集上层细胞,差速贴壁法进一步纯化小胶质细胞。流式细胞术鉴定小胶质细胞表面CD11b。
1.1.2 原代神经元培养 取材接种同前,不同的是第2天更换无血清神经元培养基(含1%青霉素、链霉素,含 2%B27),3 d一次换液,4~5 d左右形成神经网络结构,NSE免疫细胞化学染色鉴定。
1.2 Aβ1-42寡聚体制作 将人工合成的 Aβ1-42晶体 0.5 mg从-20℃冰箱中取出,六氟异丙醇(HFIP)0.11 mL溶解、重悬。室温在通风橱内使HFIP挥发,Aβ1-42形成白色肽膜。然后用20 μL二甲基亚枫DMSO溶解,稀释分装。4℃、24 h后即为 Aβ1-42 寡聚体[2],透射电镜鉴定。
1.3 小胶质细胞炎性模型建立
将分离纯化的小胶质细胞以1×105/孔分别接种到六孔板中,设立实验组:采用不同浓度的寡聚体干预小胶质细胞,根据预实验结果(未给出),本实验采取浓度为 2.5 μg/mL 的 Aβ1-42 寡聚体单独及联合 2 μg/mL CD40L干预组、T细胞参与的适应性免疫应答产物之一γ干扰素(IFN-γ)10 μg/mL联合Aβ1-42组,并设立对照,包括单独予CD40L干预小胶质细胞及空白对照组,培养原代小胶质细胞24 h后检测小胶质细胞炎症介质释放水平及向抗原提呈功能转化情况;将干预过的小胶质细胞上清液继续培养神经元同时将不同干预条件直接培养神经元,分别培养24 h检测神经元乳酸脱氢酶(LDH)的释放水平来观察神经元的损伤,随后用 2.5 μg/mL抗 CD40抗体阻断CD40-CD40L通路后,继续观察以上指标的变化。
通过ELLSA法检测细胞上清液炎性介质TNF-α的释放,严格按ELLSA试剂盒说明书进行操作。
通过流式细胞术检测小胶质细胞表面CD40及MHCⅡ表达:收集细胞,PBS洗2次(1000 r/min,5 min),100 μLPBS 悬浮细胞,分别加入抗小 鼠FITC-CD40 抗体 (0.5 mg/mL)5 μL 或抗小鼠 FITCCD45 抗体(0.5 mg/mL)5 μL,抗小鼠 PE-MHCⅡ抗体(0.2 mg/mL)5 μL,避光室温孵育30 min,PBS 洗2 次(1 000 r/min,5 min),400 μL PBS 悬浮细胞,上机即流式细胞仪检测。
小胶质细胞被干预后的炎性上清液进一步干预神经元后,用ELLSA法检测神经元上清液LDH的释放情况,严格按LDH试剂盒说明书进行操作。
1.4 统计学方法 研究资料均采用SPSS 13.0进行统计分析,结果用(±s)表示,采用单因素方差分析,组间比较采用LSD法,检验水准α=0.05。
2 结果
2.1 原代小胶质细胞的分离培养与鉴定 小胶质细胞胞体圆形或椭圆形;流式细胞术鉴定纯化后的小胶质细胞,表面CD11b的阳性率在95%以上(见图1)。
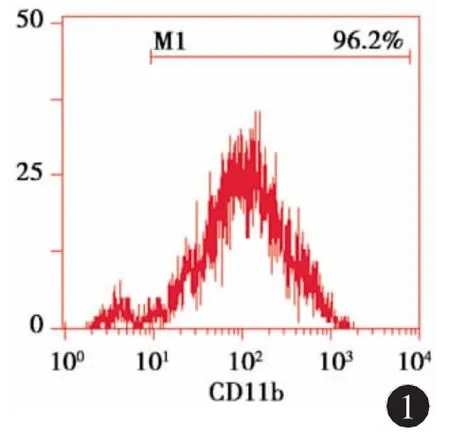
图1 小胶质细胞表面CD11b流式鉴定
2.2 原代神经元培养与鉴定 培养4~5 d后,神经元开始形成网络结构,免疫细胞化学染色可见细胞为棕褐色,阳性率为90%以上(见图2)。

图2 神经元免疫细胞化学染色
2.3 Aβ1-42寡聚体的制作 制作成功的 Aβ42寡聚体在透射电镜下显示为圆形或椭圆形的立体结构(见图 3)。

图3 Aβ1-42寡聚体透射电镜下检测
2.4 CD40L对AD炎症细胞模型影响及神经元损伤情况 与对照组相比,Aβ1-42寡聚体为2.5 μg/mL干预小胶质细胞24 h时,发现上清液中TNF-α释放明显增加,加入CD40L或IFN-γ后炎性介质增加更明显,加入抗CD40抗体后,发现上清TNF-α 释放减少,与 Aβ1-42+CD40L 组相比,差异均具有统计学意义(见表1)。干预小胶质细胞的炎性上清液培养神经元后,Aβ1-42+CD40L组与Aβ1-42组相比 LDH 的释放增加,Aβ1-42+CD40L+抗 CD40抗体组较Aβ1-42+CD40L组减少,差异具有统计学意义。用Aβ1-42等直接培养神经元,与炎症上清液培养神经元比较,LDH释放明显少 (见表1)。加入CD40L后小胶质细胞表面CD40及MHCⅡ分子共表达阳性率比单独Aβ1-42干预组高(见图4);加入抗CD40抗体后,二者的共表达阳性率较Aβ1-42单独及联合CD40L干预组下降(见图4)。

图4 小胶质细胞表面CD40及MHCⅡ表达
3 讨论
CD40L是主要表达于活化的星形胶质细胞、CD4+T细胞及血小板,而CD40表达于内皮细胞、小胶质细胞等。CD40L在一定条件下可与CD40相结合发挥生物学效应。AD患者血脑屏障(Blood brain barrier,BBB)受到破坏,血液中活化的 CD4+T细胞可以透过BBB进入脑组织参与免疫反应。
为研究CD40L在Aβ1-42寡聚体诱导的小胶质细胞活化中的作用及对神经元的影响,我们在体外建立AD炎症反应模型,并用炎症上清液培养神经元,模拟AD患者体内炎性微环境的改变对神经元的影响。结果表明:Aβ1-42寡聚体联合CD40L较单独干预小胶质细胞更能促进TNF-α释放。提示在促炎方面CD40L与Aβ1-42具有协同作用。我们继续用抗CD40抗体通过阻断CD40-CD40L通路,可以减轻Aβ1-42寡聚体诱导的炎症反应,减轻神经元的损伤。研究发现在TgAPPsw/CD40L基因缺陷鼠及体外阻断CD40-CD40L通路可以降低Aβ1-42 纤维体诱导的炎性反应[3-4]。这与我们的研究基本一致。此外,CD40L还可以促进Aβ42诱导的小胶质细胞表面表达CD40及MHCII分子明显增加,促进其向抗原提呈功能的转化,促进适应性免疫应答反应,进而加重对神经元的损伤。为进一步证实该结论,我们通过用T细胞的炎症产物IFN-γ干预Aβ42诱导的小胶质细胞,发现其与CD40L联合Aβ1-42产生的致炎效应相当。有研究[5]用米诺环素下调T细胞活化产生的CD40L,可以减少细胞毒性T细胞对产生Aβ1-42的神经元的损伤。说明CD40及CD40L对Aβ1-42诱导的小胶质细胞产生的固有免疫及适应性免疫应答方面均具有重要作用。此外,Aβ1-42及CD40L直接或炎症上清液干预神经元,发现后者对神经元的损伤更重。阻断CD40-CD40L信号通路,发现神经元损伤减轻。CD40L可能通过肿瘤坏子因子受体相关因子 (tumor necrosis factor receptor associated factor,TRAF)进一步活化核因子 κB(NF-κB)信号通路[6]或通过转录因子活化金属蛋白激酶[7]发挥作用。

表1 不同干预组小胶质细胞释放TNF-α水平、直接培养神经元及炎性上清液培养神经元后LDH的释放水平
Aβ1-42可以诱导CD40-CD40L调节小胶质细胞的固有免疫及适应性免疫活化[8],加重神经元损伤。小胶质细胞表面有不同的受体,在不同的微环境条件下,Aβ1-42刺激小胶质细胞产生神经保护或神经毒性作用,而CD40L则是促进小胶质细胞产生神经毒性的重要介质,促进胶质细胞向抗原提呈功能转化及炎症介质产生,进一步损伤神经元,因此,早期阻断CD40-CD40L通路有望成为治疗AD的潜在靶点。
[1]Townsend KP,Town T,Mori T,et al.CD40 signalingregulates innate and adaptive activation ofmicroglia in response to amyloid beta-peptide[J].Eur J Immunol,2005,35(3):901-910.
[2] 王建秀,王德生,段淑荣,等.原子力显微镜观察不同Aβ聚集状态的研究[J].中国现代医学杂志,2008,18(1):33-35.
[3]Todd Roach J,Volmar CH,Dwivedi S,et al.Behavioral effects of CD40-CD40L pathway disruption in aged PSAPP mice [J].Brain Res,2004,10(15):161-168.
[4]Laporte V,Ait Ghezala G,Volmar CH,et al.CD40 deficiency mitigates Alzheimer's disease pathology in transgenic mouse models[J].J Neuroinflammation,2006,3(3):342-343.
[5]Giuliani F,Hader W,Yong VW,et al.Minocycline attenuates T cell and microglia activity to impair cytokine production in T cell-microglia interaction[J].J Leukoc Biol,2005,78(1):135-143.
[6]Ait-ghezala G,Abdullah L,Volmar CH,et al.Diagnostic utility of APOE,soluble CD40,CD40L,and Abeta1-40 levels in plasma in Alzheimer's disease[J].Cytokine,2008,44 (2):283-287.
[7]Volmar CH,Ait-Ghezala G,Frieling J,et al.CD40/CD40L interaction induces Aβ production and increasesγ-secretase activity independently of tumor necrosis factor receptor associated factor(TRAF) signaling.Exp Cell Res,2009,315(13):2265-2274.
[8]Townsend KP,Town T,Mori T,et al.CD40 signalingregulates innate and adaptive activation ofmicroglia in response to amyloid beta-peptide[J].Eur J Immunol,2005,35(3):901-910.
