后循环缺血与前循环卒中患者单侧椎动脉优势现象对比☆
2012-09-17王庆松向阳王俊刘艳
王庆松向阳 王俊 刘艳
后循环缺血(posterior circulation ischemia,PCI)是指各种原因导致的椎基底动脉系统的缺血性改变,包括短暂性脑缺血发作(transient ischemic attack,TIA)和脑梗死两类,约占缺血性卒中的20%[1]。PCI有着与前循环病变相似的危险因素与致病机制,其中,动脉粥样硬化是PCI最常见的血管病理改变,而栓塞则是最常见的发病机制,其次为大动脉闭塞性损害引起血流动力学源性脑缺血所致[2];然而,由于前、后循环的特点不同,致使其各自的发病机制、临床表现及预后存在明显差异[3-4]。近年来随着神经影像学与神经介入技术在脑血管病诊断和治疗中的广泛应用,对颅内外血管本身发育异常,特别是椎动脉发育不良(vertebral artery hypoplasia)在 PCI 中的 作用渐 引起关 注[5-6],但 由于检测方法与传统观点的影响,目前对椎动脉发育不良及其他椎动脉优势 (vertebral artery dominance)现象在PCI中的意义尚不清楚。为此,本研究拟采用脑血管结构异常检查的“金标准”——全脑数字减影血管造影 (digital subtraction angiography,DSA),对比探讨包括椎动脉发育不良在内的单侧椎动脉优势在PCI中的作用和意义。
1 对象与方法
1.1 研究对象 采用病例对照研究,连续收集2009年3月至2011年3月在成都军区总医院神经内科住院的PCI患者及前循环缺血性卒中患者,均经头颅MRI或CT检查明确诊断,根据中国后循环缺血的专家共识[1]及全国第4届脑血管病学术会议制定的诊断标准[7]分为PCI组及前循环卒中组(对照组)。PCI组病例入组标准[1]:后循环TIA:①发病突然;②后循环供血区缺血性症状;③持续时间不超过24 h;④头颅CT、MRI检查无责任病灶。后循环梗死:①急性起病;②后循环供血区的症状和体征;③头颅CT、MRI检查发现责任病灶。排除标准:①不符合DSA适应证;②有DSA绝对和相对禁忌证;③未签署DSA手术知情同意书。符合上述标准者120例入组PCI组,其中,男76例,女44例,年龄21~80岁,平均 (56.8±12.1)岁,包括后循环TIA 99例,后循环梗死21例。对照组96例,均为前循环梗死患者,其中,男62例,女34例,年龄35~78岁,平均 (58.5±10.5)岁。两组性别及年龄构成比无统计学差异。本研究得到成都军区总医院伦理委员会批准,所有被研究者均提供了DSA书面知情同意。
1.2 DSA检查 使用 GE公司 Innova 3100 DSA机进行全脑数字减影血管造影,造影剂为碘海醇注射液(欧乃派克300,GE Healthcare AS)。采用改良的Seldinger法经右股动脉穿刺后行全脑DSA,包括主动脉弓、双侧锁骨下动脉、双侧颈总动脉及颈内动脉、双侧椎动脉正、侧位造影各1个序列,包括动脉期、毛细血管期、静脉期,对疑有血管结构异常的部位酌情加照不同角度或进行3D成像以进一步观察。
1.3 观察指标 重点观察两侧椎动脉管径是否对称,测量两侧椎动脉管径粗细,并观察椎动脉开口情况以及血管有无狭窄、闭塞、迂曲等改变,有无发育异常,是否由颈内动脉系统代偿供血等。
1.4 血管评估标准 本研究中的影像评估分别由2名未参加本研究工作的神经介入医生完成 (一致性检验 Kappa值=0.89)。椎动脉优势判断标准:具备下述条件之一者判定为一侧椎动脉优势[8-10]:①一侧椎动脉管径比另一侧明显增大,两侧直径相差0.3 mm以上(见图1);②虽然两侧椎动脉管径相差不大,但一侧椎动脉与基底动脉的连接较对侧更呈直线状 (in more of a straight line)(见图2)。椎动脉发育不良:具备下述条件之一者判定为一侧椎动脉发育不良[5,10]:①一侧椎动脉全程均匀性细小,椎动脉管径平均1.5 mm左右;②一侧椎动脉全程纤细狭小,其管径为对侧椎动脉的1/3以下(见图 3)。

图1 右侧椎动脉优势

图2 左侧椎动脉优势 (左侧椎动脉与基底动脉的连接较右侧更呈直线状)
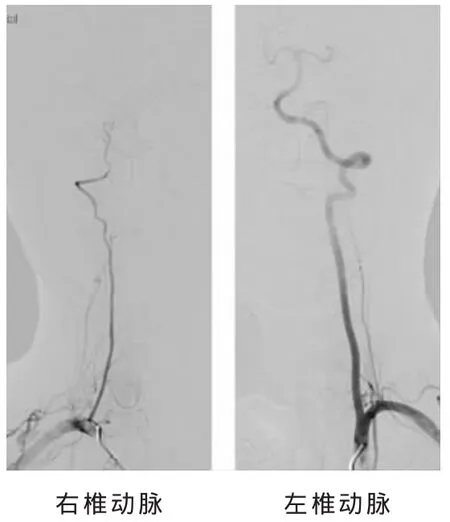
图3 右侧椎动脉发育不良

表1 两组病例一侧椎动脉优势情况
2 结果
2.1 椎动脉优势患者一般资料 椎动脉优势现象PCI组患者 63例(图 1,2),占 52.50%,其中左侧椎动脉优势占 69.84%,右侧占 30.16%;男 37例,女26例,年龄 21~80岁,平均(56.6±13.5)岁。对照组 30例,占 31.25%,其中左侧椎动脉优势占63.33%,右侧占 36.67%;男 22例,女 8例,年龄 39~77岁,平均(61.3±9.4)岁。椎动脉发育不良(图3)者 PCI组 11例,占9.17%,其中左侧发育不良者占 27.27%,右侧占 72.73%;男 6例,女 5例,年龄37~74岁,平均(57.0±9.7)岁。对照组 2例,均为男性左侧椎动脉发育不良患者,年龄分别为65、66岁。
2.2 两组病例椎动脉优势发生情况对比分析(表1)结果显示,PCI组有椎动脉优势的危险比对照组高2.432倍,而有一侧椎动脉优势的病例出现PCI的危险是没有该血管变异病例的1.462倍。进一步分析椎动脉发育不良现象亦呈现了相似的变化趋势:PCI组有椎动脉发育不良的危险比对照组高4.743倍,而有一侧椎动脉发育不良的病例出现 PCI的危险是没有该血管变异病例的 1.576倍。
3 讨论
椎动脉管径变化较大,绝大部分个体两侧椎动脉管径并不完全相同。尸体解剖及血管成像研究均显示,仅6%~26%的被研究对象两侧椎动脉管径大小一致,其余绝大部分患者两侧椎动脉粗细并不对称,其中约50%以上为左侧椎动脉管径较右侧大,这一现象常被称为椎动脉不对称(vertebral artery asymmetry),但只有当差异明显并达到一定标准时才能诊断为椎动脉优势[6,9,11]。本研究借助血管诊断和测量的“金标准”-DSA,并采用了目前较广为接受并相对更严格规范的椎动脉优势判断标准[8,10],结果显示,两组病例总体椎动脉优势出现率为43.06%,其中PCI组为52.50%,前循环对照组为31.25%,且均以左侧椎动脉优势现象多见,占60%以上,显示缺血性脑血管病患者中,椎动脉优势现象是较普遍存在的一种血管变异。
传统观点认为,椎动脉左右粗细不对称及椎动脉优势现象只是一种先天变异,并无多大的临床意义[6]。然而,近年来的一些研究显示,作为一种特殊类型的椎动脉优势现象,椎动脉发育不良本身并不是一种常见的先天性血管变异,在被检查人群中,左侧椎动脉发育不良约5.7%,右侧约8.8%[5,12],与我们的观察结果基本一致。但进一步对椎动脉发育不良的研究显示,在头颈持续过伸数分钟后,其椎基底动脉血流量常明显下降,且更易出现后循环缺血性改变,显示其本身即是后循环梗死的重要危险因素[13-14]。而对其它椎动脉优势现象的进一步研究也揭示,单侧椎动脉优势是基底动脉中、重度弯曲及延长扩张的单一独立的危险因素,推测椎基底动脉交接处的不对称血流模型可能是基底动脉弯曲及椎基底动脉汇合区附近梗死的重要原因[6,8],但对于其在 PCI 中的意义仍不明确。
为此,我们的研究进一步揭示,PCI组与前循环卒中对照组患者一侧椎动脉优势的出现率间存在明显的统计学差异;与前循环卒中患者相比,PCI组病例椎动脉优势现象出现率明显增高,且PCI组有椎动脉优势的机率比对照组高2.432倍(95%CI 1.388~4.261),而有一侧椎动脉优势的病例出现PCI的危险是没有该血管变异者的1.462 倍(95%CI 1.154~1.185)。进一步分析椎动脉发育不良现象亦呈现了相似的变化趋势:PCI组有椎动脉发育不良的危险比对照组高4.743倍(95%CI 1.025~21.942),而有一侧椎动脉发育不良的病例出现PCI的危险是没有该血管变异者的1.576 倍(95%CI 1.209~2.053)。显示椎动脉发育不良等椎动脉优势现象与PCI间存在明显关联,提示除了脑血管病常见的危险因素与致病机制外,椎动脉优势等血管变异在PCI发病中可能也有重要意义,值得高度重视。
由于本研究仅为被研究对象某一时点的横断面研究,并未探讨各组患者的纵向动态变化;同时,本研究并未同时探讨相关血流动力学与血管发生等方面的差别,因此,对椎动脉优势在PCI发病中的作用仍待进一步深入探讨。
[1] 中国后循环缺血专家共识组.中国后循环缺血的专家共识[J].中华内科杂志,2006,45(9):786-787.
[2] 苏镇培.评“缺血性卒中诊治三重奏——危险因素、病因和发病机制” [J].中国神经精神疾病杂志,2011,37(7):446-448.
[3]De Marchis GM,Kohler A,Renz N,et al.Posterior versus anterior circulation strokes: comparison of clinical,radiological and outcome characteristics[J].J Neurol Neurosurg Psychiatry,2011,82(1):33-37.
[4] 粟秀初,孔繁元,黄如训.有关眩晕诊断中的几个问题.中国神经精神疾病杂志,2010,36(12):705-707.
[5] 王力力,华杨.椎动脉发育不良影像学检查方法的研究进展[J].中华医学超声学杂志(电子版),2008,5(6):965-969.
[6]Cosar M,Yaman M,Eser O,et al.Basilar artery angulation and vertigo due to the hemodynamic effect of dominant vertebral artery[J].Med Hypotheses,2008,70(5):941-943.
[7] 中华神经科学会,中华神经外科学会.脑血管病分类及各类脑血管病诊断要点[J].中华神经科杂志,1996,29:376-380
[8]Hong JM,Chung CS,Bang OY,et al.Vertebral artery dominance contributes to basilar artery curvature and peri-vertebrobasilar junctional infarcts[J].J Neurol Neurosurg Psychiatry,2009,80(10):1087-1092.
[9] 侯红玲,闫福岭.椎动脉优势及其研究进展[J].现代医学,2010,38(4):438-440.
[10]Jeng JS,Yip PK.Evaluation of vertebral artery hypoplasia and asymmetry by color-coded duplex ultrasonography [J].Ultrasound Med Biol,2004,30(5):605-609.
[11]Eskander MS,Drew JM,Aubin ME,et al.Vertebral artery anatomy: a review of two hundred fifty magnetic resonance imaging scans[J].Spine (Phila Pa 1976),2010,35 (23):2035-2040.
[12]Peterson C,Phillips L,Linden A,et al.Vertebral artery hypoplasia: prevalence and reliability of identifying and grading its severity on magnetic resonance imaging scans[J].J Manipulative Physiol Ther,2010,33(3):207-211.
[13]Perren F,Poglia D,Landis T,et al.Vertebral artery hypoplasia: a predisposing factor for posterior circulation stroke[J].Neu rology,2007,68(1):65-67.
[14]Chen YY,Chao AC,Hsu HY,et al.Vertebral artery hypoplasia is associated with a decrease in net vertebral flow volume[J].Ultrasound Med Biol,2010,36(1):38-43.
