阿苯达唑及其代谢物在欧洲鳗鲡体内的药代动力学及残留研究
2012-09-17廖碧钗
廖碧钗
(1.福建省淡水水产研究所 福建福州 350002;2.福建省水产技术推广总站)
1 前言
阿苯达唑(albendazole,ABZ)是一种广谱抗寄生虫药,作用强、毒性小,对许多动物如羊、猪、家禽等的胃肠道线虫、绦虫等有很好的疗效[1-3],在水产养殖中主要用于鳗鲡蠕虫病的治疗[4,5]。ABZ进入体内以后,在肝微粒体药酶和还原型辅酶Ⅱ(NADPH)的作用下,转化成阿苯达唑亚砜(a1bendazole sulphoxide,ABZSO),是治疗囊虫病的有效成分,进而转化成砜(albendazole sulphone,ABZSO2)而失活,最终变成2-氨基砜排出体外[6]。ABZ及其代谢物在试验动物安全评价试验中表现出致畸和肝脏毒性[7],因此成为动物性食品兽药残留的重要监控对象。国内外对ABZ及其代谢物在人、羊等动物体内的代谢动力学已有研究[8,9],但在鳗鲡体内的药动及残留研究尚未见报道。本研究旨在了解ABZ及其代谢物在欧洲鳗鲡体内的分布及残留消除规律,为临床合理用药提供理论依据。
2 材料与方法
2.1 材料
2.1.1 实验动物
健康欧洲鳗鲡(Anguilla anguilla),购自龙岩三华养鳗场,平均体重(100±10)g,试验前3 d停止喂食,水温控制(25±2)℃;经抽查试验用欧洲鳗鲡组织中均不含ABZ及其代谢物。
2.1.2 药品及试剂
ABZ标准品(含量99%),购于德国DR.Ehrenstorfer公司;ABZSO标准品(含量99%)和ABZSO2标准品(含量98.5%),购于德国Witega公司;ABZ原料药(含量89%),购于陕西汉江制药有限公司;乙腈、甲醇为色谱纯,其他试剂均为分析纯。
ABZ母液:准确称取ABZ原料药2 g,置于100 mL容量瓶中,加10 mL冰乙酸溶解,甲醇稀释至刻度,摇匀,即得浓度为20 g/L的ABZ母液,4℃保存备用。
ABZ及其代谢物标准贮备液:分别准确称取ABZ、ABZSO和 ABZSO2标准品 10 mg,分别置于100 mL容量瓶中,用少许冰乙酸助溶,甲醇稀释至刻度,摇匀,即得浓度为100 mg/L的ABZ及其代谢物标准贮备液,4℃保存备用。
2.1.3 仪器
Agilent 1100高效液相色谱仪;XW-80A微型旋涡混合仪;飞鸽DL-5C离心机。
2.2 方法
2.2.1 色谱条件
色谱柱为SB-C18(4.6×150 mm,5 μm);流动相为乙腈:1%醋酸溶液,梯度洗脱程序见表1;检测波长为294 nm;进样量50μL;柱温25℃。

表1 梯度洗脱程序
2.2.2 给药方法及采样
试验用欧洲鳗鲡约300尾,随机等量分装至水族箱进行试验,每箱放曝气24 h以上的自来水150 L。给药时在每箱中各加15 mL ABZ母液,使水体终浓度为2 mg/L,浸浴36 h后彻底换水。给药后0.5、1、1.5、2、3、5、7、12、24、36、48、72、144、216、288、432、720、1440 和 2160 h 分别采集鱼样 10 尾,采血后用无污染的小刀割取背脊两侧肌肉,并迅速将皮剥离,依次放入标记好的样品袋中,每2尾为1组;样品置-20℃冷冻贮存,备用。
2.2.3 样品前处理
2.2.3.1 血浆样品的提取
取1.0 mL血浆,加1 mLNa2CO3溶液(2 mol/L)和6 mL二氯甲烷旋涡混合15 min,5000 r/min离心10 min,取上清液,置40℃水浴中氮气流吹干。用1.0 mL 45%乙腈水溶液溶解残留物,过0.45μm滤膜,定容至1.0 mL,HPLC 测定。
2.2.3.2 肌肉样品的提取
取2.0 g匀浆肌肉组织,加2 mL Na2CO3溶液(2 mol/L)和12 mL二氯甲烷旋涡混合15 min,5000 r/min离心10 min。取上清液,置40℃水浴中氮气流吹干。用2.0 mL 45%乙腈水溶液溶解残留物,旋涡混合2 min,超声波提取5 min。加入乙腈水饱和正己烷6 mL,旋涡混合1 min,5000 r/min离心2 min。弃去正己烷层,下层液经0.45μm微孔滤膜过滤,定容至1.0 mL,HPLC 测定。
2.2.4 标准曲线制备
于1.0 mL血浆和2.0 g匀浆肌肉样品中加入不同体积ABZ及其代谢物标准贮备液,制成含标准品浓度为 0.01、0.05、0.10、0.5、1.0、5.0 和 10.0 mg/L(kg)的样品溶液,按2.2.3的方法对样品处理后测定其峰面积,求出血浆和肌肉的标准工作曲线回归方程和相关系数。
2.2.5 回收率和精密度测定
取血浆和匀浆肌肉组织,加入ABZ及其代谢物标准贮备液适量,制成0.05、0.5 和 5.0 mg/L(kg)3个浓度的样品溶液。按2.2.3的方法处理,取50 μL进行HPLC测定,每个浓度重复测定5次,记录峰面积,计算其回收率。
将上述样品每个浓度日内测定5次,日间测5次,计算样品中药物浓度的日内、日间变异系数。
2.2.6 数据处理
采用PKS药代动力学软件进行模型拟合和参数计算;消除方程、休药期计算采用SPSS统计软件计算。
2.2.7 休药期计算
ABZ及其代谢物是按一级动力学过程从体内消除,即在消除后期服从指数消除:C=C0e-ket,根据消除后期测定的组织药物浓度及规定的最高残留限量(MRL),计算各组织药物浓度降至规定水平所需的时间(WDT):

3 结果与分析
3.1 色谱行为及标准曲线
在2.2.1色谱条件下,各物质分离完全,峰形对称,保留时间稳定(图1)。在0.01-10 mg/L(kg)线性范围内,血浆和肌肉中ABZ及其代谢物的添加标准曲线见表2,其线性关系良好。

图1 ABZ及其代谢物在欧洲鳗鲡体内的色谱图

表2 ABZ及其代谢物在欧洲鳗鲡血浆和肌肉中的线性回归方程及相关系数
3.2 回收率和精密度
以信噪比(S/N)为3计算,本方法测定ABZ及其代谢物的最低检测限均为3μg/L,回收率均达74%以上,平均变异系数均低于6.71%,说明该方法回收率高、重复性好,详见表3。
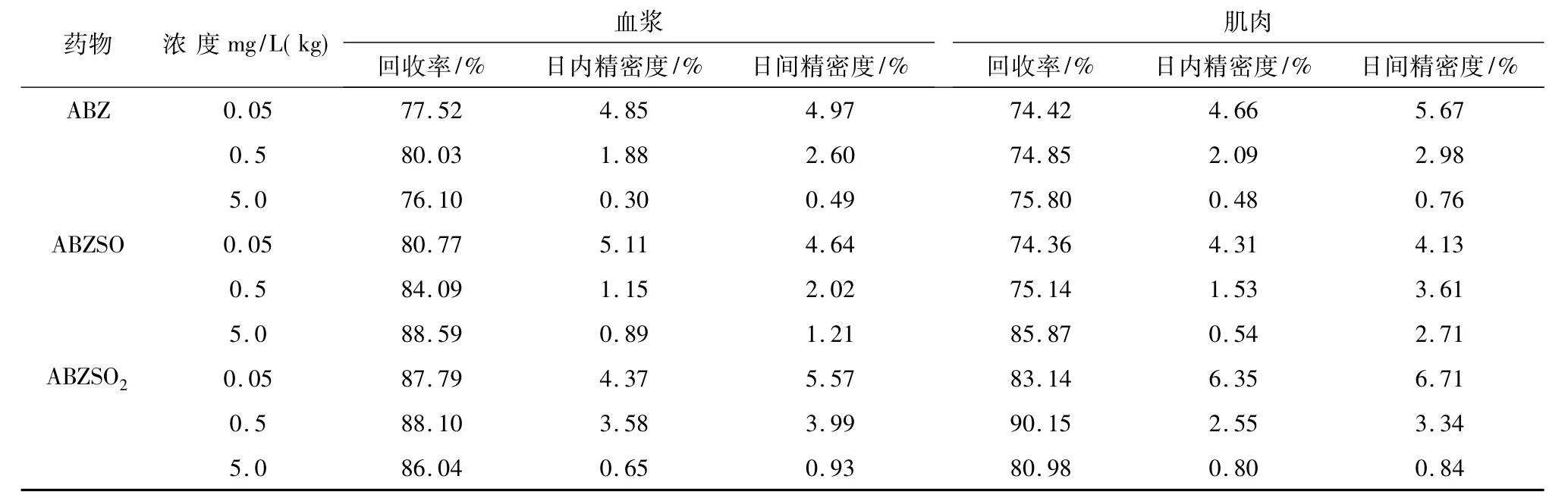
表3 欧洲鳗鲡血浆和肌肉中ABZ及其代谢物的回收率和精密度
3.3 药代动力学
欧洲鳗鲡以2 mg/kg的剂量浸浴ABZ 36h后,ABZ的血药浓度在12 h达到最高值3.623 mg/L,144 h后不能检出;ABZSO的血药浓度在24 h达到最高值7.423 mg/L,1440 h后不能检出;ABZSO2的血药浓度在36 h达到最高值1.829 mg/L,432 h后不能检出。药物在血浆中的主要动力学参数如表4所示,经房室模型分析,ABZ和ABZSO的血药浓度时间数据符合一级吸收二室开放模型,ABZSO2的血药浓度时间数据符合一级吸收一室开放模型,其药 动 学 方 程 分 别 为:C = - 16.185e-0.160t+14.756e-0.098t+1.429e-0.020t、C= - 8.371e-0.184t+7.797e-0.009t+0.574e-0.007t和 C=7.925(e-0.015t-e-0.027t),平均药时曲线见图 2。

表4 ABZ及其代谢物在欧洲鳗鲡血浆中的主要药动学参数

图2 ABZ及其代谢物在欧洲鳗鲡血浆中的药时曲线
3.4 药物消除规律
欧洲鳗鲡浸浴ABZ 12 h后,数据经SPSS统计处理得到血浆和肌肉组织中药物浓度(C)与时间(t)关系的消除曲线方程、相关指数(R2)及消除半衰期(T1/2)见表5,可知药物在血浆和肌肉中消除较缓慢。
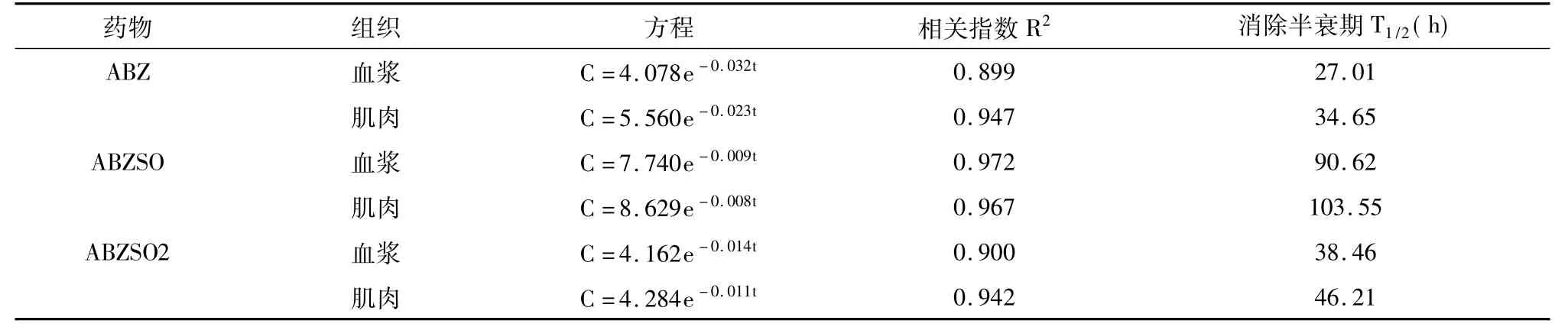
表5 ABZ及其代谢物在欧洲鳗鲡血浆和肌肉组织中的消除曲线方程及参数
3.5 休药期
我国1999年发布的235号公告《动物性食品中兽药最高残留限量》中规定动物肌肉中ABZ的总残留量为100μg/kg,通过休药期公式计算可知肌肉组织中ABZ、ABZSO和ABZSO2的理论休药期分别为 7.34d、22.65d 和 13.98d。因此在本试验条件下,建议ABZ在欧洲鳗鲡体内的休药期为23d。
4 讨论
本试验比较了不同缓冲液和提取剂对血浆和肌肉中ABZ及其代谢物的回收率。在本试验条件下用磷酸盐缓冲液(pH7.4)和其他提取剂提取ABZ及其代谢物,ABZSO和ABZSO2的回收率都能达到80%左右,而ABZ的回收率很低(仅15%左右);当用Na2CO3溶液(2 mol/L)和其他提取剂提取时,ABZ及其代谢物的回收率均能达到70%以上;而用Na2CO3溶液(2 mol/L)和二氯甲烷作为提取剂,其回收率相对较高。说明在本试验条件下,ABZ更易在碱性较高的溶液中溶于二氯甲烷。
研究表明,ABZ在动物体内仅作为“前体性药物”,其原型药作用很小,主要作用是由它在机体内的代谢产物ABZSO来完成。ABZSO是ABZ发挥作用的活性物质[10,11],2 - 氨基砜是 ABZ 的最终代谢物,无驱虫活性,仅在动物的尿中可发现[12]。因此本方法未将2-氨基砜列入残留检测对象。Averkin等比较了ABZ及ABZSO、ABZSO2代谢物的驱蠕虫活性,发现在鼠体内ABZSO比ABZ的驱虫活性要强,而ABZSO2几乎无驱虫作用[13]。本试验结果表明,浸浴给药后,ABZ在欧洲鳗鲡血浆中仅以少量存在,它在鳗鲡体内迅速、广泛地被代谢为ABZSO及少量的ABZSO2,这与其在人体与其他动物体内的检测结果相一致[14-18]。从药动学参数来看,浸浴ABZ后,ABZSO在血浆中的吸收速率常数较大,消除速率常数较小,AUC值大,说明ABZSO在鳗鲡体内能迅速吸收且消除缓慢,能发挥较好的驱虫作用。
农业部235号公告中限量规定的是ABZ及其代谢物的总残留量,在本试验条件下,ABZ和ABZSO2分别在给药后144h和432h就不能检出,因此,以ABZSO残留量代表总量作为该药在鳗鲡体内的休药期。但是,鱼体内的药物消除受许多因素影响,所以临床休药期要根据具体鱼种、实际养殖环境分别进行研究确定。
[1] 李春花,刘生财,蔡进忠.阿苯达唑干混悬剂对绵羊裸头科绦虫的驱除试验[J].中国兽医杂志,2007,43(8):43 -44.
[2] 陈闯,唐中玖,张德洪,等.复方阿苯达唑对离体猪蛔虫的作用观察[J].实用寄生虫病杂志,1995,3(1):46.
[3] 周振新,严明,陈洪,等.阿苯达唑散驱鸡线虫的临床试验[J].中国兽药杂志,2002,36(11):35 -36.
[4] 农业部《新编渔药手册》编撰委员会.新编渔药手册[M].北京:中国农业出版社,2005:481-485.
[5] 黄珏,时勇.鳗用阿苯达唑制剂的研制及临床试验[J].中国兽药杂志,2003,37(8):46 -48.
[6] Bogan J A,Marriner SE.Pharmacokinetics of albendazole,fenbendazole and oxfendazole[C].Weatport:AⅥ Publ Co1983:235-240.
[7] 王大菊,周诗其,邱银生,等.国产氧阿苯达唑对绵羊安全性试验[J].中国兽医科技,2002,32(2):43 -44.
[8] 关天颖,宫相义,孙伟之,等.阿苯达唑及其代谢物在人体内的药物动力学[J].中国药理学报,1990,11(1):69 -72.
[9] Goudah A.Aspects of the pharmacokinetics of albendazole sulphoxide in sheep[J].Veterinary Research Communications,2003,27:555-566.
[10] Morris D L,Dykes PW,Dickson B,et a1.Albendazole in hydatid disease[J].Brit Med J,1983,268(6369):103 - 107.
[11] Saimot A G,Meulemans A,Cremieux A C,et a1.Albendazole as a potential treatment for human hydatidosis[J].Lancet,1983,2(8351):652-656.
[12] Gyurik RJ,Chow A W,Zaber B,et al.Metabolism of albendazole in cattle,sheep,rats and mice[J].Drug Metab Dispos,l981,9:503-508.
[13] Averkin E A,Beard C C,Dvorak C A,et al.Methyl 5(6) - phenylsulfinyl-2 - benzimidazole carbamate,a new potent anthelmintic[J].JMed Chem,l975,18(ll):1164 - 1166.
[14] Marriner S E,Morris D L.Pharmacokinetics of albendazole in man[J].Eur JClin Pharmacol,1986,30:705.
[15] Narriner S E,Bogan J A.Pharmacokinetics of albendazole in sheep[J].Am JVet Res,1980,41(7):11 -26.
[16] Marriner SE,Began J A,Vandaele W.Comparison of the pharmacokinetics of albendazole and its major metabolites after oral administration of albendazole as a suspension and as a paste formulation to sheep[J].Zbl Vet Med,1981,28:l9.
[17] Fetterer R,Rew R S,Knight R.Comparative efficacy of albendazole against fasciola hepatica in sheep and calves:relationship to serum drug metabolite levels[J].Vet Parasito1,1982,11:309.
[18] 邱银生,李涛.丙硫苯咪唑在兔组织内的代谢动力学[J].东北农学院学报,1993,24(1):48-53.
