西红花酸体内外抗氧化作用的研究
2012-09-17石磊
石 磊
(安徽省金寨县中医院药剂科,安徽 六安 237300)
氧化应激是指机体活性氧(ROS)产生增加或清除减少,从而导致体内氧化还原自稳态失衡,ROS在体内大量蓄积而引起机体氧化损伤的过程。现代研究表明,ROS参与多种疾病的形成与发展,其中它所介导的低密度脂蛋白(LDL)氧化修饰是动脉粥样硬化(AS)发生、发展的关键环节[1]。氧化应激学说的提出为应用抗氧化剂防治AS提供了理论依据。番红花为鸢尾科植物番红花(Crocus sativus L.)的干燥柱头,在欧洲许多国家被广泛用作调味品和食品着色剂,有“香料之王”之美誉。现代研究表明,番红花具有抗氧化、抗凝血、抗肿瘤及免疫调节等多种药理作用,具有重要的临床应用价值。西红花酸为番红花中主要活性成分之一,具有明显的抗AS作用[2],本研究主要从体内外两方面探讨西红花酸的抗氧化作用,以期阐明其抗AS作用机制,为临床使用西红花酸防治AS提供依据。
1 材料与方法
1.1 材料
Wistar大鼠,雌雄各半,体质量180~220g,由南京青龙山动物养殖场提供;西红花酸,由本实验室制备(含量>80%);总抗氧化能力(TAC)、超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)、丙二醛(MDA)及抗超氧阴离子(O2-)测定试剂盒由南京建成生物工程研究所提供;其他试剂均为分析纯。752紫外分光光度计,上海第三分析仪器厂;酶联免疫检测仪,Bio-Rad。
1.2 方法
1.2.1 超氧阴离子(O2-)清除能力测定利用次黄嘌呤/黄嘌呤氧化酶反应体系产生O2-,观察西红花酸对的清除作用。实验设对照组、维生素C组及西红花酸组(5、10、20μmol/L)。实验操作按试剂盒说明书进行。
1.2.2 LDL氧化易感性测定
取健康人静脉血,EDTA抗凝,分离血浆,超速离心法分离LDL,并于4℃在10 mmol/L PBS(pH 7.4)中透析24h,考马斯亮蓝法测定LDL中蛋白含量,并调整浓度至1mg/mL。实验设Control组、Model组(LDL+Cu2+)、西红花酸组(LDL+Cu2++西红花酸),每组6个样本。于96孔培养板中分别加入LDL和PBS(终反应体积0.2mL,LDL终浓度为100μg/mL),混匀。西红花酸组加入不同浓度西红花酸溶液(终浓度分别为5、10、20μmol/L),Control组和Model组均加入等量PBS,混匀,37℃孵育1h。除Control组加入PBS外,其余各组均加入CuSO4溶液(终浓度5μmol/L),37℃孵育3h,每10 min测定一次234 nm处吸光度(A234),参照文献方法[3]计算LDL氧化延迟时间(Lag time)和达最大氧化速率时间(Tmax)。将上述反应体系继续孵育至12h,加入EDTA-Na2终止反应,TBA比色法测定反应液中MDA含量。
1.2.3 大鼠血清抗氧化能力测定
Wistar大鼠18只,随机分为3组,即对照组和西红花酸组(50mg/kg及25mg/kg),每组6只,自由进食、饮水。西红花酸组每天灌胃给予相应浓度西红花酸,对照组给予等容量生理盐水,连续7d。末次给药后2h,眼眶取血,分离血清。血清TAC采用Fe3+还原法测定,血清SOD、GPX活性分别采用黄嘌呤氧化酶法和二硫代二硝基苯甲酸(DTNB)比色法测定,操作按试剂盒说明书进行。另取血清0.2mL,加入50μmol/L CuSO4溶液0.2mL,混匀后于37℃孵育5 h,TBA比色法测定MDA含量。

表1 Inhibitory effect of crocetin on LDL oxidation induced by cupric ions (χ— ±s,n=6)

表2 Effect of crocetin on the susceptibility of rat serum to in vitro oxidation (χ— ±s,n=6)
1.2.4 统计学处理
2 结 果
2.1 西红花酸对O2-的清除作用
西红花酸呈浓度依赖性地减少次黄嘌呤/黄嘌呤氧化酶反应体系产生的,5、10和20μmol/L西红花酸对的清除率分别为23.59±5.49%、36.50±4.36%和53.40±7.62%。见图1。
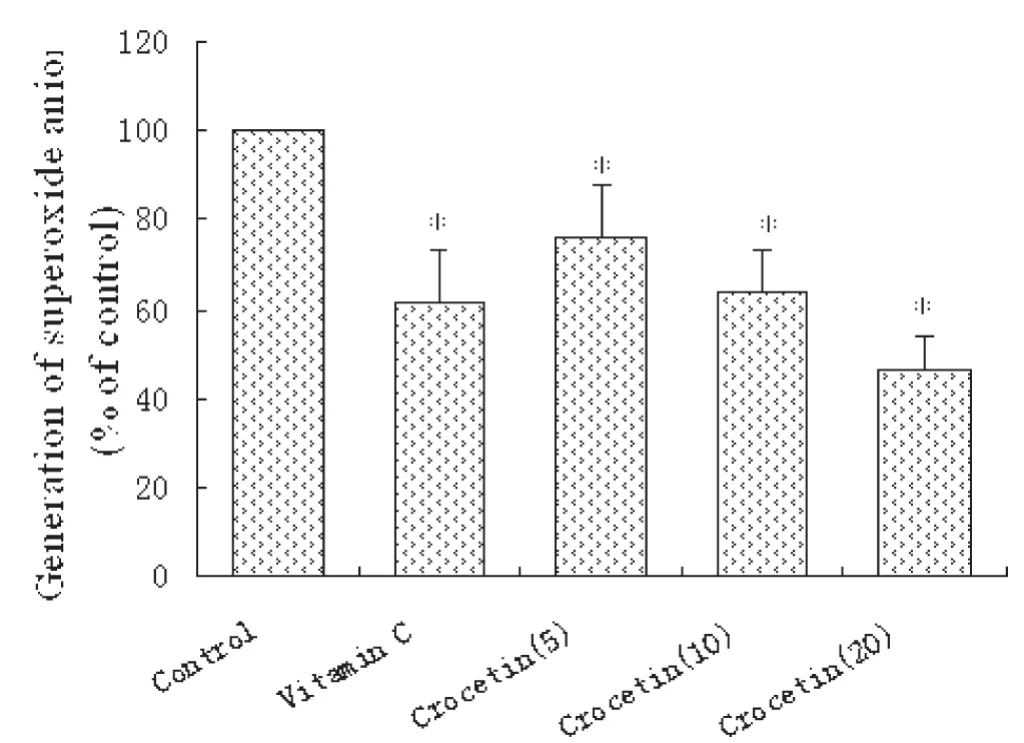
图1 Scavenging effect of crocetin on superoxide anion ()generated by hypoxanthine/xanthine oxidase system (χ— ±s,n=6)..*P <0.01 versus Control.
2.2 西红花酸对LDL氧化易感性的影响
Lag time和Tmax是衡量LDL氧化易感性的两个重要指标。由表1可见,西红花酸能显著增加LDL氧化的Lag time和Tmax,这一结果与其减少铜离子诱导的MDA生成作用相一致,提示西红花酸能明显提高LDL抗氧化能力。
2.3 西红花酸对大鼠血清抗氧化能力的影响
由表2可见,大鼠在给予西红花酸7 d后,血清TAC及SOD、GPX活性均显著升高(P<0.05或P<0.01)。正常情况下,大鼠血清MDA含量较低,补充西红花酸50 mg/kg和25 mg/kg虽有降低血清MDA趋势,但各组间并无明显差异(data not shown);在加入铜离子氧化5 h后,对照组血清MDA含量显著增加,而在补充西红花酸的大鼠,其血清MDA含量明显低于对照组(P<0.05或P<0.01),提示西红花酸能显著提高大鼠血清抗氧化能力。
3 讨 论
ROS是生物体在需氧代谢或巨噬细胞呼吸爆发中产生的活性基团或分子,具有高度氧化活性,极易攻击生物膜中脂质及核酸、蛋白质等生物大分子,引起机体氧化损伤。现代研究表明,ROS参与多种疾病的病理进程,其中ROS介导的LDL氧化修饰,是AS形成与发展的关键环节。临床资料显示,AS患者血清及LDL抗氧化能力较正常人显著降低,血浆Ox-LDL水平明显升高且与AS病变程度密切相关[4,5]。抗氧化剂如维生素E、维生素C及β-胡萝卜素等的摄入量与AS性心血管病发病率呈负相关,补充多酚类、类胡萝卜素类等天然抗氧化剂能明显提高机体及LDL抗氧化能力,降低心血管疾病死亡率[6,7]。这些结果提示,补充抗氧化剂、增强机体及LDL抗氧化能力可能是防治AS及其相关性心脑血管疾病有效途径之一。
西红花酸为天然类胡萝卜素类化合物,能明显抑制AS形成与发展,但对其抗AS作用机制至今仍未完全阐明。本研究显示,西红花酸能有效清除次黄嘌呤/黄嘌呤氧化酶反应体系产生的O2-,降低LDL氧化易感性,显示了良好的体外抗氧化活性。药动学研究表明,大鼠灌胃给予西红花酸50mg/kg,40 min后血药浓度即达峰值,10μmol/L以上血药浓度可维持100min以上[8],这一浓度与本研究所用浓度接近,提示西红花酸在体内也能达到有效血药浓度,发挥清除ROS、抑制LDL氧化等作用。为了证实上述推测,本研究观察了西红花酸对大鼠抗氧化能力的影响。结果显示,西红花酸能明显提高大鼠血清TAC,后者是衡量机体抗氧化能力的重要指标。由于血清中脂质过氧化物主要存在于LDL等脂蛋白中,血清抗氧化能力与LDL氧化易感性密切相关,因此检测血清抗氧化能力可间接反映LDL氧化易感性。在本研究中,虽然补充西红花酸对大鼠血清脂质过氧化物MDA含量无明显影响,但却能显著增强血清抵抗铜离子诱导的氧化作用,提示西红花酸能有效提高血清抗氧化能力、降低LDL氧化易感性,这一作用与西红花酸提高AS家兔血清及LDL抗氧化能力、降低血清Ox-LDL水平相一致[2],提示西红花酸可能通过提高机体抗氧化能力、减少LDL氧化修饰而发挥抗AS作用。
机体抗氧化防御体系主要包括SOD、GPX等抗氧化酶及维生素C、维生素E、β-胡萝卜素等ROS清除剂,提高这些酶的活性或增加抗氧化剂的摄入均可明显提高血清TAC,降低LDL氧化易感性及血清Ox-LDL水平,从而发挥抗AS作用[9]。本研究发现,西红花酸能明显提高大鼠血清SOD、GPX等抗氧化酶活性,这可能是西红花酸提高大鼠血清TAC的主要机制之一。此外,作为脂溶性类胡萝卜素类化合物,西红花酸可通过多种方式对ROS发挥直接清除作用。有研究表明,类胡萝卜素类化合物玉米黄质和β-胡萝卜素等可直接掺入细胞膜脂质双层或LDL等脂蛋白之中,当细胞或LDL等受到ROS攻击时,类胡萝卜素类首先被氧化,从而保护细胞或LDL等免受氧化损伤[10]。由于西红花酸也具有类似的化学结构,推测其也可能掺入细胞膜或LDL等脂蛋白之中而发挥抗氧化作用。
综上所述,西红花酸既能直接清除ROS,又能提高血清SOD、GPX等抗氧化酶活性,从而提高机体抗氧化能力,降低LDL氧化易感性,这可能是西红花酸抗AS作用主要机制之一,至于西红花酸提高SOD等抗氧化酶活性的确切机制仍有待于进一步研究。
[1]Heinecke JW.Oxidants and antioxidants in the pathogenesis of atheroslcerosis: implications for the oxidized low density lipoprotein hypothesis[J].Atherosclerosis,1998,141(1):11-15.
[2]Zheng SG,Qian ZY,Sheng L,et al.Crocetin attenuates atherosclerosis in hyperlipidemic rabbits through inhibition of LDL oxidation[J].J Cardiovasc Pharmacol,2006,47(1):70-76.
[3]Kleinveld HA,Hak-Lemmers HLM,Stalenhoef AFH,et al.Improved measurement of low-density-lipoprotein susceptibility to copperinduced oxidation: application of a short procedure for isolating low-density lipoprotein[J].Clin Chem,1992,38(10):2066–2072.
[4]Nishi K,Itabe H,Uno M,et al.Oxidized LDL in carotid plaques and plasma associates with plaque instability[J].Arterioscler Thromb Vasc Biol,2002,22(10):1649-1654.
[5]Ehara S,Ueda M,Naruko T,et al.Elevated levels of oxidized low density lipoprotein show a positive relationship with the severity of acute coronary syndromes[J].Circulation,2001,103(5):1955-1960.
[6]Rimm EB,Stampfer MJ.Antioxidants for vascular disease[J].Med Clin North Am,2000,84(3):239-249.
[7]Yang CS,Lambert JD,Sang S.Antioxidative and anti-carcinogenic activities of tea polyphenols[J].Arch Toxicol,2009,83(1):11-21.
[8]刘同征,钱之玉.西红花酸在大鼠的药代动力学研究[J].药学学报,2002,37(5):367-369.
[9]Yang H,Zhou L,Wang Z,et al.Overexpression of antioxidant enzymes in ApoE-deficient mice suppresses Benzo(a)pyreneaccelerated atherosclerosis[J].Atherosclerosis,2009(Epub ahead of print).
[10]Young AJ,Lowe GM.Antioxidant and prooxidant properties of carotenoids[J].Arch Biochem Biophys,2001,385(1):20-27.
