电刺激引起C2C12肌管IL-6蛋白及IL-6、GLUT4基因表达的变化
2012-09-16邱国荣徐晓阳谢敏豪
邱国荣徐晓阳谢敏豪
1 重庆文理学院体育学院(重庆永川 402160)
2 华南师范大学体育科学学院
3北京体育大学运动人体科学学院
电刺激引起C2C12肌管IL-6蛋白及IL-6、GLUT4基因表达的变化
邱国荣1徐晓阳2谢敏豪3
1 重庆文理学院体育学院(重庆永川 402160)
2 华南师范大学体育科学学院
3北京体育大学运动人体科学学院
目的:研究骨骼肌细胞在不同时间的电刺激下产生的GLUT4基因与肌源性IL-6蛋白含量及其基因表达之间的关系。方法:以小鼠骨骼肌肌母细胞(C2C12)为研究对象,分为电刺激组和对照组。分别测定当刺激时间为45 min、60 min、75 min、90 min及120 min时C2C12肌管内糖原含量、GLUT4和IL-6mRNA表达以及C2C12肌管上清液IL-6含量。结果:(1)电刺激各组GLUT4mRNA表达均有所增加,其中60min、75min和120min组显著高于对照组(P<0.05);电刺激75min和120min组IL-6 mRNA表达显著高于对照组 (P<0.05);电刺激各组上清液IL-6含量均显著高于对照组 (P< 0.05)。(2)随电刺激时间增加,上述各项指标均先增加,后下降,90min时达低谷。(3)随电刺激时间延长,C2C12肌管糖原含量逐渐减少,其中,刺激120分钟组糖原含量与对照组相比显著减少 (P< 0.05)。结论:(1)电刺激C2C12肌管对细胞糖代谢产生了一定影响;(2)电刺激C2C12肌管引起的GLUT4mRNA表达的增加很可能与肌管收缩产生的IL-6有关。
C2C12肌管;电刺激;IL-6蛋白含量;GLUT4基因表达;IL-6基因表达
在近期研究中,骨骼肌被认为是一个内分泌器官,分泌和表达许多种细胞因子。其中,最先被发现、也是在运动中被研究最多的细胞因子是白介素6(IL-6)[1]。先前研究发现,肌源性IL-6在新陈代谢中起着重要作用,运动中其与葡萄糖代谢关系密切[2]。葡萄糖转运载体(Glucose transporters,GLUT)是葡萄糖进入细胞的介导物质,其中GLUT4介导的葡萄糖转运是骨骼肌中糖代谢的主要限速步骤,在葡萄糖代谢中起着重要作用。目前,关于运动中肌源性IL-6在葡萄糖代谢中所起的具体作用尚无定论。
电刺激是生理学常用的实验方法,前人研究发现,利用电刺激方法可迅速改变C2C12细胞的基因表达[3],增加活性氧分泌[4],并引起参与线粒体生物合成的一些蛋白的表达[5],这些与骨骼肌运动早期的适应性反应一致。本实验以分化的C2C12肌管为研究对象,通过低频电刺激模拟运动时神经冲动,观察在离体状态下细胞肌源性IL-6与GLUT4基因在电刺激下的变化规律,研究肌源性IL-6与葡萄糖代谢之间的关系,为运动训练实践提供参考。
1 材料与方法
1.1 C2C12细胞培养
小鼠骨骼肌肌母细胞系C2C12细胞购自南方医科大学解剖学教研室,保存于液氮。复苏后培养在含有10%胎牛血清(Hyclone公司)的DMEM高糖培养基(Hyclone公司)中,置于37℃、5%CO2、饱和湿度的CO2培养箱(FormaScientific,美国)中。当细胞生长至汇合度为70~80%时,将所有细胞用0.25%胰蛋白酶(Hyclone公司)消化后,以2×105/ml传入3.5 cm培养皿中。大约培养2天后,细胞长满皿底,将DMEM高糖培养基换为含有2%马血清的分化培养基,隔天换液1次,分化5天后进行实验。本实验在华南师范大学体育科学学院实验室完成。
1.2 实验分组和电刺激方式
将培养细胞分为实验组和对照组。实验组根据电刺激时间分为30、45、60、75、90、120min组,用TYC型电刺激器(成都仪器厂)电刺激分化5天的肌管,强度为45V、20ms,5 Hz。对照组不刺激。
1.3 C2C12肌管糖原含量测定
采用蒽酮法,利用肌糖原/肝糖原测定试剂盒(南京建成生物工程研究所提供)测定C2C12肌管糖原含量。电刺激后,收集细胞,将加碱液的细胞悬液收集入玻璃试管,放入100℃水浴锅中煮20 min,后流水冷却。按照试剂盒说明书配制显色液。先用1 mg/ml葡萄糖原液做标准曲线,再将水煮过的糖原取50μl,加入1ml显色液,混匀后置沸水中煮5min,冷却后置于Model 550型酶标仪(日本BIO-RAD公司),570 nm波长、空白孔调零,测各管OD值。
1.4 IL-6mRNA和GLUT4mRNA表达测定
使用反转录PCR方法检测细胞IL-6 mRNA和GLUT4mRNA。电刺激细胞后即刻,在冰面用RNAiso Plus总RNA提取试剂(TaKaRa公司)抽提细胞总RNA,提取方法严格按照说明书进行。用紫外分光光度计测RNA在A260/A280的吸光度值,计算RNA纯度和含量,用反转录体系(Promega公司)反转录为cDNA。
IL-6 mRNA和GLUT4mRNA引物由北京赛百盛基因技术有限公司合成。IL-6mRNA序列[6]为上游引物5’-TCC AGCCAG TTG CCTTCTTGG-3’,下游引物5’-TCTGACAGTGCA TCA TCG CTG-3’。退火温度:50℃,35个循环。GLUT4mRNA序列[7]为上游引物5’-GATGCCGTCGGG TTTCCA GCA-3’,下游引物5’-TGA GGG TGCCTTGTGGGA TGG-3’。退火温度:63℃,33个循环。以β-actin cDNA引物序列作为内参照,其序列为上游引物5’-CGTGAA AAG ATG ACC CAG ATC A-3’,下游引物5’-CAC AGC CTG GATGGC TACGT-3’。退火温度:56℃,34个循环。
PCR产物在1.5%琼脂糖凝胶电泳,分析扩增结果,用紫外数字成像系统(美国genus公司)扫描定性,并用SYNGENE成像系统照相保存。用条带分析软件bandscan5.0对电泳条带进行分析,计算每个PCR扩增产物的亮度,计算每样品的目的基因和参照基因β-actin的亮度比值。
1.5 C2C12肌管上清液IL-6浓度测定
采用小鼠IL-6酶联免疫分析试剂盒 (武汉中美科技公司提供),在一次性电刺激后使用酶联免疫吸附方法(ELISA)测定C2C12肌管上清液IL-6含量。刺激后即刻收集细胞悬液,1000 g离心20 min,取细胞上清液进行检测。严格按照说明书操作。
1.6 统计学分析
采用统计分析软件SPSS13.0对实验数据进行统计分析,数据以均值±标准差表示,组间比较进行单因素方差分析,P<0.05为有显著性差异,P<0.01为有极显著性差异。
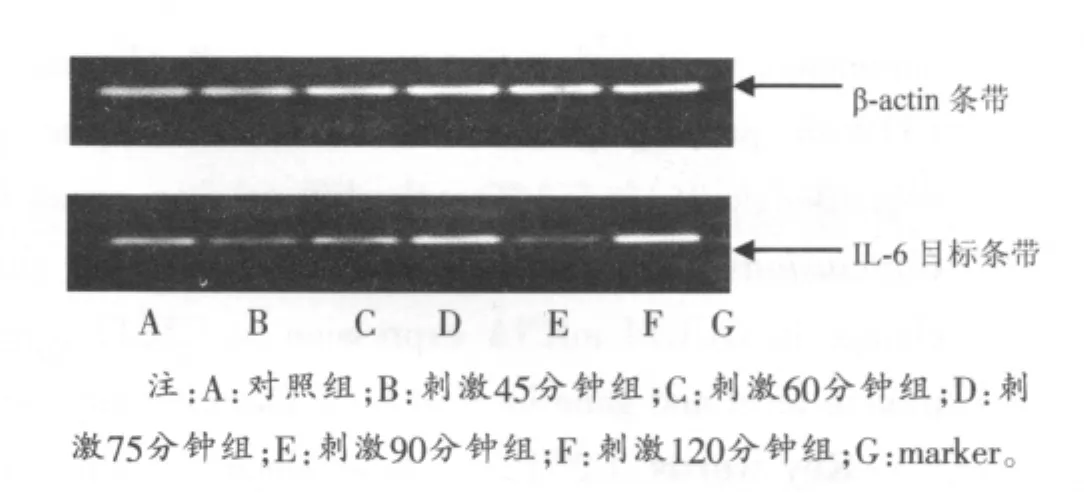
图1 电刺激引起IL-6mRNA表达电泳图
2 结果
2.1 肌管糖原
由表1可知:随电刺激时间延长,C2C12肌管糖原含量逐渐减少,其中,刺激120分钟组糖原含量与对照组相比显著减少(P<0.05)。
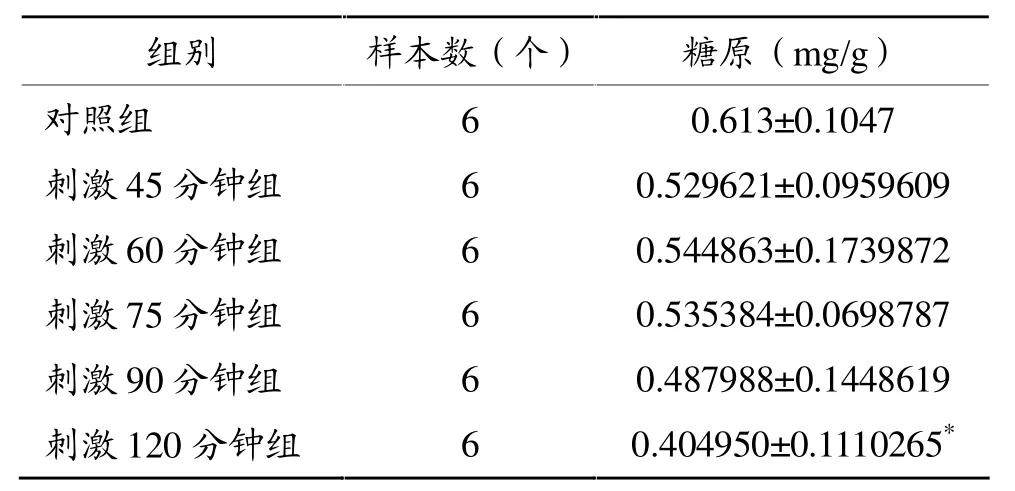
表1 电刺激引起C2C12肌管糖原变化
2.2 肌管IL-6mRNA表达
RT-PCR结果(图1和表2)显示,随电刺激时间延长,C2C12肌管IL-6mRNA表达增加,其中刺激75分钟组和120分钟组与对照组相比均显著增加 (P<0.05),两组与刺激90分钟组相比均显著升高(P<0.01)。
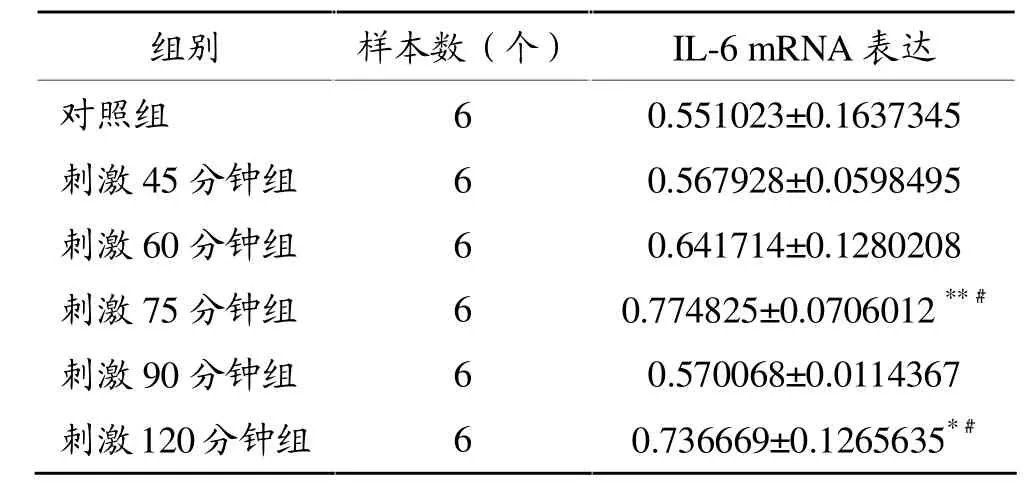
表2 电刺激引起C2C12肌管IL-6mRNA表达变化
2.3 肌管GLUT4mRNA表达
RT-PCR结果(图2和表3)显示:随电刺激时间延长,C2C12肌管GLUT4 mRNA表达增加,刺激60分钟组、75分钟组和120分钟组GLUT4 mRNA表达与对照组相比明显升高(P<0.05,P<0.01)。
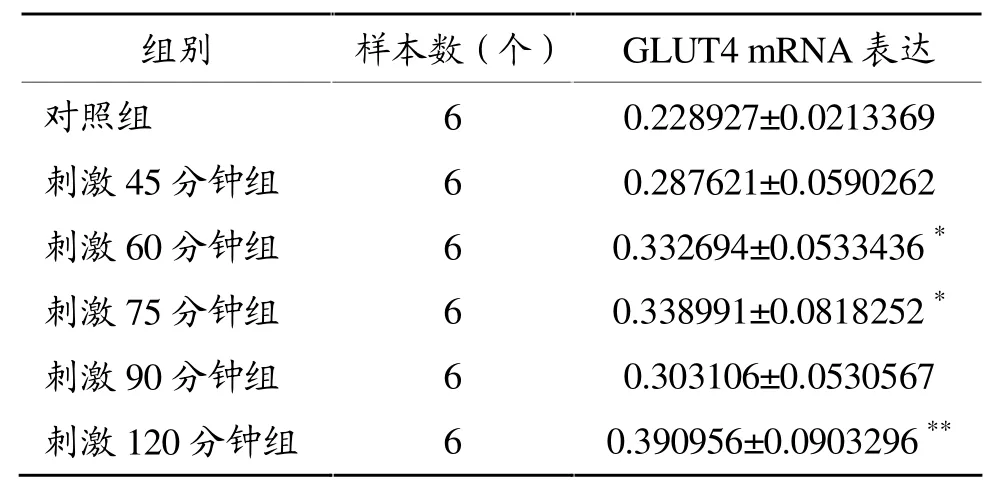
表3 电刺激引起C2C12肌管GLUT4m RNA表达变化
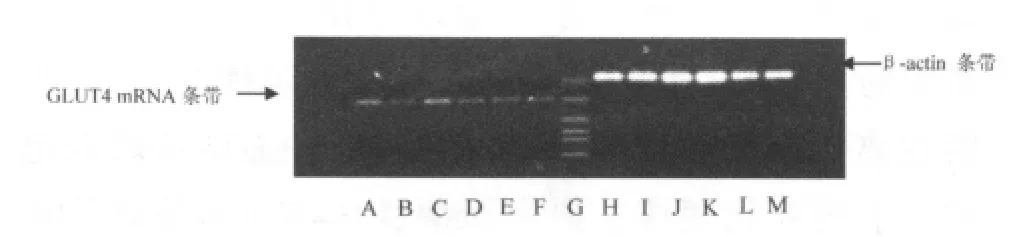
图2 电刺激引起GLUT4m RNA表达电泳图
2.4 肌管上清液IL-6浓度
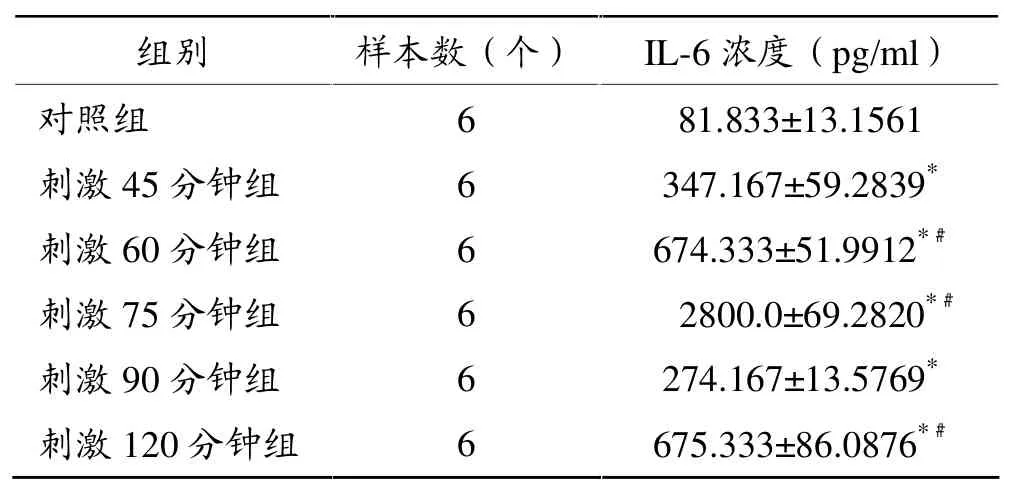
表4 电刺激引起C2C12肌管上清液IL-6浓度变化
由表4可见:随电刺激时间延长,C2C12肌管上清液IL-6浓度升高,各刺激组与对照组相比均显著升高(P<0.05),其中刺激60分钟组、75分钟组和120分钟组IL-6浓度与刺激90分钟组相比明显升高(P<0.05)。
3 讨论
3.1 电刺激对C2C12肌管GLUT4mRNA表达的影响
葡萄糖作为能量物质,在运动中发挥着举足轻重的作用。但葡萄糖是一种极性分子,不能以自由扩散的方式通过细胞膜脂质双层结构的疏水端,需要借助于细胞膜上的GLUT的介导进入细胞内。迄今为止,在哺乳动物体内已发现6种GLUT,分别是GLUT1-5和GLUT7。其中GLUT4介导的葡萄糖转运是骨骼肌糖代谢的主要限速步骤。胰岛素和肌肉收缩是已知的生理状态下促使GLUT4转位的两个主要因素[8]。
Goodyear等[9]早在1990年就发现,在运动后的恢复早期,骨骼肌细胞对葡萄糖的通透性增加是通过增加细胞膜上葡萄糖转运载体和其内在活性所致。Ren等[10]发现,葡萄糖转运能力与葡萄糖转运载体数量有密切联系,并认为运动中GLUT4的快速增加是肌肉对运动进行适应的早期表现,可以更多地增加肌糖原储备的补充。Neufer等[11]发现,一次性运动后,肌肉GLUT4mRNA表达增加,GLUT4蛋白在1周训练后也随之增加。研究者认为,GLUT4蛋白表达的增加受到转录和翻译的共同调节作用。Marotta等[12]研究发现,一次性电刺激C2C12肌管90 min,可增加葡萄糖代谢和糖原分解能力,电刺激引起的骨骼肌肌管的收缩性与运动引起的相同,电刺激下发生的骨骼肌肌管的糖代谢变化与运动时骨骼肌的变化相同。
本研究中发现,电刺激C2C12肌管可增加GLUT4 mRNA表达,并且,随着刺激时间的延长,GLUT4 mRNA表达呈规律性增加,当电刺激时间延长至60分钟,75分钟及90分钟时,GLUT4mRNA表达显著增加。同时,随着电刺激时间延长,C2C12肌管糖原含量呈下降趋势,且电刺激120 min时,糖原含量与对照组比较显著减少。这与在体研究中随着运动时间延长,糖原消耗明显增加的结果相似[13]。这也与Marotta的研究结果[12]相似,说明电刺激模拟运动时神经冲动的发放,使肌管产生收缩性,可以改变葡萄糖代谢的状态,对葡萄糖转运能力产生影响。
3.2 电刺激C2C12肌管产生的IL-6与葡萄糖代谢的关系
过去研究已经证实,人和大鼠骨骼肌收缩能够在循环系统中产生和释放IL-6[14,15]。在运动中,肌纤维本身是产生IL-6的一种来源[16,17]。在运动中,血浆胰岛素水平通常很低,骨骼肌需要增加葡萄糖和脂肪摄入来产生ATP和快速补充肝糖原储备[18]。骨骼肌收缩产生的IL-6的一个生理功能,可能是增加葡萄糖在骨骼肌中的合成[19]。IL-6可以导致糖原分解,增加葡萄糖在肝脏中的输出,并且在脂肪组织中增加脂解作用,这可能为骨骼肌提供葡萄糖和脂肪酸作为能源物质[20]。在运动中产生的IL-6可能发挥一种胰岛素敏感性效应,可以减弱肌肉中由胰岛素分泌引起的葡萄糖增加的作用[21]。研究表明肌肉在运动时释放大量IL-6,可能在维持运动中和运动后的葡萄糖动态平衡中起到决定性的作用[22]。
运动中肌源性IL-6的产生与葡萄糖代谢之间的关系非常紧密,但IL-6通过何种途径影响葡萄糖代谢目前尚无定论。Pedersen等[23]认为,肌源性IL-6可促进骨骼肌对葡萄糖的摄取能力,摄取能力的增加与增加GULT4基因表达和转位能力相关。Carey等[21]通过在体试验得出结论,IL-6通过增加GLUT4的转录而增加基础水平和受到胰岛素刺激时的葡萄糖摄取,同时,在此过程中,AMP-活性蛋白激酶(AMP-activated protein kinase,AMPK)起到关键作用。
本研究中,电刺激C2C12肌管后,GLUT4 mRNA表达呈增加趋势,且随着刺激时间的延长,增加趋势呈现一定规律性,即电刺激75min和电刺激120min时表达量与对照组相比显著增加,表达变化趋势呈双峰曲线。同时,电刺激引起C2C12肌管IL-6及IL-6 mRNA表达增加,两者变化规律均呈双峰曲线,峰值分别出现在电刺激75分钟和电刺激120分钟,这种变化与电刺激引起的GLUT4 mRNA的变化规律一致。总结前人研究可知,在运动中,IL-6的一种生物学功能可能是引起机体葡萄糖摄取和GLUT4转运增加的一个信号。我们猜测,可能是IL-6的自分泌作用在一定程度上增加了GLUT4基因的表达。虽然无直接证据证明这种猜想,但根据电刺激模拟运动中神经冲动发放过程中产生不同浓度IL-6时,GLUT4基因表达变化趋势与IL-6蛋白合成和基因表达呈一致性这一事实,证明它们之间是存在联系的,研究观察到的GLUT4mRNA表达的变化可能是电刺激产生的肌源性IL-6引起的。但IL-6通过何种途径对葡萄糖代谢产生影响,将是今后研究继续关注的重点。
4 总结
电刺激C2C12肌管对细胞糖代谢产生了一定影响,电刺激C2C12肌管引起的GLUT4 mRNA的表达增加可能与肌管收缩产生的IL-6有关。
[1]Pedersen BK,Febbraio MA.muscle as an endocrine organ:focus on muscle-derived interleukin-6.Physiol Rev,2008,88(4):1379-1406.
[2]GleesonM.Interleukinsand exercise.JPhysiol,2000,529:1.
[3]Irrcher I,Hood DA.Regulation of Egr-1,SRF,and Sp1 mRNA expression in contracting skeletal muscle cells.J Appl Physiol,2004,97:2207-2213.
[4]潘红英,徐晓阳,刘承宜,等,电刺激C2C12细胞时活性氧生成的变化.中国运动医学杂志,2006,25(1):46-49.
[5]Irrcher I,Adhihetty PJ,Sheehan T,et al.PPARγcoactivator-1αexpression during thyroid hormone-and contractile activity-induced mitochondrial adaptations.Am J Physiol Cell Physiol,2003,284(6):C1669-1677.
[6]JovéM,Planavila A,Laguna JC,et al.Palmitate-induced interleukin 6 production is mediated by protein kinase C and nuclear-factorκB activation and leads to glucose transporter 4 down-regulation in skeletalmuscle cells.Endocrinology,2005,146(7):3087-3095.
[7]JovéM,Planavila A,Sánchez RM,et al.Palmitate induces tumor necrosis factor-αexpression in C2C12 skeletalmuscle cells by a mechanism involving protein kinase C and nuclear factor-κB activation.Endocrinology,2006,147(1):1552-1561.
[8]潘志军.葡萄糖转运蛋白4与运动.中国体育科技,2006,42(2):118-121.
[9]Goodyear LJ,Chang PY,Sherwood DJ,et al.Effects of exercise and insulin onmitogen-activated protein kinase signaling pathways in rat skeletal muscle.Am J Physiol,1996,271(2):E403-E408.
[10]Ren JM,Semenkovich CF,Gulve EA,et al.Exercise induces rapid increases in GLUT4 expression,glucose transport capacity,and insulin-stimulated glycogen storage inmuscle.JBiol Chem,1994,269(20):14396-14401.
[11]Neufer PD,Dohm GL.Exercise induces a transient increase in transcription of the GLUT-4 gene in skeletal muscle.Am J Physiol Cell Physiol,1993,265:C1597-C1603.
[12]Marotta M,Bragós R,Gómez-Foix AM.Design and performance of an electrical stimulator for long-term contraction of cultured muscle cells.Biotechniques,2004,36(1):68-73.
[13]Steensberg A,Febbraio MA,Osada T,et al.Interleukin-6 production in contracting human skeletalmuscle is influenced by pre-exercisemuscle glycogen content.JPhysiol, 2001,537(pt2):633-639.
[14]Jonsdottir IH,Schjerling P,Ostrowski K,et al.Muscle contractions induce interleukin-6 mRNA production in rat skeletalmuscles.JPhysiol,2000,528(part1):157-163.
[15]Febbraio MA,Ott P,Nielsen HB,et al.Hepatosplanchnic clearance of interleukin-6 in humans during exercise.Am JPhysiol EndocrinolMetab,2003,285(2):E397-E402.
[16]Penkowa M,Keller C,Keller P,et al.Immunohistochemical detection of interleukin-6 in human skeletalmuscleWbers following exercise.FASEB J,2003,17(14):2166-2168.
[17]Hiscock N,Chan MH,Bisucci T,et al.Skeletal myocytes are a source of interleukin-6 mRNA expression and protein release during contraction:evidence of fiber type specificity.FASEB J,2004,18(9):992-994.
[18]Shulman RG,Rothman DL.The“glycogen shunt”in exercising muscle:A role for glycogen in muscle energetics and fatigue.Proc Natl Acad Sci USA,2001,98(2):457-461.
[19]Febbraio MA,Pedersen BK.Muscle-derived interleukin-6:mechanisms for activation and possible biological roles.FASEB J,2002,16(11):1335-1347.
[20]Weigert C,Hennige AM,Brodbeck K,et al.Interleukin-6 acts as insulin sensitizer on glycogen synthesis in human skeletalmuscle cells by phosphorylation of Ser473 of Akt.Am J Physiol Endocrinol Metab,2005,289 (2):E251-E257.
[21]Carey AL,Steinberg GR,Macaulay SL,et al.Interleukin-6 increases insulin-stimulated glucose disposal in humans and glucose uptake and fatty acid oxidation in vitro via AMP-activated protein kinase.Diabetes,2006,55(10):2688-2697.
[22]Lopez-Soriano J,Chiellini C,Maffei M,et al.Roles of skeletalmuscle and peroxisome proliferator-activated receptors in the development and treatment of obesity.Endocr Rev,2006,27(3):318-329.
[23]Pedersen BK,Steensberg A,Schjerling P.Muscle-derived interleukin-6:possible biological effects.J Physiol,2001,536(pt2):329-337.
Changes in IL-6 Content,and IL-6 and GLUT4 Gene Expressions of C2C12M yotubule Caused by Electrical Stimulation
Qiu Guorong1,Xu Xiaoyang2,Xie Minhao3
1 Chongqing University of Arts and Science,Yongchuan,China 402160
2 South China Normal University,Guangzhou,China 510006
3 Sport Science College,Beijing Sport University,Beijing,China 100086
Xie Minhao,Email:xieminhao@bsu.edu.cn
ObjectiveIn this study,the relationship among GLUT4 mRNA expression,contents of myogenic IL-6,and its mRNA expressions following different durations of electrical stimulation were researched.MethodsC2C12 cellswere divided into electrical stimulation group(ES)and control group(CON).GLUT4 mRNA,IL-6 mRNA expression in C2C12 myotubes and the contents of IL-6 in C2C12 myotubes were determined following different stimulation durations.Results(1)With prolonging of stimulation duration,the GLUT4 mRNA expression in C2C12 myotubes increased.Compared with the group CON,the GLUT4 mRNA expression following 60-minute,75-minute and 120-minute stimulation increased significantly(P<0.05),the IL-6mRNA expression in C2C12myotubes increased significantly following 75-minute and 120-minute stimulation(P<0.05),the IL-6 concentration in supernatant increased(P<0.05)in group ES,and the IL-6 concentration of group ES following the three durations was significantly higher than of group CON (P<0.05).(2)With prolonging of stimulation duration,allparameters increased at first,then gradually decreased to the lowest values after 90-minute stimulation.(3)With prolonging of stimulation duration,the glycogen content in C2C12 myotubes gradually decreased,and was significantly differed from group CON following 120-minute stimulation(P<0.05).Conclusions(1)Electrical stimulation affected glucose metabolism of cells to some extent.(2)The change in GULT4 mRNA expression in C2C12 myotubes was correlated positively with the change in protein level and gene level of IL-6 following electrical stimulation.
C2C12 myotube,electrical stimulation,IL-6 protein content,GLUT4 gene expression,IL-6 gene expression
2012.04.07
国家自然科学基金(30570897)资助
谢敏豪,Email:xieminhao@bsu.edu.cn
