急性抗阻运动及不同比例糖和蛋白营养干预对男子力量项目运动员尿雄激素代谢的影响
2012-09-16文安王启荣方子龙邵晶陈成亮周钰杰
文安王启荣方子龙邵晶陈成亮周钰杰
1 上海体育学院研究生部(上海 200438)
2 国家体育总局运动医学研究所,国家体育总局运动营养重点实验室
3 西安工业大学体育学院 4 北京体育大学研究生院
急性抗阻运动及不同比例糖和蛋白营养干预对男子力量项目运动员尿雄激素代谢的影响
文安1,2,3王启荣2方子龙2邵晶2陈成亮4周钰杰4
1 上海体育学院研究生部(上海 200438)
2 国家体育总局运动医学研究所,国家体育总局运动营养重点实验室
3 西安工业大学体育学院 4 北京体育大学研究生院
目的:观察急性抗阻运动及不同比例糖和蛋白营养干预对男子力量项目运动员尿雄激素变化的影响。方法:18名男子力量项目(拳击、健美)运动员,分为糖加高蛋白补充组(HP组,糖和蛋白比例为3:1)、糖加低蛋白补充组(LP组,糖和蛋白补充比例为6:1)及纯糖补充对照组(C组),所有受试者进行相同的抗阻运动,先进行4组70%1RM深蹲动作,每组8次,组间休息60 s,第4组完成后休息90 s;随后完成4组50%1RM深蹲动作,第1、2组重复8次,后两组重复至不能完成动作为止,组间休息60 s,第4组完成后休息150 s;接下来完成4组70%1RM卧推动作,组间休息60 s,第4组完成后休息90 s;最后完成4组50%1RM卧推动作,第1、2组重复8次,后两组重复至不能完成动作为止,组间休息60 s。采用气相质谱色谱仪(GC-MS)测定运动前、运动后即刻及次日晨尿雄激素。结果:急性运动后即刻各组尿本胆烷醇酮及雄酮比运动前显著升高(P<0.05),组间无差异。运动后次日晨,HP组和LP组尿5α-雄烷二醇和5β-雄烷二醇比运动前显著升高 (P<0.05),组间比较HP组5α-雄烷二醇和5β-雄烷二醇显著高于LP、C组(P<0.05)。结论:急性抗阻运动及糖和蛋白营养干预能加速男子力量项目运动员性腺雄激素和肾上腺雄激素转化和代谢,促进睾酮向双氢睾酮转化,有利于脂肪分解和糖酵解,促进机体运动后疲劳恢复。
糖;蛋白质;雄激素;抗阻运动
糖和蛋白质营养干预是重要的运动疲劳营养恢复手段。抗阻运动前补充糖和蛋白质有助于维持肌糖元贮存[1],促进运动后骨骼肌肌纤维蛋白质合成[2];运动中补充糖和蛋白质能缓解高强度抗阻运动对肌肉的损害[3];运动后补充糖和蛋白质能促进氨基酸动力学改变,提高净蛋白质平衡,促进肌糖原再合成最大化。总之,糖和蛋白质营养干预能有效强化抗阻运动训练的生理适应[4,5,6]。
目前对糖和蛋白营养干预功效的评价方法,主要集中在肌肉组织活检和血液指标方面,主要包括对测定示踪物浓度、血液各种同化激素浓度及骨骼肌肌原纤维蛋白质同化信号转导物——雷帕霉素靶蛋白(mTOR)活化水平[7]等。这些方法准确、直观,但有一定损伤,实际应用中有局限性。已有研究显示,急性抗阻运动引起尿雄激素浓度变化,这一变化与运动负荷量、强度有关,与肌肉收缩方式无关[8,9,10],但未见与营养干预有关的报道。本研究采用糖和蛋白营养干预,观察一次急性抗阻运动后被试者尿雄激素变化,探讨糖和蛋白营养对急性抗阻运动应激的影响。
1 对象与方法
1.1 研究对象与分组
男子力量项目(拳击、健美)运动员18名(来自北京体育大学竞技体育学院),根据预先测试的1RM深蹲/瘦体重(kg·kg-1瘦体重),随机分为3组:纯糖补充对照组(C组)、糖加高蛋白补充组(HP组)和糖加低蛋白补充组(LP组),每组6人。所有被试入选前进行体格检测,均无各种内脏疾病,肝肾功能正常,无不良嗜好,不吸烟饮酒,不喝咖啡,不补充任何其他营养补剂。所有被试均签署知情同意书。测试日(包括1RM测试)前一天不进行剧烈身体活动,测试后到第二日清晨采集生物样品之前,不进行任何剧烈体力活动。被试基本情况见表1。
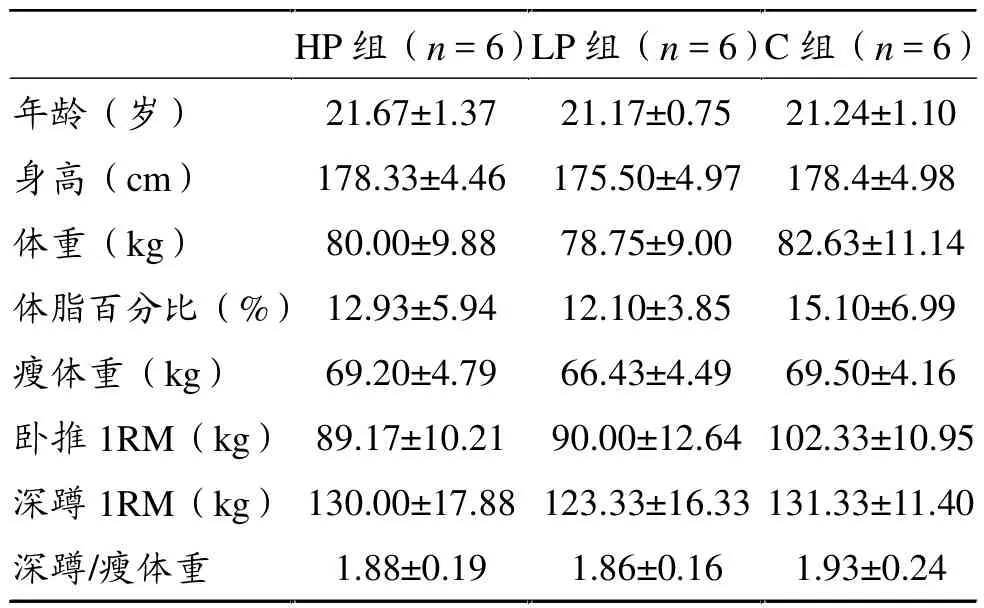
表1 被试者基本情况
1.2 实验方法
1.2.1 运动能力测试
共进行4次测试,第一次为深蹲、卧推最大力量(1RM)测试[11],3次抗阻运动测试每隔一周进行一次,每次安排每组2名共6名被试者。测试时间为8:00~9:00AM。
抗阻运动方案为:深蹲70%1RM,4组,每组重复8次,组间休息60 s,第4组完成后休息90 s;随后进行4组50%1RM深蹲练习,第1、2组每组重复8次,3、4组重复至不能完成为止。组间休息60 s,第4组完成后休息150 s;接下来进行4组70%1RM卧推练习,组间休息60 s,第4组完成后休息90 s;最后完成4组50%1RM卧推练习,第1、2组重复8次,第3、4组重复至不能完成为止。组间休息60 s,总的运动时间为30min[11]。抗阻运动测试在北京体育大学举重训练馆完成。
1.2.2 营养干预方法
营养干预为低聚糖加乳清蛋白粉。HP组补充糖和蛋白粉比例为3:1;LP组糖和蛋白粉比例为6:1;C组采用纯糖干预。运动饮料按照上述比例用纯净水配置并补充,其中CHO浓度为8%。分别在运动前、中、后补充三次,补充量为6、3和6 ml·kg-1体重(总量为15ml·kg-1体重)。
1.3 取样和检测方法
分别取运动前、运动后即刻、运动后1 min和运动后3min指血20μl,溶于40μl破膜液中,采用金泉YSI1500便携式乳酸仪测定血乳酸。
分别取运动前(安静基础值)、运动后即刻和运动后次日晨空腹尿40+m l,使用兴奋剂检测专用白色加盖塑料瓶收集。样品分装在5m l样品冻存管内,每个样品分装8份,-20℃冰箱冷冻储存备用。
采用Shimadzu QP2010气质联用仪测定尿液雄性激素代谢物,测试指标为雄酮(And)、本胆烷醇酮(Etio)、5α-雄烷二醇(5α-diol)、5β-雄烷二醇(5βdiol)、表睾酮(ET)和睾酮(T)。
尿液前处理流程:第一步,酶解。取解冻尿液2 ml加入带盖玻璃试管内,加入1 ml pH7.0磷酸盐缓冲溶液,50μl葡萄糖醛酸酶和加入1μg/ml甲睾(MT)50μl,37℃混悬摇晃过夜。第二步,液液萃取。加入叔丁基甲醚(TBME)4ml和0.5 ml pH9.6 NaHCO3/K2CO3缓冲液0.5 ml,摇床20 min,3000 r/min,室温离心5 min,-75℃冷冻15分钟,有机相倒入另一试管内,70℃高纯氮气吹干。第三步,衍生化。加入1000∶1∶1的衍生化试剂MSTFA∶NH4I∶DTE(二硫代赤藓醇)50 μl。反应液体移入色谱芯中,烘箱加热70℃,进行40分钟衍生化反应。
分析条件:色谱柱:毛细管气相色谱柱HP-1,17 m×0.25mm×0.11μm,载气为氦气,流速控制模式为压力控制,压力为95.2 kPa,总流速为29.0 ml/min,柱流速是1.63ml/min。进样口温度为250℃,进样方式为分流式,分流比15∶1;质谱检测器接口温度为280℃;柱升温程序为起始温度180℃,以3.3℃/min升温至250℃,恒定5min,再以20℃/min升至310℃。
质谱条件:离子源温度200℃,检测器电压为相对调谐方式,阈值为1000,电子轰击能量为70 eV。气相色谱质谱联用仪(GC-MS)为岛津QP2010。自动进样器(AOC)为AOC-20i,每次进样量为1μl。
采用SUNTO团队心率表测定运动前、运动后即刻、运动后1min和运动后3 min心率。
1.4 统计学分析
采用重复测量设计方差分析进行检验。总体差异明显时,Post Hoc Test采用LSD检验不同时间点的差异性[12];相同时间点组间差异性比较采用单因素方差分析(ANOVA)。显著性差异为P<0.05,非常显著性差异为P<0.01。所有统计分析采用SPSS 17.0软件包进行,测试结果以平均值±标准误±SEM.)描述。
2 结果
2.1 血乳酸(表2)
各组运动后即刻血乳酸较运动前升高 (P< 0.01),运动后3min较运动后即刻下降(P<0.05),但仍显著高于运动前基础值。组间比较无差异。
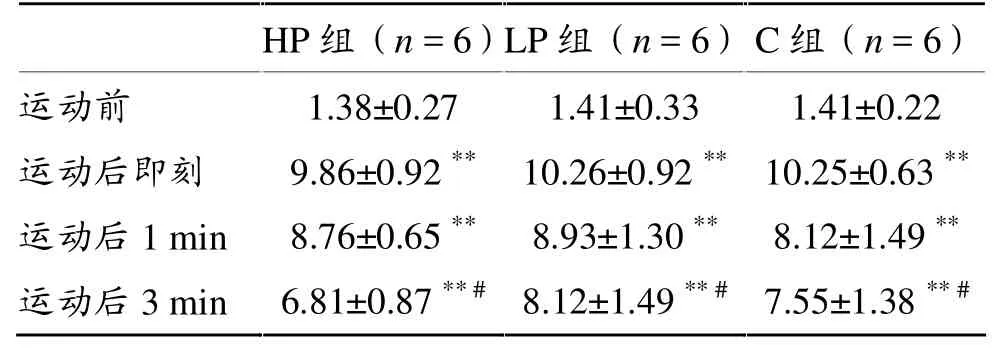
表2 急性抗阻运动前后及恢复期血乳酸变化(mmol·L-1)
2.2 心率(表3)
各组运动后即刻心率较运动前升高(P<0.01),运动后1 min较运动后即刻下降(P<0.05),运动后3 min较运动后1min下降(P<0.05),但仍显著高于运动前基础值。组间比较无差异。
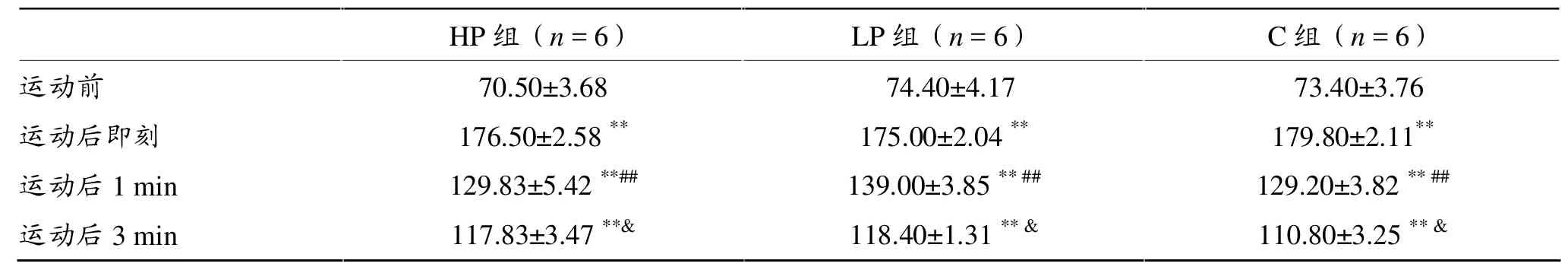
表3 急性抗阻运动前后及恢复期心率变化(beat·m in-1)
2.3 尿雄激素(表4)
表4显示了急性抗阻运动及糖和乳清蛋白营养干预下各组尿中雄激素代谢物不同的变化趋势。
HP组运动后即刻And、Etio显著升高,5α-diol、5β-diol、ET和T无显著性变化,运动后次日晨And、E-tio、5α-diol、5β-diol、T显著升高 (P<0.01,P< 0.05),ET呈升高趋势但无显著性差异。LP组运动后即刻And、Etio和5β-diol显著升高(P<0.05),运动后次日晨除5α-diol升高外(P<0.05)外,其它雄激素水平下降,ET和T运动前后无显著变化。C组运动后即刻And、Etio显著升高(P<0.05),其余无显著变化,运动后次日晨And、Etio、5α-diol、ET和T显著升高(P<0.01),其余无变化。组间比较,HP组运动后次日晨5α-diol、5β-diol显著高于LP组和C组。
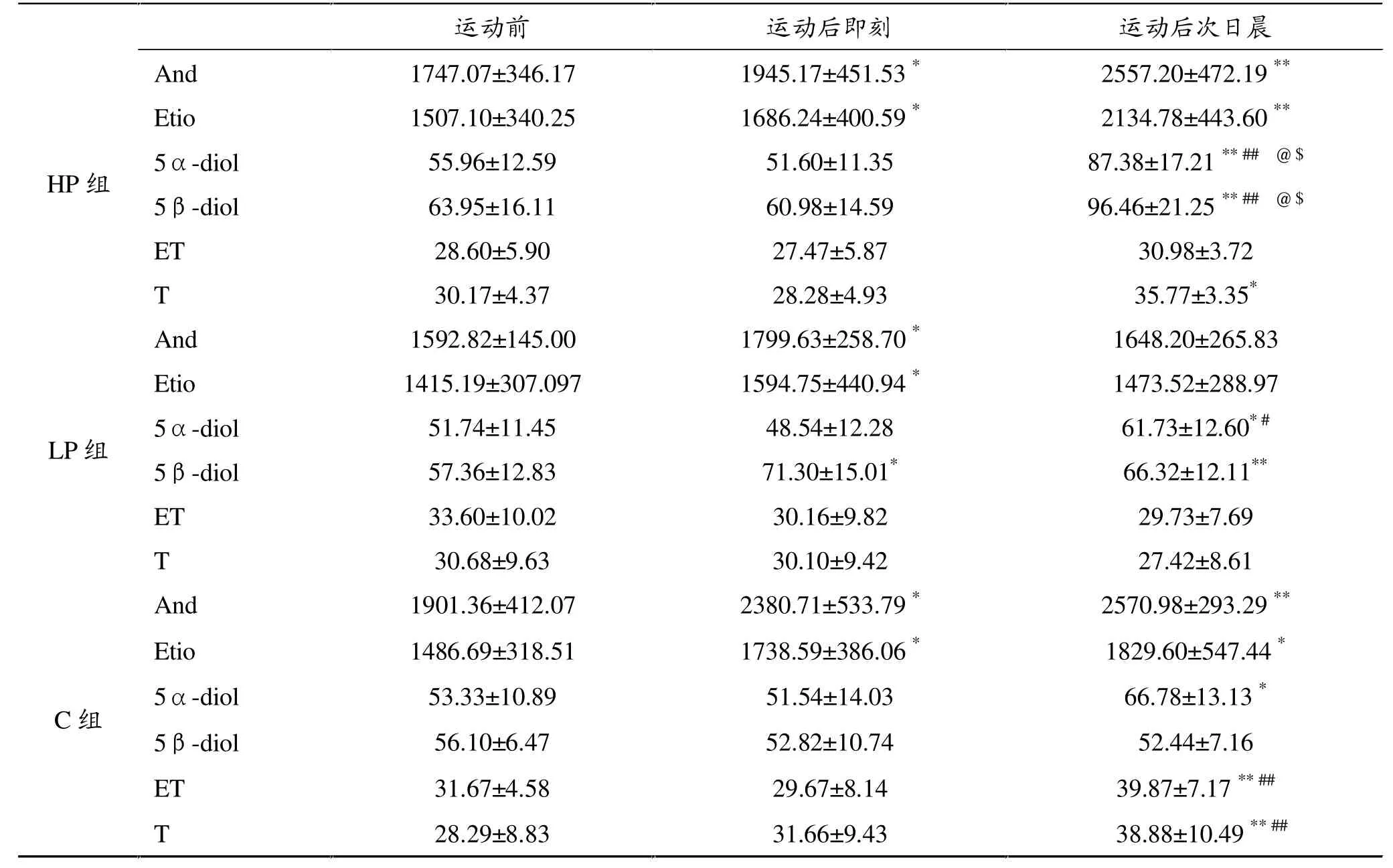
表4 急性抗阻运动前后及恢复期尿雄激素水平变化(ng·m l-1)
3 讨论
3.1 血乳酸和心率的变化
运动后即刻各组血乳酸值均达到10mmol·L-1左右,表明此次运动负荷超过了乳酸阈,抗阻运动主要由糖酵解供能。此次抗阻运动设计主要为大肌肉群参与收缩,在该负荷下骨骼肌产生大量血乳酸,因组间间歇时间较短,血乳酸清除减慢,导致乳酸堆积持续在较高数值。另外,乳酸也是骨骼肌线粒体所能利用的重要能源物质[13],运动后恢复期3 min测量乳酸明显下降,表明所有被试者骨骼肌线粒体功能良好,机体利用和清除乳酸能力良好。各个时间点上各组间比较均无显著性差异,表明不同营养干预配方对血乳酸应答变化无影响。心率一般用于监测和评价间歇时间长短的合理性,当最大心率达到87%~93%时为无氧运动状态,本次研究中运动后即刻各组被试心率达到无氧训练强度。各个时间点上各组间比较均无显著性差异,表明不同营养干预方法对心率变化无明显影响。
3.2 尿雄激素代谢物变化
本次研究中各组运动前、后即刻尿中主要雄激素代谢物And和Etio均表现出升高变化,产生这一变化的主要原因除营养干预外主要来自抗阻运动的效应。一般认为持续大强度训练后尿雄激素代谢物会升高,本次抗阻运动虽然时间较短,但由于抗阻计划中各组间间歇时间较短,被试机体表现为力竭反应(不能完成定量负荷),可以视为持续大强度训练。有两种假设可以解释这一结果:①大强度运动诱导促肾上腺皮质素(ACTH)分泌增加[14],ACTH刺激肾上腺雄激素分泌增加[15],后者的主要代谢物尿And和Etio浓度升高。②剧烈运动导致骨骼肌内T利用率下降,体内代谢清除增加,其主要代谢物尿And和Etio浓度升高。
5α-雄烷二醇(5α-diol),5β-雄烷二醇(5β-diol)是血清T经5α-还原酶和5β-还原酶催化下转化为双氢睾酮(DHT)后DHT的两个主要代谢物。这两个代谢物变化主要源于T的代谢过程的变化。导致5αdiol、5β-diol变化延迟即运动后次日晨出现显著变化的主要原因是:由T代谢到5α-diol、5β-diol至少需要三步代谢过程,分别为5α-还原酶作用和Ⅰ相代谢反应、Ⅱ相代谢反应,所以5α-diol、5β-diol浓度变化所需时间较长,运动后次日晨表现出显著的浓度变化。
本次急性实验结果显示运动后次日晨HP、LP组表现出5α-diol、5β-diol浓度显著高于基础值,提示抗阻运动结合糖和蛋白干预方式能促进肝内5α-还原酶的活性,促进机体内睾酮向DHT转化。另外运动后次日晨HP组5α-diol浓度高于LP组,提示糖加高比例蛋白质在促进5α-还原酶的活性方面优于糖加低比例蛋白质。DHT作为体内与雄激素结合球蛋白(HSBG)结合力最强的雄激素,体内含量增高有利于机体运动能力的恢复。DHT通过对脂肪组织代谢的影响来促进运动疲劳度的恢复。虽然人类骨骼肌中缺少5α-还原酶,但广泛存在于皮下组织及皮肤、前列腺等其他内脏器官,DHT能通过多种渠道促进脂肪组织代谢,促进糖酵解、脂类分解[16,17]。DHT通过雄激素受体来抑制间充质细胞分化和前体脂肪细胞分化,但不影响间充质细胞增殖[18]。一项为期一年的纵向跟踪研究发现:运动训练导致DHT受体含量升高,而血清睾酮值没有显著变化[19],另外一项研究发现橄榄球运动员补充肌酸三周,血清DHT浓度升高,同样血清睾酮浓度未发生变化[20],这或许可以解释为长期运动训练促进机体睾酮向DHT转化率升高,表现为机体对运动训练负荷的良性适应。由于此次仅观察运动后恢复期次日晨尿液雄激素的变化,尿液采集的时间点较少,如果能再持续观察36~72 h后5α-diol、5β-diol的变化就能进一步完整发现这对DHT的代谢物在抗阻运动及糖和蛋白干预后的变化趋势。
尿中睾酮和表睾酮为经肾脏直接清除的雄性激素,尿液中含量很低,两者虽为同分异构体,但代谢途径各自独立,几乎完全不同,表睾酮表现出一定的稳定性。C组表现出升高的主要原因可能是这种干预方式对机体在抗阻运动中对雄激素的利用率无明显影响,运动导致代谢清除增加。
综上所述,抗阻运动及不同比例蛋白质营养干预可以影响体内雄激素的代谢过程,但由于本次研究各组被试数量较少,要进一步发现抗阻运动及糖和蛋白营养干预对雄激素代谢过程的影响,还需进一步大样本量的实验研究。
4 总结
急性抗阻运动及糖和蛋白营养干预能改变体内雄激素的代谢特征,加速男性力量项目运动员性腺雄激素和肾上腺雄激素的转化和代谢。抗阻运动及糖加蛋白能够促进男性力量项目运动员体内睾酮向双氢睾酮转化,从而有利于脂肪分解和糖酵解,有利于提高机体运动能力和促进运动后疲劳的恢复。
致谢:中国反兴奋剂中心杨树民研究员在尿液样品前处理及气相色谱、质谱条件设定等方面提供了帮助。
[1]Haff GG,Koch AJ,Potteiger JA,et al.Carbohydrate supplementation attenuates muscle glycogen loss during acute bouts of resistance exercise.Int JSport Nutr Exerc Metab,2000,(10):326-339.
[2]Tipton KD,Rasmussen BB,Miller SL,et al.Timing of amino acid-carbohydrate ingestion alters anabolic response of muscle to resistance exercise.Am J Physiol Endocrinol Metab,2001,(281):197-206.
[3]White JP,Wilson JM,Austin KG,et al.Effect of carbohydrate-protein supplement timing on acute exercise-induced muscle damage.J Int Soc Sports Nutr,2008,(5):5.
[4]Ivy JL.Glycogen resynthesis after exercise:Effect of carbohydrate intake.Int JSports Med,1998,19:142-145.
[5]Daniel R,Moore,Jason E,et al.Differential stimulation of myofibrillar and sarcoplasmic protein synthesiswith protein ingestion at rest and after resistance exercise.J Physiol,2009,587(4):897-904.
[6]Micah J.Drummond,Hans C.Dreyer,Bart Pennings,et al.Skeletalmuscle protein anabolic response to resistance exercise and essential amino acids is delayed with aging.J Appl Physiol,2008,104(5):1452-1461.
[7]West DW,Kujbida GW,Moore DR,et al.Resistance exercise-induced increases in putative anabolic hormones donot enhance muscle protein synthesis or intracellular signaling in youngmen.JPhysiol,2009,587(2):5239-5247.
[8]Rafael Timón,Andrada M,Maynar Marin D,et al.Variations in urine excretion of steroid hormones after an acute session and after a 4-week programme of strength training.Eur JAppl Physiol,2007,99:65-71.
[9]Timon R,Olcina G,Munoz D,et al.Determination of urine steroid profile in untrained men to evaluate recovery after a strength training session.J Strength Cond Res,2008,22:1087-1093.
[10]Timon R,Olcina G,Tomas-Carus P,et al.Urinary steroid profile after the completion of concentric and concentric/ eccentric trials with the same total workload.J Physiol Biochem,2009,65(2):105-112.
[11]Bird SP,Tarpenning KM,Marino FE,et al.Independent and combined effects of liquid carbohydrate/essential amino acid ingestion on hormonal and muscular adaptations following resistance training in untrained men.Eur J Appl Physiol,2006,97(2):225-38.
[12]邱宏,金如峰,赵玲,等.用SPSS11.0实现对重复测量资料的方差分析.数理医学杂志,2006,19(2):162-165.
[13]G Van Hall.Lactate as fuel formitochondrial respiration.Acta Physiol Scand,2000,168:643-653.
[14]Kraemer WJ,Hakkinen K,Robert UN,et al.Effects of heavy-resistance training on hormonal response patterns in younger vs.older men.J Appl Physiol,1999,87(3):982-992.
[15]Radant AD,Dobie DJ,Peskind ER,et al.Adrenocortical responsiveness to infusions of physiological doses of ACTH is not altered in posttraumatic stress disorder.Front Behav Neurosci,Epub,2009,3(40):1-8.
[16]Bolduc C,Larose M,Yoshioka M,et al.Effects of dihydrotestosterone on adipose tissuemeasured by serial analysis of gene expression.JMol Endocrinol,2004,33:429-444.
[17]Bolduc C,Yoshioka M,St-Amand J,et al.Transcriptoric characterization of long term dihydrotestosterone effects in adipose tissue.Obesity,2007,15:1107-1132.
[18]Gupta V,Bhasin S,Guo W,et al.Effects of dihydrotestosterone on differentiation and proliferation of human mesenchymal stem cells and preadipocytes.Mol Cell Endocrinol,2008,296:32-40.
[19]Hawkins VN,Foster-Schubert K,Chubak J,et al.Effect of exercise on serum sex hormones in men:a 12-month randomized clinical trial.Med Sci Sports Exerc,2008,40:223-233.
[20]Van Der Merwe J,Brooks N,Myburgh KH,et al.Three weeks of creatine monohydrate supplementation affects dihydrotestosterone to testosterone ratio in college-aged rugby players.Clin JSportMed,2009,19:399-404.
Influence of Single-bout Resistance Training and Carbohydrate-Protein Supp lementation on Urine Androgen M etabolism of M ale Boxers and Bodybuilders
Wen An1,2,3,Wang Qirong2,Fang Zilong2,Shao Jing2,Chen Chengliang4,Zhou Yujie4
1 Shanghai University of Sport,Shanghai,China 200438
2 National Institute of Sports Medicine,Beijing,China 100029
3 Xi'an Technological University,Xi'an,China 710032
4 Beijing Sport University,Beijing,China 100084
Wang Qirong,Email:qirongw@163.com
ObjectiveTo investigate the effects of carbohydrate-protein supplementations with different ratios on the body recovery process after acute resistance training and urine androgen metabolism of male boxers and bodybuilders.MethodsEighteen male boxers and bodybuilders were supplied with high-protein and low-carbohydrate(group HP,carbohydrate:protein=3:1),low-protein and high-carbohydrate(group LP,carbohydrate:protein=6:1)and carbohydrate only(group C).All subjects completed4 sets of 8-repetition squats at 70%of 1-RM with 60-second interval.There was 150-second interval after the fourth set.The last two sets were carried out until the subjects were exhausted.Then,4 sets of bench press at 70%of 1-RM were followed with 60-second interval,and 90-second interval after the last set.Again,4 sets of bench press at 50%of 1-RM were followed until the actions of the last two sets could not be repeated.Gas chromatographymass spectrometry(GC-MS)was used to observe urine androgen before exercise,and immediately and in the nextmorning after exercise.ResultsEtiocholanalone and androsterone in each group increased significantly(P<0.05)immediately after acute resistance exercise,but there was no difference among the 3 groups.5α-androstanediol and 5β-androstanediol increased significantly(P<0.05)in groups HP and LP in the nextmorning after acute resistance exercise,and they were significantly higher in group HP than that in groups LP and C(P<0.05).ConclusionsCarbohydrate-protein supplementation during acute resistance training can accelerate the transformation and metabolism of gonad androgen and adrenal androgen,promote testosterone transforming to dihydrotestosterone,and thus benefit the recovery process after acute resistance exercise.
carbohydrate,protein,androgens,resistance training
2012.08.10
国家体育总局科研课题(10B016)
王启荣,Email:qirongw@163.com
