有氧运动对2型糖尿病大鼠腓肠肌氧化应激及MAPKs信号通路的影响
2012-09-16王小娟李建华边仁秀
王小娟李建华边仁秀
1 浙江工业大学体育军训部(浙江杭州 310014)
2 浙江大学医学院附属邵逸夫医院康复医学科
有氧运动对2型糖尿病大鼠腓肠肌氧化应激及MAPKs信号通路的影响
王小娟1李建华2边仁秀2
1 浙江工业大学体育军训部(浙江杭州 310014)
2 浙江大学医学院附属邵逸夫医院康复医学科
目的:研究有氧运动对2型糖尿病大鼠胰岛素抵抗、腓肠肌氧化应激以及MAPKs信号通路的影响。方法:健康雄性Wistar大鼠30只,随机分为正常对照组(C组)、糖尿病对照组(DC组)和有氧运动组(DE组),其中C组以普通饲料喂养,DC组和DE组以高脂饲料喂养。4周后,对DC组和DE组大鼠采用单次注射链脲佐菌素(STZ)的方法建立2型糖尿病大鼠模型,继续高脂饲料喂养4周后,DE组大鼠进行无负重游泳训练6周,训练期间C组大鼠继续以普通饲料喂养,DC组和DE组大鼠继续以高脂饲料喂养。6周后,处死所有大鼠,测试空腹血糖(FBG)、空腹胰岛素(FINS)并计算胰岛素抵抗指数(HOMA-IR),测试腓肠肌超氧化物歧化酶(SOD)和谷胱甘肽过氧化物酶(GPX)活性及丙二醛(MDA)水平,RT-PCR法测试腓肠肌p38和JNK mRNA表达,Western-blot法测试腓肠肌ERK1/2和p-ERK1/2表达。结果:和C组相比,DC组大鼠FBG、FINS和HOMA-IR均显著升高,腓肠肌SOD和GPX活性显著降低而MDA水平显著升高,腓肠肌p38、JNK1、JNK2 mRNA相对表达量显著升高,p-ERK1、ERK2和p-ERK2相对表达量显著升高而ERK1相对表达量差异无统计学意义。与DC组相比,DE组大鼠FBG、FINS和HOMA-IR均显著降低,腓肠肌SOD和GPX活性显著升高而MDA水平显著降低,腓肠肌p38和JNK1 mRNA相对表达量显著升高而JNK2 mRNA相对表达量无统计学意义,腓肠肌p-ERK1、ERK2和p-ERK2相对表达量显著升高而ERK1相对表达量无统计学意义。结论:有氧运动可激活糖尿病大鼠腓肠肌MAPKs信号通路系统,增强机体抗氧化酶SOD和GPX活性,改善糖尿病大鼠氧化应激状态,降低其胰岛素抵抗水平。
有氧运动;2型糖尿病;氧化应激;MAPK信号通路
氧化应激在糖尿病及其并发症中的作用逐渐引起重视。氧化应激是指体内活性氧(reactive oxygen species,ROS)产生和抗氧化防御体系之间失衡,导致组织损伤的一种状态。2型糖尿病患者体内的高脂肪酸、高糖诱导了氧化应激,产生过多自由基,诱发炎症反应,产生诸多炎症因子如TNF-α和IL-6等,这些炎症因子对糖尿病发生发展有重要影响。糖尿病发病后,持续高血糖进一步加重氧化应激,而氧自由基大量堆积又加重糖尿病病情,形成恶性循环[1]。丝裂原活化蛋白激酶信号系统(MAPKs)是一组高度保守的丝氨酸/苏氨酸双重磷酸化蛋白激酶家族,它存在于大多数原核生物和所有真核生物中,在细胞生物信号传导中起着非常重要的作用。MAPKs家族由ERK1/ 2、JNK、p38、ERK3/4、ERK5等5种亚类组成[2]。其中对ERK1/2、JNK、p38研究得最深入。ROS可通过激活MAPKs信号通路,调节抗氧化酶基因等氧化还原敏感型基因表达,使细胞产生预适应,以抵抗更严重的氧化应激。本研究采用单次注射链脲佐菌素(STZ)方法建立2型糖尿病大鼠模型,研究有氧运动对2型糖尿病大鼠胰岛素抵抗和氧化应激的影响,探讨运动诱导MAPKs信号通路变化与2型糖尿病大鼠氧化应激和胰岛素抵抗的关系。
1 材料和方法
1.1 动物造模与分组
健康雄性Wistar大鼠30只,体重(191.84±16.53)g,购于上海西普尔-必凯实验动物有限公司,许可证号为SCXK(沪)2003-0002,用普通饲料适应性喂养3天后随机选8只作为正常对照组(C组),普通饲料喂养;其余22只大鼠改用高脂饲料喂养(高脂饲料配方为基础饲料60%,蛋黄粉5%,蔗糖20%,猪油15%),并进行糖尿病造模。造模大鼠高脂饲养4周后禁食12 h,将链脲佐菌素溶于0.1mol/L枸橼酸—枸橼酸钠缓冲液(pH 4.2)溶液中,配成浓度为1%的溶液,单次腹腔注射30mg/kg体重,对照组8只大鼠给予等量枸橼酸—枸橼酸钠缓冲液腹腔注射。72 h后尾静脉取血测血糖,血糖>16.7 mmol/L为造摸成功。共17只大鼠造模成功并纳入实验,继续高脂饮食4周后随机分为2组:糖尿病对照组(DC组,n=8)和有氧运动组(DE组,n=9)。实验期间,动物自由摄食和饮水,环境温度(20±2)℃,光照12 h/12 h明暗周期。本实验在浙江省医学科学院完成。
1.2 运动方案
C组和DC组大鼠笼中正常饲养。DE组大鼠进行无负重游泳训练,第1天运动25min,第2天35min,第3天45min,从第4天开始每天运动60min,每周6天,共6周。游泳池为90 cm×70 cm×70 cm的长方体,水深50 cm,水温(30±1)℃。整个训练期间,C组大鼠继续以普通饲料喂养,DC组和DE组大鼠继续以高脂饲料喂养。
1.3 取材
于DE组大鼠6周训练结束后,所有大鼠禁食12 h。戊巴比妥钠腹腔麻醉,开胸,胸主动脉取血10ml,4℃条件下12000 r/min离心1min分离血清,于4℃冰箱保存,待测空腹血糖(FBG)和空腹胰岛素(FINS)。将左侧腓肠肌分成三份于液氮中速冻,并于-80℃冰箱保存。第一份测试超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GPX)和丙二醛(MDA),第二份测试MAPK信号通路蛋白p38和JNK mRNA表达,第三份测试MAPK信号通路ERK1/2和p-ERK1/2蛋白表达。
1.4 指标的测定
1.4.1 血清FBG和FINS测定
用全自动生化分析仪(HITACHI-7020)检测各组动物血清FBG含量;血清FINS采用放射免疫法测定,试剂盒均由上海生工生物工程技术服务有限公司提供,严格按试剂盒说明进行操作,并计算胰岛素抵抗指数[HOMA-IR=(FBG×FINS)/22.5][1]。
1.4.2 腓肠肌SOD、GPX和MDA测定
于-80℃冰箱取出腓肠肌,用4℃预冷的生理盐水冲洗干净,滤纸吸干水分,电子天平称重,按1 g∶10 ml(每克腓肠肌组织加10 ml 4℃预冷生理盐水)比例,在冰水溶液中用玻璃匀浆器研磨制成匀浆,4℃3500 r/min离心10 min,取上清液制成10%腓肠肌组织匀浆,然后严格按照试剂盒操作说明书检测SOD、GSH-Px活性和MDA水平。试剂盒均购自南京建成生物工程研究所。
1.4.3 腓肠肌p38和JNK mRNA表达测定
腓肠肌总RNA抽提参照Trizol试剂盒说明书进行。总RNA纯度和浓度检测采用NANODROP 2000 spectrophotometer仪,确认OD260/OD280比值均在1.8~2.0之间,并记录各样本浓度;琼脂糖凝胶电泳检测28s、18s、5s三条带以鉴定总RNA完整性(如图1)。
图1 琼脂糖凝胶电泳检测RNA完整性
将符合要求的RNA样品进行逆转录,逆转录反应条件:37℃,15 min(反转录反应);85℃,5 s(反转录酶的失活反应)。根据所要检测的目的基因,在NCBI数据库查询各基因引物序列,由上海生工生物技术有限公司合成,各基因引物序列及扩增长度如表1所示。荧光定量PCR扩增反应按以下体系进行,SYBR Premix Ex TaqTM(2×)10μl、PCR Forward Primer(10μM)0.4μl、PCR Reverse Primer(10μM)0.4μl、ROX Reference Dye(50×)0.4μl、DNA模板2 μl、加DEPC水使总反应体系达到20μl。Real time PCR分三阶段,扩增采用三步法,温度循环参数如下:Stage 1(1×):95℃,1 min (预变性)。Stage 2(40×):95℃,15 s;61℃,30 s;72℃,45 s(收集荧光)。Stage 3(1×):建立PCR产物的熔解曲线,95℃,30 s;61℃,2min;95℃,15 s;每1℃收集荧光。反应结束后,PCR仪给出各反应孔的Ct值,以β-actin基因为内参,根据公式2-ΔCt计算各基因相对表达量。
1.4.4 腓肠肌ERK1/2和p-ERK1/2蛋白表达测定
从-80℃冰箱取出腓肠肌,放入手动组织匀浆器中,按组织净重∶裂解液=1∶10的比例,加入相应体积裂解液进行匀浆,离心收集上清,加入Laemmli样品缓冲液(按照蛋白样品∶Laemmli样品缓=1∶2的比例混合),强力混匀,样品置100℃水浴箱中加热5 min,10000 r/min离心10min,取上清液,将其转入另一洁净的试管中,BCA法测定蛋白总浓度。蛋白样品经SDS-PAGE凝胶电泳、转膜,根据蛋白质maker标志和目的蛋白的分子量剪膜,5%脱脂牛奶封闭1小时,用PBST洗3遍,将膜在一抗(兔抗鼠)(Sant Cruze公司1∶2000)中孵育,4℃过夜,用PBST洗3遍,加入荧光二抗(1∶2000),在黑色孵育盒中闭光轻摇孵育1.5 h,用PBST洗3遍,将膜放在odyssey荧光凝胶成像系统扫描、拍照,以待测蛋白与内参蛋白β-actin的平均密度之比作为待测蛋白相对表达水平。
1.5 统计学分析
2 结果
2.1 血清FBG和FINS含量及HOMA-IR
由表2可知,与正常对照组相比,糖尿病对照组和有氧运动组大鼠FBG、FINS和HOMA-IR均显著升高 (P<0.01或P<0.05)。而有氧运动组大鼠FBG、FINS和HOMA-IR则比糖尿病对照组显著降低 (P< 0.01或P<0.05)。病对照组相比,有氧运动组大鼠腓肠肌p38和JNK1 mRNA相对表达量显著升高 (P<0.01),而JNK2 mRNA相对表达量差异无统计学意义(P>0.05)。
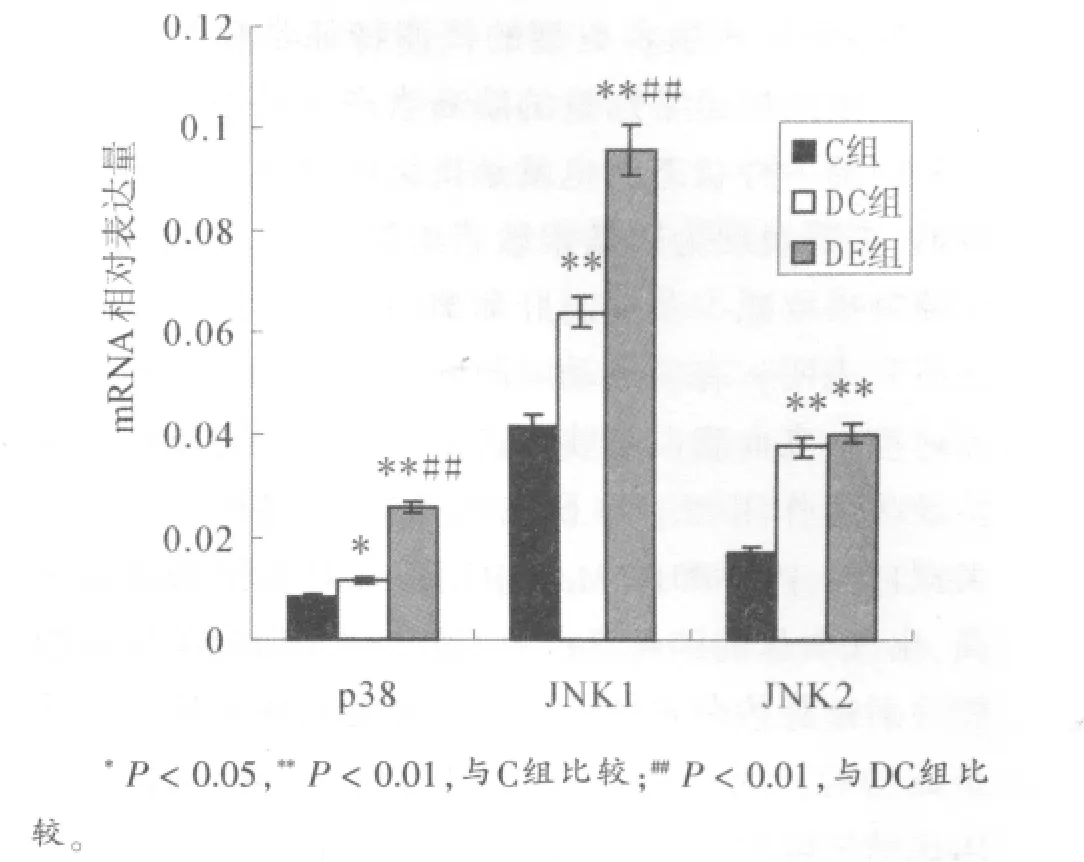
图2 各组p38和JNK mRNA相对表达量比较

表2 各组大鼠血清FBG、FINS和HOMA-IR比较
2.2 腓肠肌SOD、GPX活性及MDA含量
由表3可知,与正常对照组相比,糖尿病对照组和有氧运动组大鼠腓肠肌SOD和GPX活性显著降低 (P< 0.01或P<0.05),而MDA水平显著升高(P<0.01)。与糖尿病对照组相比,有氧运动组大鼠SOD和GPX活性显著升高(P<0.01),而MDA水平显著降低(P<0.01)。
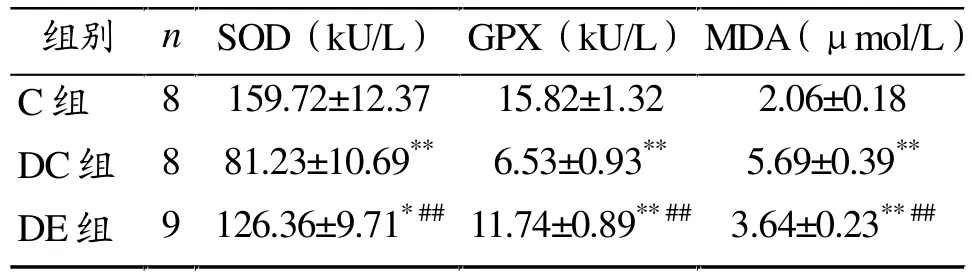
表3 各组大鼠腓肠肌SOD、GPX活性和MDA含量比较
2.3 腓肠肌p38和JNK mRNA表达
由图2可知,与正常对照组相比,糖尿病对照组和有氧运动组大鼠腓肠肌p38、JNK1和JNK2 mRNA相对表达量显著升高(P<0.01或P<0.05)。与糖尿
2.4 腓肠肌ERK1/2和p-ERK1/2的蛋白表达
由图3可知,与正常对照组相比,糖尿病对照组大鼠腓肠肌p-ERK1、ERK2和p-ERK2相对表达量显著升高(P<0.01),而ERK1相对表达量差异无统计学意义(P>0.05)。与正常对照组相比,有氧运动组大鼠腓肠肌ERK1、p-ERK1、ERK2和p-ERK2相对表达量显著升高(P<0.01或P<0.05);与糖尿病对照组相比,有氧运动组大鼠腓肠肌p-ERK1、ERK2和p-ERK2相对表达量显著升高(P<0.01或P<0.05),而ERK1相对表达量差异无统计学意义(P>0.05)。
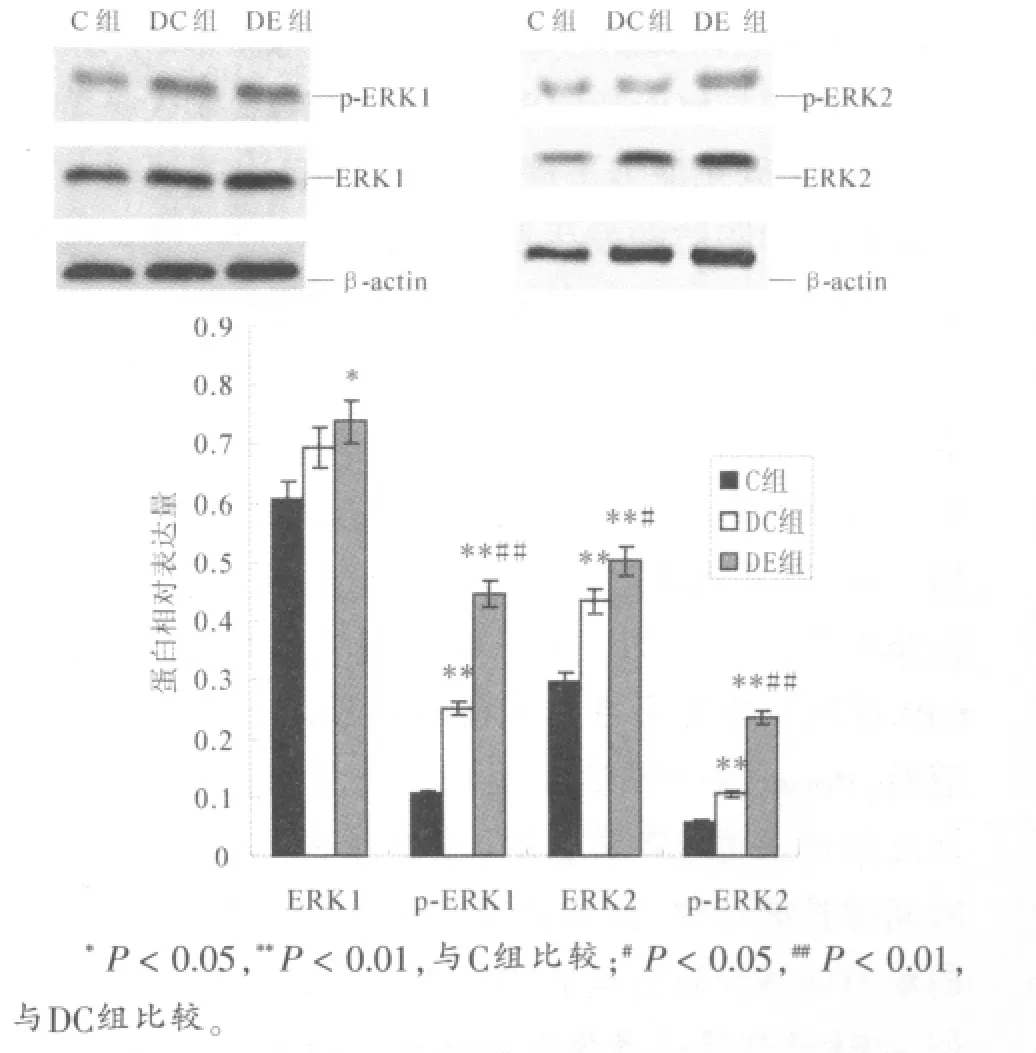
图3 各组ERK 1/2和p-ERK 1/2蛋白表达比较
3 讨论
3.1 有氧运动对2型糖尿病大鼠胰岛素抵抗的影响
2型糖尿病患者典型的代谢特征是胰岛素抵抗(IR)。IR是指正常剂量的胰岛素产生低于正常生物学效应的一种状态,也就是指机体对胰岛素的反应减退,主要表现为胰岛素敏感组织(肌肉、脂肪组织)葡萄糖摄取减少及抑制肝葡萄糖输出作用减弱。以往研究表明,有氧运动对肥胖和与肥胖密切相关的高血糖、高血脂以及胰岛素抵抗等症状有较好的预防及改善作用[3-5]。本研究结果显示:糖尿病对照组大鼠FBG、FINS和HOMA-IR比正常对照组均显著升高,出现明显的胰岛素抵抗。这说明本研究采用的腹腔注射链脲佐菌素结合高脂饮食的糖尿病造模方法是成功的;而有氧运动组大鼠FBG、FINS和HOMAIR比糖尿病对照组显著降低,表明有氧运动明显改善糖尿病大鼠胰岛素抵抗,这同有关研究报道结果一致[6]。
3.2 有氧运动对2型糖尿病大鼠氧化应激的影响
糖尿病时体内自由基生成增多,这些自由基主要来源于高糖状态下线粒体内糖、脂肪、体内糖基化蛋白质的氧化或细胞浆内醛糖的还原反应[7]。糖尿病患者产生过多自由基,消耗了内源性SOD、GPX和过氧化氢酶(CAT),导致抗氧化能力下降[8]。同时,ROS又会进一步升高血糖,加重糖尿病病情,二者彼此影响,形成恶性循环[9]。本研究结果显示:糖尿病对照组大鼠腓肠肌SOD和GPX活性比正常对照组显著降低,而MDA水平显著升高。这说明糖尿病大鼠体内高脂肪酸、高糖诱导氧化应激,产生过多自由基,消耗了内源性SOD和GPX,使机体SOD和GPX显著下降,导致抗氧化能力下降。同时,氧自由基通过与细胞膜不饱和脂肪酸发生脂质过氧化反应,破坏细胞结构,生成MDA,使机体MDA含量显著升高。
运动是一种应激。运动中肌肉收缩、氧化物释放增多和运动引起细胞功能改变等在刺激抗氧化酶基因表达上起重要作用。过度氧化应激对机体造成损伤,而适度氧化应激能诱导细胞抗氧化反应,有利于预防更严重的氧化应激。耐力训练提高机体SOD和GPX等抗氧化酶活性,从而有效预防更严重的氧化应激。Powers等[10]研究了运动负荷量与骨骼肌SOD活性之间的关系,结果显示,强度越大和/或每日持续时间越长的运动,提高骨骼肌SOD活性越明显。规律的耐力训练导致运动肌GPX活性增加[11,12]。与SOD相似,GPX升高受运动强度和运动持续时间影响,运动强度越大和/或持续时间越长,GPX活性升高程度越大[10,11]。 本研究结果显示:有氧运动组大鼠腓肠肌SOD和GPX活性比糖尿病对照组显著升高,而MDA水平显著降低。这说明糖尿病大鼠体内高脂肪酸、高糖诱导了氧化应激,产生过多自由基,消耗了内源性SOD和GPX,而这并未引起SOD和GPX活性增加,或者引起的SOD和GPX活性增加不足以抵抗自由基对其的消耗。有氧运动作为对机体的一种适宜刺激,相对于糖尿病大鼠体内高脂肪酸、高糖诱导的氧化应激,有氧运动对机体的刺激是间歇性的,能较好刺激抗氧化酶SOD和GPX活性增加,而又不产生过多自由基,从而适度增强机体抗氧化反应,有利于预防糖尿病大鼠体内高脂肪酸、高糖诱导的氧化应激。
3.3 有氧运动对2型糖尿病大鼠MAPKs信号通路的影响
有研究认为,非力竭性运动通过产生适度氧化应激刺激一些抗氧化酶基因表达,这可能与细胞信号转导有关[13]。有研究证明,肌肉单次收缩运动,尤其是离心性收缩能激活骨骼肌MAPK通路[14]。耐力训练明显增加骨骼肌ERK1/2蛋白量[15],提示运动能激活MAPK在内的多种细胞信号通路[16]。人单腿骑自行车可以使运动侧腿部肌肉ERK1/2蛋白表达增加,但不能使非运动侧腿部肌肉ERK1/2蛋白表达增加[17]。而大鼠进行跑台运动时,骨骼肌ERK磷酸化增高,膈肌ERK活性无变化[18]。这说明运动诱导肌肉ERK磷酸化可能是运动引起肌肉局部变化而不是全身变化的效应。
本研究结果显示:糖尿病对照组大鼠腓肠肌p38、JNK1和JNK2 mRNA相对表达量以及腓肠肌p-ERK1、ERK2和p-ERK2蛋白相对表达量比正常对照组显著升高,而ERK1蛋白相对表达量无明显变化。这说明糖尿病大鼠体内高脂肪酸、高糖诱导的氧化应激和产生的ROS主要通过激活MAPKs信号通路,使细胞产生预适应,以抵抗更严重的氧化应激。ROS激活的MAPKs信号通路主要包括p38、JNK1和JNK2基因表达增加以及p-ERK1、ERK2和p-ERK2蛋白表达增加,而对ERK1蛋白表达的作用不明显。另外,有氧运动组大鼠腓肠肌p38和JNK1mRNA相对表达量以及p-ERK1、ERK2和p-ERK2蛋白相对表达量比糖尿病对照组显著升高,而JNK2 mRNA相对表达量与ERK1蛋白相对表达量无明显变化。这说明有氧运动使机体产生适度氧化应激,通过激活MAPKs信号通路,增加抗氧化酶SOD和GPX表达,使细胞产生预适应,以抵抗更严重的氧化应激。有氧运动激活的MAPKs信号通路主要包括p38和JNK1基因表达增加,以及p-ERK1、ERK2和p-ERK2蛋白表达增加,而对JNK2基因表达和ERK1蛋白表达的作用不明显。
4 总结
2型糖尿病大鼠机体出现明显的胰岛素抵抗现象和氧化应激,且MAPKs信号通路系统被适度激活,但激活的MAPKs信号通路系统不足以抵抗机体的氧化应激。
有氧运动可激活糖尿病大鼠腓肠肌MAPKs信号通路系统,使机体抗氧化酶SOD和GPX表达增加,改善糖尿病大鼠的氧化应激状态,降低其胰岛素抵抗水平。
[1]Neyestani TR,Shariatzade N,Kalayi A,et al.Regular daily intake of black tea improves oxidative stress biomarkers and decreases serum C-reactive protein levels in type 2 diabetic patients.Ann Nutr Metab,2010,57(1):40-49.
[2]Meilhac O,Zhou M,Santanam N,et al.Lipid peroxides induce expression of catalase in cultured vascular cells.J Lipid Res,2000,41(8):1205-1213.
[3]Kalupahana NS,Claycombe K,Newman SJ,et al.Eicosapentaenoic acid prevents and reverses insulin resistance in high-fat diet-induced obesemice viamodulation of adipose tissue inflammation.JNutr,2010,140 (11):1915-1922.
[4]Ritchie IR,Gulli RA,Stefanyk LE,et al.Restoration of skeletalmuscle leptin response does not precede the exercise-induced recovery of insulin-stimulated glucose uptake in high-fat-fed rats.Am J Physiol Regul Integr Comp Physiol,2011,300(2):492-500.
[5]Huffman KM,Slentz CA,Bateman LA,et al.Exercise-induced changes in metabolic intermediates,hormones,and inflammatory markers associated with improvements in insulin sensitivity.Diabetes Care,2011,34(1):174-176.
[6]Hoy AJ,Turner N.New insight into the mechanism by which acute physical exercise ameliorates insulin resistance.JPhysiol,2008,586(9):2251-2252.[7]李爱琴,陆环,徐文静,等.氧化应激与2型糖尿病的研究进展.现代生物医学进展,2010,10(12):2371-2378.
[8]Hayden MR,Yang Y,Habibi J,et al.Pericytopathy:oxidative stress and impaired cellular longevity in the pancreas and skeletalmuscle in metabolic syndrome and type 2 diabetes.Oxid Med Cell Longev,2010,3(5):290-303.
[9]郭超卿,王灿,苗明三.浅析氧化应激与糖尿病.中医学报,2009,24(6):24-26.
[10]Powers SK,Criswell D,Lawler J,et al.Influence of exercise and fiber type on antioxidant enzyme activity in rat skeletalmuscle.Am JPhysiol,1994,266(2):375-380.
[11]Criswell D,Powers S,Dodd S,et al.High intensity training-induced changes in skeletal muscle antioxidant enzyme activity.Med Sci Sports Exerc,1993,25(10):1135-1140.
[12]Leeuwenburgh C,Hollander J,Leichtweis S,et al.Adaptations of glutathione antioxidant system to endurance training are tissue and muscle fiber specific.Am J Physiol,1997,272(1):363-369.
[13]Ji LL.Exercise-induced modulation of antioxidant defense.Ann NY Acad Sci,2002,959:82-92.
[14]BoppartMD,AronsonD,Gibson L.Eccentricexercisemarkedly increases c-Jun NH (2)-terminal kinase activity in human skeletalmuscle.JApplPhysiol,1999,87(5):1668-1673.
[15]Yu M,Blomstrand E,Chibalin AV,et al.Exercise-associated differences in an array of proteins involved in signal transduction and glucose transport.J Appl Physiol,2001,90(1):29-34.
[16]江钟立,陈家伟,苏恩本,等.运动对大鼠肌细胞丝裂素活化蛋白酶信号传导系统的调节作用.中华物理医学与康复杂志,2002,24(6):353-355.
[17]Hayashi T,Hirshman MF,Dufresne SD,et al.Skeletal muscle contractile activity in vitro stimulatesmitogen-activated protein kinase signaling.Am JPhysiol,1999,277(4):701-707.
[18]Goodyear LJ,Chang PY,Sherwood DJ,et al.Effects of exercise and insulin on mitogen-activated protein kinase signaling pathways in rat skeletalmuscle.Am J Physiol,1996,271(2):403-448.
Aerobic Exercise Reduces the Level of Insulin Resistance in Diabetic Rats
Wang Xiaojuan1,Li Jianhua2,Bian Renxiu2
1 Physical Education Department,Zhejiang University of Technology,Hangzhou,China 310014
2 Sir Run Run Shaw Hospital,College of Medicine,Zhejiang University,Hangzhou,China 310016 Corresponding Author:Li Jianhua,Email:zjdxsyfkfk@126.com
ObjectiveTo study the effect of aerobic exercise on the insulin resistance,oxidative stress and MAPKs signaling pathway of gastrocnemius in type 2 diabetic rats.MethodsThirty healthy maleWistar ratswere randomly divided into control group(C,normal diet),diabetic control group(DC,high fat diet),and diabetic aerobic exercise group(DE,high fat diet).After 4 weeks,rats in groups DC and DE were injected with streptozotocin(STZ)for developing type 2 diabetes,and continued feeding high-fat diet for another 4 weeks.Rats in group DE underwent swimming without additional load for 6weeks.All rats were sacrificed after 6 weeks,and the fasting blood glucose (FBG),fasting insulin(FINS),insulin resistance index(HOMA-IR),gastrocnemius superoxide dismutase(SOD)and glutathione peroxidase(GPX)activities,and malondialdehyde(MDA)levels were tested or calculated.Gastrocnemius p38 and JNK mRNA expression were determined by RT-PCR,and gastrocnemius ERK1/2 and p-ERK1/2 expression by Western-blotmethod.ResultsCompared with the rats in group C,FBG,FINS,HOMA-IR and MDA levels increased,gastrocnemius SOD and GPX decreased,MDA level significantly increased,mRNA relative expression levels of p38,JNK1,and JNK2 in gastrocnemius significantly increased in rats of group DC.There was no statistical significance in relative expression level of ERK1.Compared with the group DC,FBG,FINS,HOMA-IR and MDA levels decreased,and gastrocnemius SOD and GPX increased,mRNA relative expression level of p38 and JNK1 in gastrocnemius,and relative expression level of p-ERK1,ERK2 and p-ERK2 significantly increased in group DE.There was no statistical significance in the level of ERK1 and JNK2.ConclusionAerobic exercise could activate the MAPKs signaling pathway,increase the expression of antioxidant enzymes SOD and GPX,improve the oxidative stress status in gastrocnemius,and thus reduce the level of insulin resistance in diabetic rat.
aerobic exercise,type 2 diabetes,oxidative stress,MAPK signaling pathway
2012.04.01
浙江省自然科学基金项目(Y2080042)
李建华,Email:zjdxsyfkfk@126.com
