超声辐照微泡对肝细胞生长因子转染大鼠损伤面神经的促进作用
2012-09-15郝亚宁骆文龙
郝亚宁,骆文龙
(重庆医科大学附属第二医院耳鼻咽喉头颈外科,重庆400010)
面神经作为一条重要的周围神经,主要功能是支配面部肌肉的运动。外伤、邻近组织感染、脑血管意外及医源性损伤都可能损伤面神经。近几年诸多学者对面神经损伤的修复进行了系统研究。由于基因治疗能在分子水平上纠正疾病的发病过程,因此在面神经损伤的防治上有较好的应用前景。肝细胞生长因子(hepatocyte growth factor,HGF)对感觉神经[1]、副交感[2]及交感神经[3-4],特别是对运动神经[5-6]的发育、轴索生长都有一定的神经营养性作用和导向作用。超声辐照微泡能将目的基因转入各种靶细胞和靶组织,但它在面神经损伤修复的作用研究,尚未见国内外报道。因此本实验运用超声微泡介导HGF基因转染损伤后的面神经,观察HGF的表达及受损面神经传导速度、神经电位波幅、潜伏期等参数,探讨该方法的有效性,为面神经损伤的修复提供一种新型、高效、安全的方法。
1 材料与方法
1.1 实验动物
清洁级SD大鼠,40只,雌雄不限,体质量200~250g,由重庆医科大学动物实验中心提供,合格证号:SCXK(渝)2007-0001。
1.2 质粒的提取
HGF菌液由重庆医科大学附属二院肝病研究治疗中心提供,HGF经大肠埃希氏菌扩增16 h后,按质粒大量抽提试剂盒 (Omega公司)说明提取。提取纯化的HGF经酶切电泳鉴定,紫外分光光度计测定其浓度为1 g/L。
1.3 试剂
Trizol试剂,兔抗鼠HGF多克隆抗体和兔抗鼠β-actin多克隆抗体,羊抗兔IgG,化学发光试剂,(武汉谷歌生物科技有限公司);脂质微泡,(重医附二院超声影像学研究所提供)白色冻干粉末状。使用时将2 mL 0.9%氯化钠注射液注入瓶中,振荡混匀,微泡浓度为(0.5~1)×108个/mL,微泡直径为3 ~5 μm。
1.4 动物模型的制作
5%戊巴比妥(30 mg/kg)腹腔内注射麻醉大鼠并仰卧位固定,再以5%利多卡因局部追加麻醉。在手术显微镜下切开右侧颞骨骨泡,用钻磨开镫骨肌支面神经骨管3 mm左右,蚊式钳钳夹面神经干长约2 mm,力量为三扣,持续60 s,松开30 s,再钳夹60 s,手术显微镜观察面神经损伤程度为束膜性神经中断,符合 Sunderland损伤Ⅳ度[7].
1.5 脂质微泡与HGF基因的结合
用一次性注射器取2 mL 0.9%氯化钠注射液,注入微泡冻干粉瓶中,充分摇匀;取含HGF基因溶液0.5 mL(质粒浓度为1 g/L),加入微泡瓶中,摇匀后室温下静置30 min,使之充分黏附在微泡表面,该混合液中质粒浓度为0.2 g/L。
1.6 动物分组及给药
模型制作成功后,将大鼠随机分成4组,A组:单纯手术组(PBS);B组:HGF+微泡组;C组:HGF+超声组;D组:HGF+超声+微泡组,每组10只。D组经股静脉注入载基因微泡溶液1 mL(含0.2 mg HGF),再用超声转染仪,频率1 MHz,功率0.75 W/cm2,紧贴面神经受损部位进行体外照射,照射10 s,间隔10 s,共2 min;C组经股静脉插管注入1 mL含0.2 mg HGF溶液,同样采用上述超声参数,B组经股静脉输入同等剂量的载基因微泡,不用超声触发;A组输入1 mL PBS作为对照。
1.7 标本采集
基因转染后28 d,再以3%戊巴比妥钠腹腔注射麻醉。打开胸腔后,经左心室向升主动脉插管,剪开右心耳。迅速灌注0.9%NaCI约300 mL至从右心耳流出的血液完全变清,再灌注4%多聚甲醛约250 mL,先快后慢,致动物四肢僵硬。切取吻合处神经组织1 cm×1 cm,用于Western blot和RT-PCR检测。
1.8 神经电生理学检测
采用BL-6420C生物信号采集与处理系统,将自制的针灸针电极作为刺激电极,两极间的距离约为9 mm。记录电极为针灸针(经氯化银镀银处理)双极记录电极。基因转染后28 d检测:常规10%水合氯醛麻醉大鼠后固定,将针灸针刺激电极分别插至神经干术后处的中枢端和外周端的肌肉,尽量将刺激电极靠近神经,再将记录电极插进受面神经支配的面颊肌,插入深度约为3~5 mm,两电极间距离约为4~6 mm。刺激方式为正方波刺激(频率60 Hz、波宽1 ms),刺激电流从0 mA开始,至出现动作电位。测定面神经传导速度(nerve conduction velocity,NCV)、潜伏期(Latency)及动作电位的波幅(Amplitude)。
1.9 大鼠吻合处神经组织中HGF基因mRNA转录的检测
采用RT-PCR法,根据GenBank中登录的HGF(NM 017017)基因设计引物,正向序列:5'-GCTACA CAGGGAATCCTCTCG-3',反向序列:5'-CGTTTCTCC TCGCCTCTCTC-3',扩增片段大小334 bp;内参β-actin(NM 031144)正向序列:5'-CGTTGACATCCG TAAAGACCTC-3',反向序列:5'-TAGGAGCCAGGG CAGTAATCT-3',扩增片段大小110 bp,引物由武汉谷歌生物科技有限公司合成。用Trizol试剂提取吻合处神经组织RNA,合成cDNA第一链,再以其为模板,进行 PCR扩增,反应条件:94℃ 30 s,54℃,30 s,72℃ 40s,35个循环。mRNA水平用β-actin作为内标,以扩增倍数=2-△△CT表示基因相对表达量。
1.1 0 大鼠吻合处神经组织中HGF蛋白表达的检测
采用Western blot法,按100 mg组织:1 mL细胞裂解液的比例,4℃冰浴匀浆,提取总蛋白。用核酸蛋白定量仪进行蛋白定量。取40 μg蛋白,经12%SDS-PAGE分离,转移至硝酸纤维膜上,用封闭液(5%的脱脂奶粉)室温封闭2 h;加入兔抗鼠HGF多克隆抗体和兔抗鼠 β-actin多克隆抗体(1∶200稀释),37℃孵育2 h;PBST洗膜,加入羊抗兔 IgG(1∶400稀释),37℃孵育2 h;化学发光试剂反应约2 min,发光成像仪呈像并测定条带吸光度值。以目的条带和内参条带吸光度值的比值作为目的蛋白相对表达量。
1.1 1 统计学分析
各实验组做10个样本,实验重复3次。数据以均数±标准差(±s)表示,通过 SPSS18.0软件,采用多个样本均数间两两比较的q检验。
2 结果
2.1 各组大鼠的一般情况
各组大鼠基因转染后无一例死亡,手术切口一期愈合。术后1 d,各组动物均有饮食下降、精神萎靡,右侧面神经受损后,胡须集中伸直,不能摆动,鼻尖偏向左侧,表现为完全性面瘫。伤后10 d,各组大鼠情况没有明显好转。伤后20 d,A、B、C组情况没有显著改变。D组大鼠右侧胡须仍集中倒状,但少量胡须有细微的摆动,鼻尖仍向左偏斜。伤后28 d,A、B、C组大鼠虽然有明显的改变,但没有完全恢复。D组大鼠右侧胡须大部分向前竖起,可见节律性摆动,鼻尖居正中,大鼠右眼可以闭合。局部皮肤红肿消退,感觉障碍,肌肉萎缩也较其余3组轻。
2.2 神经电生理检测
D组面神经传导速度、神经电位波幅明显高于其余3组,潜伏期明显低于其余3组(P<0.05)。C组面神经传导速度、神经电位波幅明显高于A、B两组(表1)
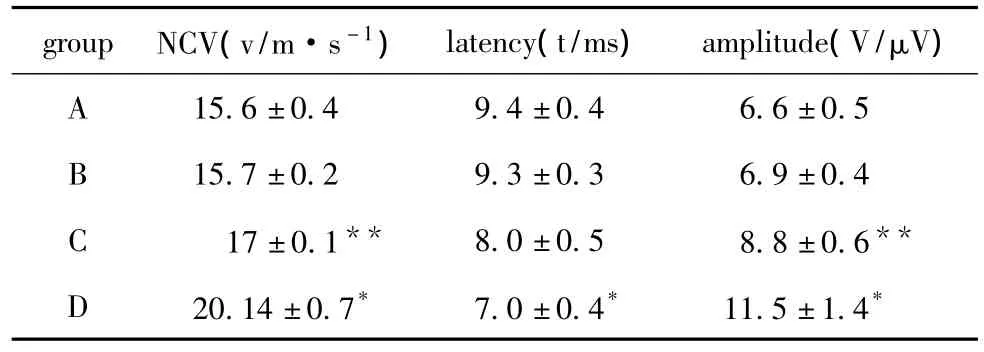
表1 28 d后各组大鼠面神经传导指标比较Table 1 Comparison of facial nerve conduction indices among 4 groups 28 day after(x ± s,n=10)
2.3 各组大鼠吻合处神经组织中HGF基因mRNA的转录水平
D组损伤面神经中HGF mRNA表达量明显高于A、B、C组(P<0.05)。C组损伤面神经中HGF mRNA表达量明显高于A、B组(P<0.05)(图1)。
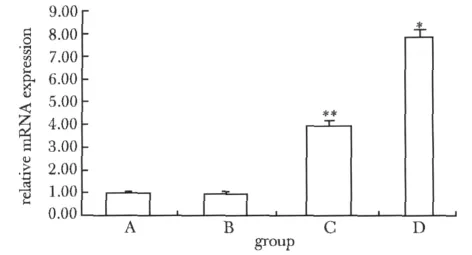
图1 RT-PCR检测大鼠HGF mRNA的表达Fig 1 HGF mRNA expression in rat was detected by real-time RT-PCR(x ± s,n=10)
2.4 各组大鼠吻合处神经组织中HGF蛋白的表达水平
D组损伤面神经中HGF蛋白表达量明显高于A、B、C组(P<0.05)。C组损伤面神经中HGF蛋白表达量明显高于A、B组(P<0.05)(图2,3)。
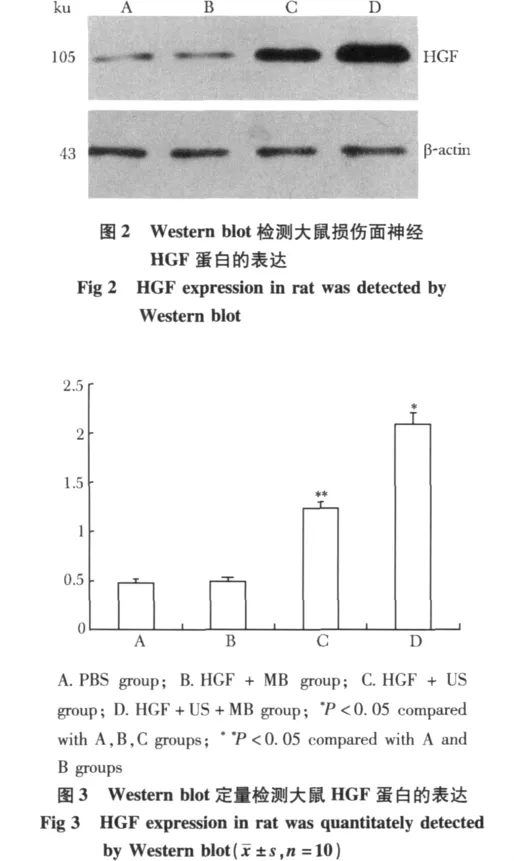
3 讨论
基因治疗主要目的是纠正基因水平上蛋白质异常表达,通过基因治疗方式导入神经生长因子的目的基因,使已降低的神经生长因子恢复到正常水平[8]。目前将外源基因转染靶细胞的载体主要有病毒载体与非病毒载体。病毒载体效率高,但细胞毒性高、免疫原性强;非病毒类载体较安全,但效率低[9]。因此选择一个合理、安全及高效的给药方式尤为重要。
本研究以HGF作为治疗基因,采用超声靶向破坏微泡技术将HGF转染入受损面神经周围。微泡造影剂已被证明是一种新型、安全及高效的基因载体。当微泡造影剂被注射到静脉后,微泡造影剂会到达受损面神经局部。此时在靶区给予一定强度和频率的超声辐照,受损面神经周围的微泡会破裂,从而释放出HGF基因并通过细胞膜产生的小孔进入细胞,达到转染目的。从结果可以得出,D组大鼠无论是触须摆动、鼻尖位置还是能否完全闭眼均明显优于其他3组。D组大鼠面神经传导速度、诱发电位波幅以及潜伏期明显优于其他3组,D组HGF蛋白及mRNA的表达量也显著高于A、B、C组,说明脂质微泡能有效的与目的基因相结合,在一定频率及强度超声的作用下,能将目的基因转染入受损的面神经,为建立修复损伤面神经的微环境提供安全有效的保障。此外,C组与A、B两组之间统计学意义也有显著差异,说明C组也可以将HGF转染入受损面神经周围,这是因为超声自身具有的机械效应和热效应能将HGF基因转染入靶细胞或靶组织,只是相比D组的转染效率要弱。这是因为载基因微泡在一定频率和强度超声作用下破裂,产生的空化效应所致。
综上所述,本实验表明超声微泡可以提高基因的转染效率,从而验证了超声微泡介导HGF转染的潜在应用价值,它能够作为一种有效的非病毒基因转染载体,为面神经损伤的基因治疗提供实验依据。
[1]Zheng LF,Wang R,Yu QP,et al.Expression of HGF/c-
Met is dynamically regulated in the dorsal root ganglions and spinal cord of adult rats following sciatic nerve ligation[J].Neurosignals,2010,18:49 -56.
[2]Hobara N,Yoshida N,Goda M,et al.Neurotrophic effect of hepatic growth factor(HGF)on reinnervation of perivas-cular calcitonin gene-related peptide(CGRP)-containing nerves following phenol-induced nerve injury in the rat mesenteric artery[J].J Pharmacol Sci,2008,108:495 - 504.
[3]Kato N,Nemoto K,Nakanishi K,et al.Nonviral HVJ(hemagglutinating virus of Japan)liposome-mediated retrograde gene transfer of human hepatocyte growth factor into rat nervous system promotes functional and histological recovery of the crushed nerve[J].Neurosci Res,2005,52:299 -310.
[4]Koh SH,Baik W,Noh MY,et al.The functional deficiency of bone marrow mesenchymal stromal cells in ALS patients is proportional to disease progression rate[J].Exp Neurol,2012,233:472 -480.
[5]Shi E,Jiang X,Wang L,et al.Intrathecal injection of hepatocyte growth factor gene-modified marrow stromal cells attenuates neurologic injury induced by transient spinal cord ischemia in rabbits[J].Anesthesiology,2010,113:1109 -1117.
[6]Li Z,Peng J,Wang G,Yang Q,et al.Effects of local release of hepatocyte growth factor on peripheral nerve regeneration in acellular nerve grafts[J].Exp Neurol,2008,214:47-54.
[7]代喻兵,骆文龙,陈红江,等.面神经损伤后rhEPO对面运动神经元的保护作用[J].中国康复医学杂志,2008,2:491-494.
[8]胡智兴,耿菊敏,梁道明,等.肝细胞生长因子减轻皮质神经元的缺氧/复氧损伤[J].基础医学与临床,2010,30:369-373.
[9]刘铖,阙海萍,靳继德,等.肝细胞生长因子延长原代培养大鼠脊髓神经元的生存时间[J].基础医学与临床,2006,26:957-961.
