登革病毒4型E蛋白的表达与多克隆抗体的制备
2012-09-15李竹石杨会强曾献武刘莉娜俞永新李玉华
李竹石,林 华,杨 健,杨会强,曾献武,赵 宇,刘 俐,刘莉娜,康 庄,俞永新,李玉华*
(1.中国生物技术集团公司成都生物制品研究所有限责任公司,四川成都610023;2.中国食品药品检定研究院,北京100050)
登革病毒(Dengue virus,DENV)属于黄病毒科黄病毒属,分为1、2、3和4这4个不同的血清型,是一类经蚊媒传播的单股正链RNA病毒。登革病毒可引起登革热(Dengue fever,DF)及更严重的登革出血热(Dengue hemorrhagic fever,DHF)与登革休克综合征(Dengue shock syndrome,DSS),目前尚无特异性药物与疫苗问世,因此已成为全球尤其是热带与亚热带地区人群健康的主要威胁之一。根据WHO发布的信息,全球每年约有1亿登革热患者,死亡达2.5万人。近年来,登革热在我国的发病率亦呈显著上升趋势[1-3]。
登革病毒基因组编码3个结构蛋白(C、prM、E)和7 个非结构蛋白(NS1、NS2a、NS2b、NS3、NS4a、NS4b和NS5)。其中,结构蛋白E包括3个结构域:I区、II区和III区,其中III区含有IgG免疫球蛋白样折叠,并通过二硫键稳定自身结构,是登革病毒与宿主细胞结合的主要位点,也是诱导机体产生保护性中和抗体和血凝抑制抗体的主要部位[4-9]。本研究分别将去除C端跨膜区的登革病毒4型E蛋白(DENV4E,402AA)以及 E 蛋白 III区(DENV4EIII,126AA)克隆到pET-32a(+)质粒中,构建两种蛋白的表达载体,并利用 IPTG分别诱导 DENV4E与DENV4EIII蛋白在原核细胞中大量表达,以表达的蛋白免疫家兔并采集血清,分别制备出针对DENV4E与DENV4EIII蛋白的多克隆抗体,并对其进行鉴定,从而为进一步的研究提供依据。
1 材料与方法
1.1 材料
Rosetta感受态细胞和pET-32a(+)质粒(成都生物制品研究所有限责任公司病毒疫苗研究室保存);TOP10感受态细胞(北京天根公司);含有登革病毒4型(814669株)E蛋白编码序列的TOPOD4prM/E质粒(上海英骏生物技术有限公司构建);登革病毒4型(H241株)(美国疾病控制与预防中心提供);PrimeSTAR DNA聚合酶与异丙基-β-D-硫代吡喃半乳糖苷(IPTG)(Takara公司);凝胶回收试剂盒与质粒抽提试剂盒(Qiagen公司);BamHⅠ、XhoⅠ限制性内切酶以及T4 DNA连接酶(NEB公司);脱脂奶粉(BD公司)、碱性磷酸酶标记的山羊抗兔IgG、BCIP/NBT碱性磷酸酶显色试剂盒(上海碧云天生物技术研究所);弗氏完全佐剂与不完全佐剂(Sigma-Aldrich公司);核苷酸序列测定(上海英骏生物技术有限公司);免疫用雌性家兔(普通级,体质量2.5~3.5 kg)[成都生物制品研究所有限责任公司动物室,许可证号SCXK(川)2011-08]。
1.2 pET32-DENV4E与pET32-DENV4EIII表达载体的构建与鉴定
根据登革病毒4型(814669株)序列(GenBank登录号AF326573.1)设计引物,用于扩增DENV4E与DENV4EIII片段(去除C端跨膜区),引物由上海英骏生物技术有限公司合成,序列如下:DENV4E:5'-CGCGGATCCATGCGATGCGTAGGAGTAGGAAAC-3'(正向,下划线部分为BamHⅠ酶切位点);5'-C CGCTCGAGTTAAAACATCTTGCCAATGGAACTCC-3'(反向,下划线部分为XhoⅠ酶切位点);DENV4EIII:5'-CGCGGATCCTGCAAAGTCCGTATGGAGAAA-3'(正向,下划线部分为BamHⅠ酶切位点);5'-CCGCTC GAGTTATTTTGCACCTCTGTATGTGGACT-3'(反向,下划线部分为XhoⅠ酶切位点)。
以 TOPO-D4prM/E质粒为模板,采用 Prime-STAR DNA聚合酶扩增DENV4E与DENV4EIII片段,切胶回收扩增产物,回收产物与pET-32a(+)质粒经BamHⅠ/XhoⅠ双酶切后通过T4 DNA连接酶进行连接,连接产物转化TOP10感受态细胞后挑取克隆,对重组质粒进行BamHⅠ/XhoⅠ双酶切鉴定以及测序分析,将插入序列正确的重组质粒分别命名为pET32-DENV4E和pET32-DENV4EIII。
1.3 DENV4E与DENV4EIII蛋白的表达
分别用 pET-32a(+)质粒、pET32-DENV4E以及pET32-DENV4EIII表达载体转化Rosetta感受态细胞,阳性克隆经扩大培养后,在37℃以1 mmol/L IPTG诱导表达4 h,离心收集菌体,通过SDS-PAGE检测DENV4E和DENV4EIII蛋白表达,并以裂解缓冲液重悬菌体,冰浴中超声裂解,离心收集上清液和沉淀,通过SDS-PAGE检测DENV4E和DENV4EIII蛋白为可溶性表达或是以包涵体形式表达。
先后以2 mol/L尿素洗涤和8 mol/L尿素溶解DENV4E与DENV4EIII包涵体,通过 SDS-PAGE检测蛋白纯度,并采用Lowry法测定蛋白浓度。
1.4 DENV4E与DENV4EIII多克隆抗体的制备
分别用表达的DENV4E与DENV4EIII蛋白免疫家兔,首次免疫后14及21 d进行加强免疫,首次免疫以弗氏完全佐剂乳化,加强免疫以弗氏不完全佐剂乳化,每次免疫的蛋白量约为1 mg。另以8 mol/L尿素免疫家兔作为对照。末次免疫后7 d采集血清。
1.5 多克隆抗体的Western blot鉴定
取适量登革病毒4型(H241株)全病毒裂解物进行12%SDS-PAGE电泳,蛋白电转移至硝酸纤维素膜,以溶解于PBS的5%脱脂牛奶室温封闭1 h,然后用上述制备的多克隆抗体以及阴性对照血清(牛奶稀释,稀释度均为1∶40)4℃孵育过夜。PBS洗膜,以碱性磷酸酶标记的羊抗兔IgG室温孵育1.5 h,PBS洗膜后以BCIP/NBT碱性磷酸酶显色试剂盒显色。
2 结果
2.1 pET32-DENV4E与 pET32-DENV4EIII表达载体的构建与鉴定
PCR扩增得到的 DENV4E(1206 bp)与DENV4EIII(378 bp)片段分别插入pET-32a(+)质粒后,取大小正确的重组质粒(图1)进行BamHⅠ/XhoⅠ双酶切鉴定,结果与预期一致(图2)。核苷酸序列测定显示插入片段与目的片段序列完全一致且读码框正确。
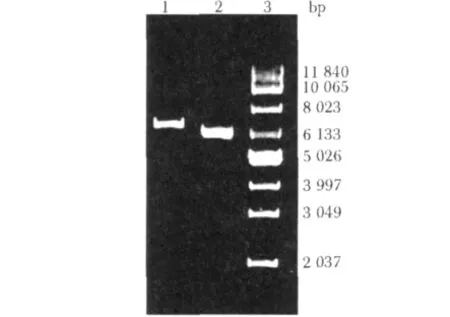
图1 pET32-DENV4E与pET32-DENV4EIII表达载体Fig 1 pET32-DENV4E and pET32-DENV4EIII expression vectors
2.2 DENV4E与DENV4EIII蛋白的诱导表达
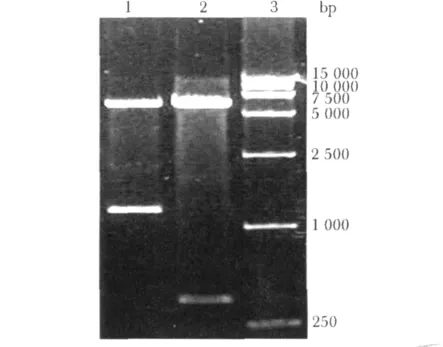
图2 pET32-DENV4E与pET32-DENV4EIII表达载体的酶切鉴定Fig 2 Restriction enzyme digestion of pET32-DENV4E and pET32-DENV4EIII
含有 pET32-DENV4E与 pET32-DENV4EIII表达载体的Rosetta感受态细胞经IPTG诱导表达后,可见明显蛋白条带,分别与DENV4E和DENV4EIII蛋白的预期相对分子质量相符(DENV4E:64 ku;DENV4EIII:33 ku)(图3)。菌体经超声裂解后,结果显示两种蛋白主要以包涵体的形式存在于沉淀中(图4)。以尿素洗涤和溶解包涵体,能够得到纯度较高的DENV4E和DENV4EIII蛋白(图5)。蛋白浓度可达1.0 g/L左右。

图3 Rosetta菌体裂解物的SDS-PAGE检测Fig 3 SDS-PAGE of Rosetta cell lysates
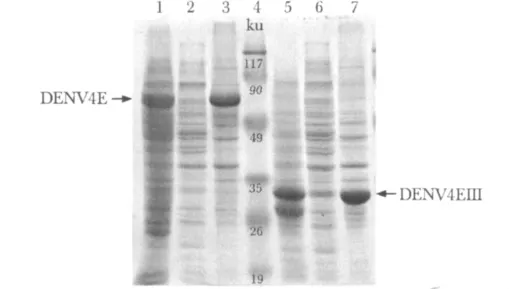
图4 Rosetta菌体超声裂解后上清液与沉淀的SDS-PAGE检测Fig 4 SDS-PAGE of the supernatant and pellet of Rosetta cells after sonication
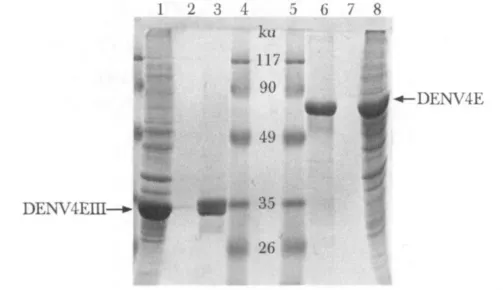
图5 DENV4E与DENV4EIII蛋白经纯化后的SDS-PAGE检测Fig 5 SDS-PAGE of purified DENV4E and DENV4EIII proteins
2.3 多克隆抗体的Western blot鉴定
DENV4E、DENV4EIII多克隆抗体与登革病毒4型(H241株)全病毒裂解物杂交后,均在病毒E蛋白相应位置(55 ku)出现明显条带,而阴性对照血清与全病毒裂解物杂交后未出现条带(图6)。

图6 多克隆抗体对登革病毒4型的Western blot检测Fig 6 Western blot of dengue virus type 4 using the prepared polyclonal antibody
3 讨论
位于登革病毒表面的E蛋白是其最主要的结构蛋白,介导诸多功能。E蛋白包括Ⅰ、Ⅱ、Ⅲ区等3个结构域,其中III区为IgG免疫球蛋白样结构域,含有型和亚型特异性抗原表位,可诱导机体产生中和抗体[4-9]。由于目前尚无市售的针对登革病毒4型E蛋白的特异性抗体,因此对该型病毒的研究造成了一定困难。为解决这一问题,本研究在原核细胞中表达登革病毒4型E蛋白与E蛋白III区,并通过免疫家兔制备多克隆抗体。为提高目的蛋白的表达效率,本研究去除了 E蛋白编码序列 C端约300 bp的跨膜区,获得了表达量较好的蛋白,其结果与文献[10]的研究结果一致。此外,本研究以pET-32a(+)质粒作为载体,表达出硫氧还蛋白与目的蛋白的融合蛋白,以促进目的蛋白的可溶性表达。但在对表达温度、时间及IPTG浓度等条件进行优化后,并不能显著增大蛋白的可溶性,DENV4E与DENV4EIII蛋白仍然主要以包涵体的形式表达。经尿素洗涤、溶解后,蛋白浓度可达1.0 g/L左右,可达到本研究的需求。推测两种蛋白以包涵体的形式表达可能是由其序列本身所决定的。
登革病毒4型完整E蛋白的相对分子质量为55 ku,去除C端跨膜区的E蛋白及其III区分别为45与14 ku,由于N端融合了硫氧还蛋白,因此最终表达的DENV4E与DENV4EIII分别为64与33 ku。尽管并非完整的E蛋白,但由于两者均含有E蛋白的主要抗原表位,因此两者足以诱导家兔产生高水平的免疫反应,所制备的多克隆抗体能够从登革病毒4型全病毒裂解物中成功检测到完整的病毒E蛋白(55 ku)。需要指出的是,所制备的抗体在对病毒裂解物进行检测时出现了非特异性条带,其原因可能是因为多抗的特异性无法与单抗相比,以及病毒表面的E蛋白同源二聚体可能与多抗发生反应。但总体而言,考虑到目标条带清晰,且非特异性条带未对结果造成干扰,因此本研究制备的多克隆抗体的检测效果是可接受的。该研究结果为登革病毒E蛋白抗原表位肽及登革亚单位疫苗的研究提供了依据,也解决了登革疫苗开发中所面临的抗登革病毒抗体缺乏的瓶颈问题。
[1]Murphy BR,Whitehead SS.Immune response to dengue virus and prospects for a vaccine [J].Annu Rev Immunol,2011,29:587-619.
[2]Dussart P,Baril L,Petit L,et al.Clinical and virological study of dengue cases and the members of their households:the multinational DENFRAME project[J].PLoS Negl Trop Dis,2012,6:1482.
[3]Gubler DJ.Epidemic dengue/dengue hemorrhagic fever as a public health,social and economic problem in the 21 st century[J].Trends Microbiol,2002,10:100 -103.
[4]Rey FA.Dengue virus envelope glycoprotein structure:new insight into its interactions during viral entry[J].Proc Natl Acad Sci USA,2003,100:6899-6901.
[5]Chen Y,Maguire T,Marks RM.Demonstration of binding of dengue envelope protein to target cells [J].J Virol,1996,70:8765-8772.
[6]Hung JJ,Hsieh MT,Young MJ,et al.An external loop region of domain III of dengue virus type 2 envelope protein is involved in serotype-specific binding to mosquito but not mammalian cells[J].J Virol,2004,78:378 -388.
[7]Mota J,Acosta M,Argotte R,et al.Induction of protective antibodies against dengue virus by tetravalent DNA immunization of mice with domain III of the envelope protein [J].Vaccine,2005,23:3469-3476.
[8]Van Der Schaar HM,Wilschut JC,Smit JM.Role of antibodies in controlling dengue virus infection [J].Immunobiology,2009,214:613 -629.
[9]Volk DE,May FJ,Gandham SH,et al.Structure of yellow fever virus envelope protein domain III [J].Virology,2009,394:12-18.
[10]Deubel V,Bordier M,Megret F,et al.Processing,secretion,and immunoreactivity of carboxyl terminally truncated dengue-2 virus envelope proteins expressed in insect cells by recombinant baculoviruses[J].Virology,1991,180:442-447.
