齐墩果酸对抗小鼠胰岛细胞糖脂毒性和凋亡促进胰岛素分泌
2012-09-15程路峰张东辉毛新民李学军
张䶮之,程路峰,张东辉,张 燕,毛新民,李学军
(1.新疆医科大学䶮基础医学院药理教研室;2.新疆医科大学中医学院;3.兰州军区乌鲁木齐总医院,新疆乌鲁木齐830011;4.北京大学医学部,北京100191)
齐墩果酸(Oleanolic acid,OA)是一种五环三萜类化合物,临床上用为保肝药,是女贞子、石榴等许多中药的活性成分之一。近年来研究发现OA具有改善糖耐量、保护糖尿病肾脏、激动PPARγ,激活酪氨酸磷酸酶Shp2等作用,可能是一个有潜力的抗糖尿病的天然物质[1-5],齐墩果酸降糖作用可能与其能促进胰岛素分泌有关[6]。但对其在长期糖脂毒状态下对胰岛细胞的作用未见报道。本实验观察了OA在高糖脂毒环境下对原代培养胰岛细胞分泌功能的影响,并从其对胰岛细胞增殖与凋亡的影响探讨其可能的机制。
1 材料与方法
1.1 药品与试剂
齐墩果酸、双硫棕、台盼蓝、噻唑蓝(MTT)和胰蛋白酶(Sigma公司);Annexin-FITC/PI双染试剂盒(Invetrogene公司);胰岛素放射免疫分析试剂盒(北京北方生物技术研究所);DMEM完全培养液和胎牛血清(Gibco公司);格列苯脲(Glibenclamide,天津太平洋制药公司),棕榈酸(palmitic acid,PA),碘乙酸均为CP级。
1.2 小鼠原代胰岛细胞培养
参照参考文献[7]等方法,经形态学鉴定、活力及生物学功能鉴定合格后,备用。
1.3 胰岛素分泌功能测定
将胰岛细胞数调整为2×105~5×105个/mL,每孔加胰岛细胞悬液1.0 mL,接种于24孔培养板中,分别加入低糖(5.6 mmol/L葡萄糖),高糖脂(30 mmol/L葡萄糖+0.5 mmol/L棕榈酸),高糖脂+阳性对照格列苯脲(25 mg/L),高糖脂+不同浓度OA(5、10和20 mg/L)进行培养,每组4复孔,2和5 d后吸取培养液上清,用放射免疫法测定胰岛素含量。
1.4 胰岛细胞增殖活力测定
培养良好的胰岛细胞用胰蛋白酶消化成含2×104~5×104个/mL的单细胞悬液,接种于96孔培养板中,低糖、高糖脂及药物不同浓度干预组每组各设5复孔,并设不含细胞只含培养液的空白调零孔,37℃,5%CO2,饱和湿度培养箱中培养2和5 d后,每孔加入20 μL 5 g/L的MTT溶液继续培养4 h,吸出培养后加入200 μL二甲基亚砜,使结晶物溶解均匀,酶标仪490 nm处测定吸光度。
1.5 胰岛细胞凋亡测定
将生长良好的胰岛细胞接种于6孔培养板中,分别加低糖、高糖脂及药物+高糖脂培养基2 mL,每组设3个复孔,干预6 d后收集细胞,冷PBS洗,洗后细胞再离心,弃上清重悬细胞用1×Annexin-binding缓冲液稀释至1×106个/mL,加入AV,PI室温避光孵育15 min,样品置冰上尽快用流式细胞仪530 nm检测荧光发射。
1.6 统计学分析
SPSS13.0统计软件进行统计学分析,计量数据用均数±标准差(±s)表示,AVON单因素方差分析后进行多组间均数比较。
2 结果
2.1 齐墩果酸对高糖脂培养胰岛细胞胰岛素分泌的作用
高糖脂培养2 d胰岛素分泌降低,5 d时显著低于正常低糖培养组(P<0.01),5 mg/L OA干预2 d胰岛素分泌明显高于高糖脂组,20 mg/L OA干预组在第5天胰岛素分泌显著高于高糖脂组(P<0.05)(表1)。
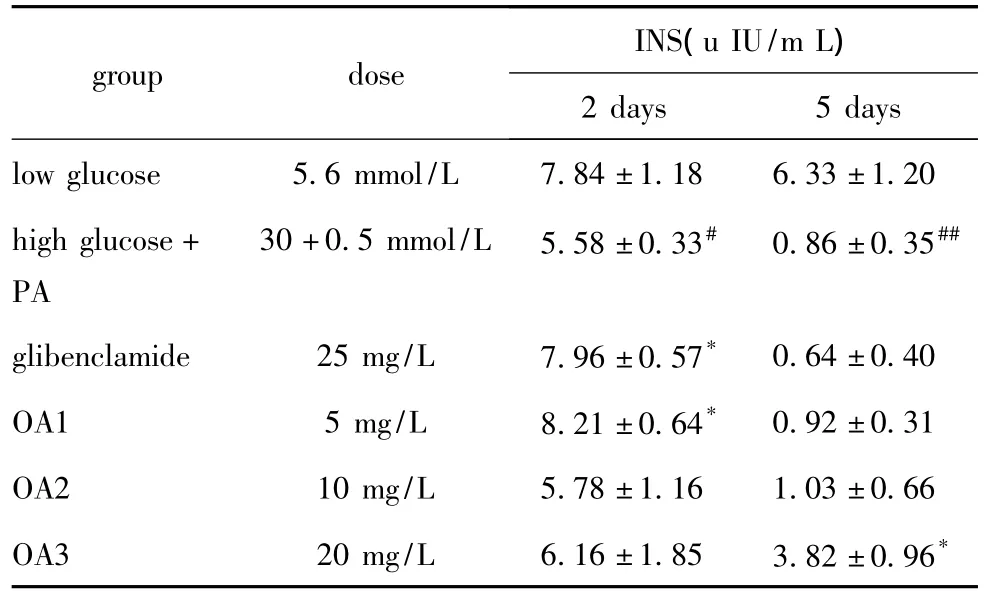
表1 OA对高糖脂培养胰岛细胞insulin分泌功能的影响Table 1 Effects of OA on insulin secretion of islet cell under glucose and fat cultivation(x ± s,n=4)
2.2 齐墩果酸对高糖脂培养胰岛细胞增殖活力的影响
高糖脂培养2 d胰岛细胞增殖与低糖培养组比较没有显著差异,而第5天高糖脂毒对胰岛细胞活力的抑制作用明显,第5天时,5和10 mg/L OA药物干预组及阳性对照组细胞增殖作用显著高于高糖脂组(P<0.05)(表2)。
2.3 齐墩果酸对高糖脂培养胰岛细胞凋亡的影响
原代胰岛细胞正常低糖培养基培养6 d,细胞凋亡率为3.9%,高糖脂联合培养组细胞凋亡率为15.1%,10 mg/L齐墩果酸干预组胰岛细胞凋亡率为7.4%,凋亡率显著降低(图1)。
3 讨论
近年来糖尿病治疗从关注胰岛素外周靶器官转变到更关注胰岛本身,英国糖尿病联盟[8]前瞻性研究显示,糖尿病患者胰岛素分泌功能随病程进展进行性下降,直至耗竭,绝大多数患者不得不依靠外源性胰岛素控制血糖,因此提出保护胰岛细胞功能,抑制胰岛细胞凋亡对延缓糖尿病进展有重要意义。

表2 OA对高糖脂培养胰岛细胞活力的影响Table 2 Effect of OA on islet cell viability under glucolipotoxicity(x ± s,n=5)
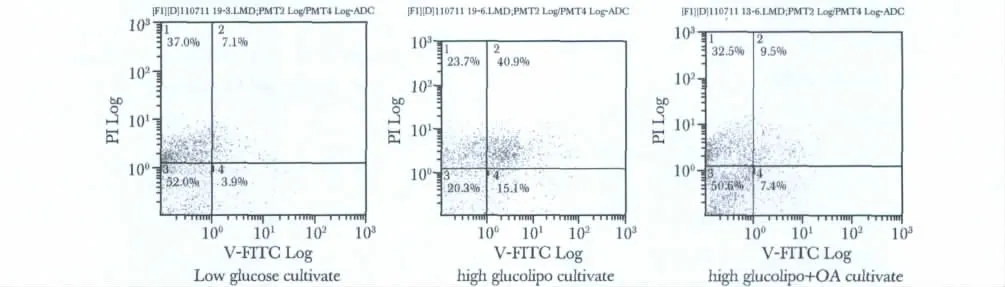
图1 低糖、高糖脂、高糖脂+OA分别培养6 d对原代培养胰岛细胞凋亡的影响Fig 1 Apoptosis of primary cultured islet cell under low level glucose,high glucolipo,high glucolipo+OA culture respectively
高糖脂毒性能抑制胰岛素胞吐环节,引起胰岛素含量衰竭,胰岛素前体分子增加,进行性DNA片断增加以及暂时的β细胞增殖反应等,毒性机制涉及胰十二指肠同源盒因子-1(PDX-1)及肌腱膜纤维肉瘤癌基因同源核A(MafA)结合活性的降低,基因表达的抑制等[9]。本研究显示高糖脂培养初期对胰岛细胞增殖活力影响不明显,但对胰岛素分泌抑制作用已经显著并且随时间推移持续增强,甚至耗竭。天然多酚齐墩果酸有一定对抗糖脂毒性促胰岛素分泌作用,小剂量(5 mg/L)OA促胰岛素分泌作用强,但短暂,作用特点类似25 mg/L格列本脲,而稍大剂量OA(20 mg/L)作用平缓持久,原因有待进一步研究。
高糖脂毒性能抑制细胞增殖加速胰岛细胞凋亡[10],内质网应激、线粒体DNA损伤等参与了凋亡过程[11-12],本实验发现OA具有一定有促进胰岛细胞增殖,对抗糖脂毒诱导的胰岛细胞凋亡作用,这可能是其保护胰岛细胞的机制之一。有趣的是OA及格列本脲促细胞增殖与促胰岛素分泌效果的显现时间上呈不同步现象,推测胰岛素分泌匮乏时可能会代偿性的促进胰岛细胞增殖,胰岛素分泌及细胞增殖过程周期不同不是呈直线式而是有峰谷现象造成,OA抗凋亡作用的具体分子机制有待进一步研究。
本实验前期研究显示,石榴皮乙酸乙酯提取物有对抗高糖脂毒促进胰岛素分泌的作用,而齐墩果酸、鞣花酸及没食子酸等是该提取物主要成分,本实验进一步表明齐墩果酸具有一定抗糖脂毒促胰岛素分泌作用,但依赖于合适的浓度及作用时间,齐墩果酸抗凋亡的机制靶点及其与其他多酚类是否存在协同作用等都是进一步研究的方向。
[1]Wang ZH,Hsu CC,Huang CN,et al.Anti-glycative effects of oleanolic acid and ursolic acid in kidney of diabetic mice[J].Eur J Pharmacol,2010,628:255-260.
[2] de Melo CL,Queiroz MG,Fonseca SG,et al.Oleanolic acid,a natural triterpenoid improves blood glucose tolerance in normal mice and ameliorates visceral obesity in mice fed a high-fat diet[J].Chem Biol Interact,2010,185:59-65.
[3]Christensen KB,Jørgensen M,Kotowska D,et al.Activation of the nuclear receptor PPARγ by Metabolites isolated from sage(Salvia officinalis L.)[J].J Ethnopharmacol,2010,132:127-133.
[4]Bu Y,Shi T,Meng M,et al.A novel screening model for the molecular drug for diabetes and obesity based on tyrosine phosphatase Shp2[J].Bioorg Med Chem Lett,2011,21:874-878.
[5]Wang X,Li YL,Wu H,et al.Antidiabetic effect of oleanolic acid:a promising use of a traditional pharmacological agent[J].Phytother Res,2011,25:1031-1040.
[6]Teodoro T,Zhang L,Alexander T,et al.Oleanolic acid enhances insulin secretion in pancreatic beta-cells[J].FEBS Lett,2008,582:1375-1380.
[7]姚海,王烨,徐永华,等.石榴皮乙酸乙酯提取物对胰岛细胞生长活力的影响,新疆医科大学,2010,33:1168-1170.
[8]Mark Evans.The UK Prospective Diabetes study[J].The Lancet,1998,352:1932-1933.
[9]Harmon JS,Stein R,Robertson RP.Oxidative stress-mediated,post-translational loss of MafA protein as a contributing mechanism to loss of insulin gene expression in glucotoxic beta cells[J].J Biol Chem,2005,280:11107-11113.
[10]王威,曹翠平,陈颖,等.棕榈酸诱导胰岛素瘤细胞MIN6细胞凋亡[J].基础医学与临床,2010,30:401-405.
[11]杨燕丽,向若兰,孙琦.内质网应激参与糖脂毒性引起的胰岛 beta细胞凋亡[J].基础医学与临床,2009,29:1337-1339.
[12]Yuzefovych LV,Solodushko VA,Wilson GL.Protection from palmitate-induced mitochondrial DNA damage prevents from mitochondrial oxidative stress,mitochondrial dysfunction,apoptosis,and impaired insulin signaling in rat L6 skeletal muscle cells[J].Endocrinology,2012,153:92-100.
