利用基因芯片分析小麦茎秆伸长过程中的基因表达谱
2012-09-15王创云王陆军侯雅静李海燕
王创云 ,吴 曦 ,王陆军 ,赵 丽 ,侯雅静 ,李海燕
(1.山西腾达种业有限公司,山西太原030031;2.山西省农业科学院作物科学研究所,山西太原030032;3.太原市星火技术发展中心,山西太原030009)
株型是小麦品种改良的重要目标性状,其中茎秆是最重要的株型性状。近年来,随着植物生物技术,特别是基于基因芯片的高通量差异表达分析技术的迅速发展,促进作物生长发育过程中的基因表达谱研究取得了新的进展[1],克隆了一批控制株型性状的基因,这对于阐明作物生长发育过程的分子调控机制、通过分子手段改造株型及开展分子育种具有重要意义。
目前,利用基因芯片技术分析植物基因表达谱的研究主要集中在拟南芥和水稻等模式植物上[2],而对小麦的相关研究较少。李荣华等[3]采用基因芯片技术分析了铝胁迫下小麦的基因表达谱,马璐琳等[4]利用Affymetrix芯片分析了DON诱导抗赤霉病小麦品种望水白的基因表达谱。
本研究利用Affymetrix小麦基因芯片分析了郑麦9023茎秆伸长过程中的基因表达谱,获得了一批与小麦茎秆伸长相关的候选基因,为进一步探讨小麦茎秆伸长的分子机制积累了资料。
1 材料和方法
1.1 试验材料
温室种植小麦品种郑麦9023,选取生长一致的植株用于取材。分别剥取拔节前期及拔节过程中的基部茎节组织,迅速在液氮中速冻,置于-80℃冰箱中保存备用[5]。用于基因差异表达分析的组织材料包括:拔节前期:拔节前的基部茎节组织(V1)、第1节长度为2 mm的茎节组织(V2);拔节后期:第1节长度为5 mm的茎节组织(V3)、第1节长度为10 mm的茎节组织(V4)。
1.2 RNA抽提和探针合成
利用TRIzol(美国Invitrogen公司)方法提取各材料的总RNA,并采用RNeasy Mini Kit(德国Qiagen公司)纯化总RNA,利用One-cycle cDNA SynthesisKit(美国Affymetrix公司)合成ds cDNA,并用 GeneChip Sample Cleanup Module(美国Affymetrix公司) 纯化该 cDNA。然后按照GeneChip IVT LabelingKit说明书制备生物素标记的cRNA,于94℃保温35 min后进行片段化处理,并作为杂交探针用于基因芯片分析。
1.3 芯片杂交及数据分析
采用Affymetrix公司的小麦基因组芯片,其中含有代表55 052个小麦转录本的61 127个探针组(http://www.affymetrix.com)。首先,用检测芯片(test chip)检测片段化cRNA的质量。然后取适量cRNA与试验芯片(experimental chip)杂交,按照试验流程进行洗涤、扫描后,用Affymetrix Microarray Suite 5.0软件对杂交图像进行分析,并对数据均一化。按照芯片上杂交信号的强弱将基因的表达情况分为表达、模糊表达和不表达共3种类型,并对4张芯片的杂交数据进行比较。
1.4 基因功能注释和分类
通过Affymetrix的NetAffx Analysis Center查询和NCBI的BLASTx分析,对差异表达基因进行功能注释,并通过MIPS数据库检索,将候选基因按照功能分类[6]。
2 结果与分析
2.1 小麦芯片杂交数据比较
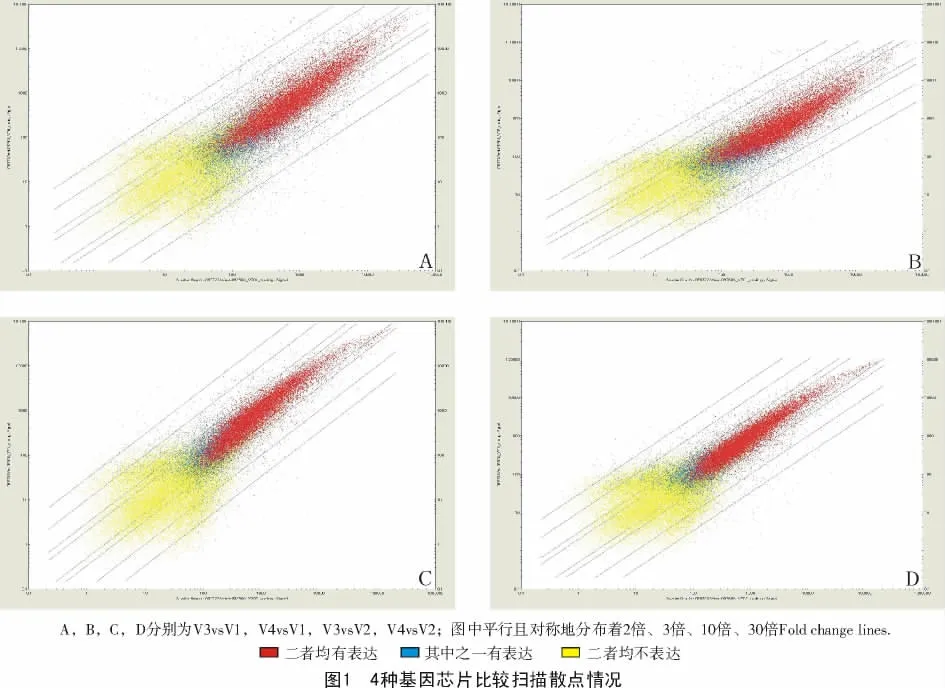
将拔节后期的2个芯片数据(V3,V4)分别与拔节前期的2个芯片数据(V1,V2)比较,得到4种基因表达差异情况散点图(图1)。其更直观地显示了小麦拔节不同时期基因表达量的比例信息和信号强度的关系。由图1可知,小麦拔节前后有一定数量的基因存在表达差异(图1偏离45°中线的点),其中,既有上调表达的基因,又有下调表达的基因,本试验选取2倍线以外的基因转录产物为差异性表达基因。
2.2 小麦茎秆伸长过程中的基因差异表达分析
在比较分析小麦拔节前后基因表达差异过程中,试验选择了对小麦茎秆伸长研究有意义且表达差异大于2倍以上的上调高表达基因作为研究对象,以拔节前期的基部茎节组织(V1,V2)为对照,拔节后期与前期分别比较,2.0倍以上的上调表达基因,与V1比较分别有2 708,2 654个,共有差异基因1 554个;与V2比较分别有2 169,1 294个,共有差异基因605个;4个比较共有差异基因172个(表1)。总体来看,小麦差异表达主要表现在第1节长度2 mm到第1节长度5 mm时期。

表1 小麦茎秆伸长过程中的基因差异表达比较分析
2.3 差异表达基因的功能分类
经Affymetrix的NetAffx Analysis Center查询和NCBI的BLASTx分析发现,4个比较中,上调表达2倍以上的基因共有172个,其中的29个已被注释(表2)。
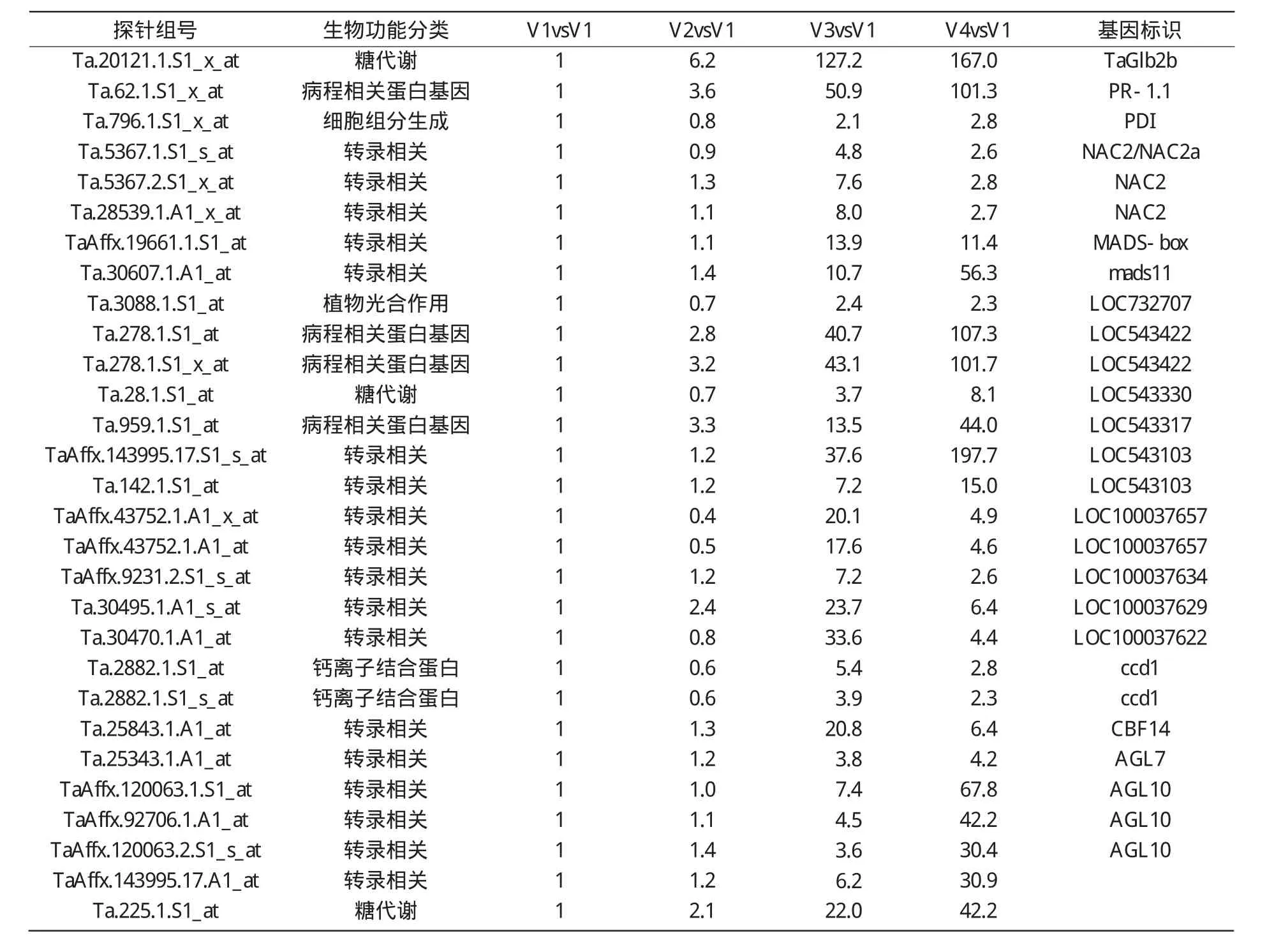
表2 小麦拔节过程中已被注释的29个基因
将经过注释的差异表达基因按照生物学功能分为6类(表3)。
比较各类型基因的数量发现,已注释的候选基因中与转录相关、糖代谢、病程相关蛋白基因占了绝大多数,分别占29个注释基因总数的62.07%,10.34%和13.79%,其他功能基因所占比例较少。在这些表达变化倍数较高的基因中,转录相关基因最多(18个),包括8个MADS-box家族转录因子,6个CAF转录因子,3个NAC类转录因子。
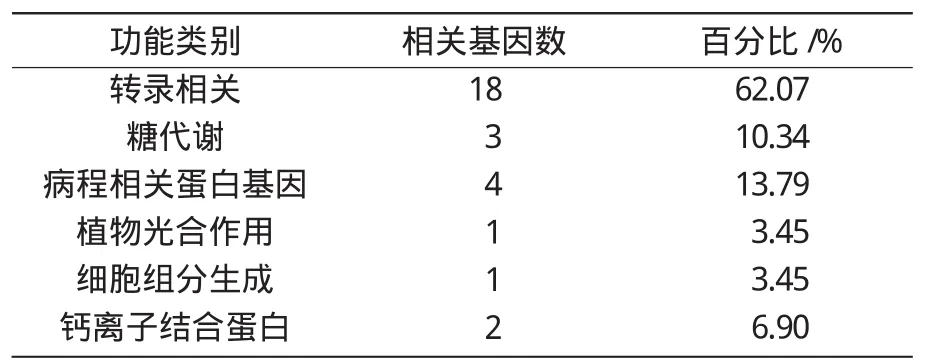
表3 小麦拔节过程中29个已被注释基因生物学功能分类
2.4 小麦茎秆伸长过程中功能基因的差异表达变化
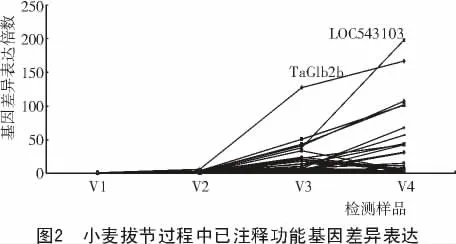
从图2可以看出,变化趋势较大的前10个基因,5个是与转录相关的MADS-box家族基因,且表达趋势都是随着小麦拔节过程逐步加强;3个是与病程相关蛋白基因,2个是与糖代谢相关基因。其中,变化最大的探针编号为TaAffx.143995.17.S1_s_at的 LOC543103是 MADS-box家族基因;变化次之的探针编号为Ta.20121.1.S1_x_at的TaGlb2b是糖代谢相关基因。
3 结论与讨论
小麦茎秆高度是解决倒伏问题的重要途径。以往的研究表明,赤霉素(gibberellin,GA)和油菜素类固醇(brassinosteroid,BR)参与节间的发育过程,另外,多胺也影响植株的高度[7]。与它们共同参与调节茎秆高度的基因主要分为2类,一类影响信号的转导,一类影响生物合成。
转录因子(反式作用因子)基因是植物中最重要的一类调节基因,其在植物体内构成复杂的调节网络,在时间和空间上协同控制基因的表达。转录因子是能够与真核基因启动子区域中顺式作用元件发生特异性作用的DNA结合蛋白,通过它们之间以及与其他相关蛋白之间的相互作用,激活或抑制基因转录[8-9]。
本研究中已经注释的29个与小麦茎秆伸长相关的基因中,有18个与转录相关的基因,所占比例达到62.07%。这与前人研究结果相一致[7]。在18个转录相关基因中,主要包括3类转录因子:MADS-box,CAF和NAC,其中,基因表达差异变化趋势较大的前10个基因中,5个是MADS-box家族转录因子,且表达趋势都是随着小麦的拔节过程而逐步加强,变化最大的LOC543103正是MADS-box家族转录因子。但它们是否直接或间接参与了小麦的GA,BR和多胺的生物合成,以及它们不同的表达模式,这些还有待于进一步研究。
综上所述,在小麦的拔节过程中,有多个MADS-box基因的表达发生了变化,并且在茎节的表达量较高,变化也较为显著,这说明MADS-box基因可能参与了小麦茎秆过程中茎节的伸长,为进一步理解这些基因的功能提供了有利的材料。
[1] Shinozaki K,Yamaguchi-Shinozaki K.Gene networks involved in drought stressresponseand tolerance[J].JExp Bot,2007,58:221-227.
[2]Micheletto S,Rodriguez-Uribe L,Hernandez R,et al.Comparative transcript profiling in roots of Phaseolus acutifolius and P.vulgaris under waterdeficit stress[J].Plant Sci,2007,173:510-520.
[3]李荣华,郭培国.用基因芯片技术分析铝胁迫下小麦的基因表达谱谱[J].生物技术通讯,2007,18(4):581-586.
[4]马璐琳,尚毅,亓增军,等.利用Affymetrix芯片分析DON诱导抗赤霉病小麦品种望水白的基因表达谱 [J].麦类作物学报,2009,29(6):959-964.
[5]王创云,王美霞,卢成达,等.小麦拔节过程中差异表达基因WSR1的克隆及序列分析 [J].山西农业科学,2009,37(3):22-24.
[6] Ruepp A,Zollner A,Maier D,et al.The FunCat,a functional annotation scheme for systematic classification of proteins from wholegenomes[J].Nucl Acids Res,2004,32:5539-5545.
[7]胡珀,天富.植物茎秆性状形成与发育的分子基础[J].植物学通报,2008,25(1):1-13.
[8]王力娜,范术丽,宋美珍,等.植物MADS-box基因的研究进展[J].生物技术通报,2010(8):12-18.
[9]李科友,朱海兰.植物非生物逆境胁迫DREB/CBF转录因子的研究进展[J].林业科学,2011,47(1):124-134.
