山西省猪致病性大肠杆菌血清型调查及耐药性监测
2012-09-15李红丽詹丽娥王彩先陆冰洋
李红丽,詹丽娥,王彩先,唐 娟,陆冰洋
(山西省农业科学院畜牧兽医研究所,山西太原030032)
猪大肠杆菌病是由致病性大肠杆菌引起的仔猪肠道传染性疾病,常见的有仔猪黄痢、仔猪白痢和仔猪水肿病3种,以发生肠炎、肠毒血症、败血症为特征[1-2]。仔猪感染大肠杆菌的发病率为26%~32%,病死率为20%左右,对养猪业为害极大。猪大肠杆菌有数百种血清型,已确定的菌体抗原(O)180种、表面荚膜抗原(K)104种和鞭毛抗原(H)60种。
2011—2012年,从山西省50多个规模化养猪场无菌采集疑似大肠杆菌病死仔猪心、肝、脾、肠系膜淋巴结以及可疑病猪的直肠内容物等病料,进行大肠杆菌分离、血清型鉴定及耐药性检测[3],旨在快速准确地调查清楚存在于山西省猪致病性大肠杆菌的血清型及分布情况,以及根据临床实际情况研发具有针对性的、目前流行血清型的猪大肠杆菌病的预防用多价高效灭活菌苗,筛选出敏感价廉的预防、治疗用药物,建立猪大肠杆菌病的综合防治体系。
1 材料和方法
1.1 病料来源
对山西省50多个规模化养猪场疑似猪大肠杆菌病的病死猪进行剖检,无菌采集发病仔猪心、肝、脾、肠系膜淋巴结以及可疑病猪的直肠内容物等病料,进行致病性大肠杆菌的分离。
1.2 试剂、仪器
营养琼脂培养基粉购自北京奥博星生物技术有限公司,麦康凯培养基粉购自广东环凯微生物科技公司,主要致病性大肠杆菌O抗原定型血清、药敏试验质控标准菌株大肠埃希氏菌(ATCC 25922)购自天津生物芯片技术有限公司,伊红美兰培养基粉、三糖铁培养基粉、营养肉汤、微量生化反应管、药敏纸片购自杭州天和试剂公司。
1.3 试验动物
试验小白鼠 219只(体质量(21.0±2.85)g)购自山西省医科大学实验动物中心。
1.4 细菌分离培养[4-6]
用灭菌棉拭子取黄、白痢病仔猪直肠内容物或无菌采集死亡仔猪心、肝、脾、肠系膜淋巴结等病料,接种于营养肉汤中,37℃培养18~24 h后,取可疑菌液划线接种于麦康凯培养基上,37℃培养18~24 h,取砖红色单个菌落接种于伊红美兰培养基,37℃培养18~24 h后,挑取紫黑色带金属光泽单个菌落接种于营养琼脂培养基平板上,37℃恒温纯化培养12~18 h后,将纯化的细菌放4℃冰箱保存备用。
1.5 细菌形态学观察
对纯化的细菌进行革兰氏染色,镜检观察细菌的形态及染色特征。取培养特性、形态和革兰氏染色反应均符合大肠杆菌特征的菌株接种在普通营养琼脂培养基上,37℃培养18~24 h,之后将纯化的细菌放4℃冰箱保存,做生化鉴定用。
1.6 生化试验
取已分离纯化的菌株用微量生化反应管进行生化反应试验。取待检菌纯培养物分别接种在乳糖、蔗糖、葡萄糖、麦芽糖、山梨醇、甘露醇、鸟氨酸、赖氨酸、尿素酶、枸橼酸盐、三糖铁琼脂、半固体琼脂培养基上,37℃恒温培养18~24 h,观察结果。将待检菌纯培养物少量接种于葡萄糖蛋白胨水生化管中,37℃培养24~48 h后进行甲基红试验、VP试验和吲哚试验。
1.7 致病性试验[7-8]
将分离出符合大肠杆菌生化特征的72株细菌分别接种在72支营养肉汤试管中,37℃恒温培养18~24 h,细菌计数后,将菌液稀释成约1×1010cfu/mL。将219只健康的小白鼠随机分为73组,每组3只,72组为试验组,1组为对照组。试验组腹腔接种菌液,每只0.3 mL;而对照组腹腔接种0.3 mL灭菌生理盐水,隔离饲养。观察小白鼠发病和致死情况,剖检死亡小白鼠,取其脏器划线接种在麦康凯培养基上,挑取砖红色单个菌落进行纯培养,对纯化的细菌革兰氏染色镜检观察其形态并进行生化试验,各项检测都符合大肠杆菌特征的菌株就判定为致病性大肠杆菌。
1.8 致病性猪大肠杆菌O抗原血清型鉴定[9-10]
将69株致病性大肠杆菌分别接种在69支营养琼脂培养基斜面上,37℃恒温培养18~24 h,之后用2 mL 0.5%石炭酸生理盐水洗下菌落,并用生理盐水稀释至约1×1010cfu/mL,将稀释的菌液做好标记于121℃高压2 h后,将每一种菌液都作为抗原和各型O抗原血清进行玻片凝集试验以确定细菌的O血清型。先用微量滴管吸取1滴O抗原单因子血清于玻片上,再将等量的待检菌液加于血清中,即刻将二者充分混匀,室温下作用3~5 min,若出现明显凝集者为阳性反应,同时以菌悬液与生理盐水混合物作阴性对照,以排除细菌自凝现象,玻片凝集试验为阳性的,再进行试管凝集试验以确定其血清型。
1.9 药敏试验[11]
药敏试验参考美国临床实验室标准化委员会(CLSI)推荐的琼脂纸片扩散方法。购买的26种抗菌药物纸片在使用前均按照CLSI琼脂纸片扩散法操作要求进行质控,测试各种药物纸片对大肠杆菌(ATCC25922)质控菌产生的抑菌圈直径是否在要求范围之内,符合要求者方可使用。对69株致病性大肠杆菌进行耐药性监测,将致病性菌株营养肉汤培养物以灭菌生理盐水稀释至与0.5麦氏单位比浊管浊度相当(约108cfu/mL),无菌吸取各致病菌液0.2 mL,接种于水解酪蛋白(MH)琼脂培养平板上,用涂菌棒涂布均匀,盖上平皿盖静置2~3 min,待菌液完全吸收后,用镊子无菌操作将药敏纸片贴到培养基的表面,把平板置于37℃恒温培养24 h后,用游标卡尺测量抑菌圈直径,判断标准按照CLSI颁布的药敏试验纸片扩散法进行。
2 结果与分析
2.1 分离培养结果
分离出的77株病原菌在普通琼脂上长出直径为2~3 mm、圆形凸起的半透明浅灰色菌落;在麦康凯琼脂平板上长出直径为2~3 mm的圆形、砖红色菌落;在伊红美兰琼脂平板上长出紫黑色、带金属光泽的圆形菌落;在普通肉汤中呈均匀混浊,液面有菌膜,管底有黏性白色沉淀,振荡呈云雾状散开。
2.2 形态特征
革兰氏染色后,镜检可见紫红色、着色均匀、单个或成对的无荚膜、无芽孢、两端钝圆的短杆菌,77株病原菌都符合猪大肠杆菌形态特征。
2.3 生化试验结果
分离菌株生化试验结果显示,有72株病原菌能发酵乳糖、葡萄糖、麦芽糖、甘露醇,产酸产气,对蔗糖多数不能发酵,只有极少数发酵产酸,尿素酶试验阴性,不产生H2S,有鞭毛,能运动。甲基红试验、吲哚试验是阳性,VP试验、枸橼酸盐利用试验是阴性,符合猪大肠杆菌的生化特性,证实了这72株病原菌都是猪大肠杆菌。5株病原菌的三糖铁培养基变成了黑色,有H2S产生,不符合猪大肠杆菌的生化特性。
2.4 致病性试验结果
小白鼠接种12 h后,有69组试验组小白鼠全部发病,大部分小白鼠出现精神沉郁、低头昏睡、体温升高、采食量大幅减少、拉稀、呼吸加快,106只小白鼠24 h内死亡,101只小白鼠48 h内死亡,剖检死亡小白鼠可见肠道严重臌胀,肠腔内充满水样稀便,有的肠黏膜有出血斑点。无菌采集试验组小白鼠的心血、肝和脾划线接种在麦康凯琼脂平板上,37℃恒温培养20 h,有砖红色菌落生长,挑取单个菌落接种在普通营养琼脂斜面纯培养后,革兰氏染色镜检及生化鉴定表明,此菌与接种的细菌为同种细菌,说明该菌对小白鼠具有较强的致病力。有3组试验组小白鼠接种12 h后,只表现精神沉郁,第2天就精神好了,和对照组小白鼠饲养7 d后全部存活,剖检未见病变,结果证明有69株病原菌是致病性猪大肠杆菌。
2.5 猪致病性大肠杆菌O抗原血清型鉴定结果
用50种单因子O抗原血清对69株猪大肠杆菌进行血清型鉴定,除2株未鉴定出血清型外,其余67株血清型分属于30个血清型。其中,O138,O101,O9,O119,O141有 27株,占所鉴定分离菌株的40.3%,这几种血清型均为山西省50多个规模化养猪场目前流行的优势血清型(表1)。
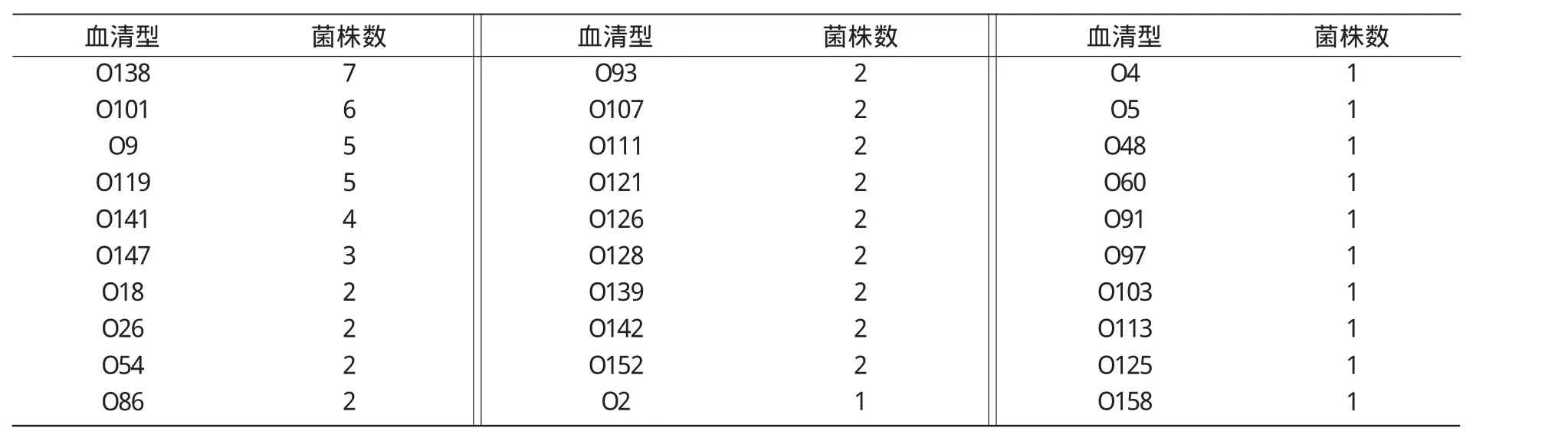
表1 致病性猪大肠杆菌O抗原血清型鉴定结果
2.6 药物敏感性试验结果
猪大肠杆菌对抗生素的敏感性试验结果如表2所示。
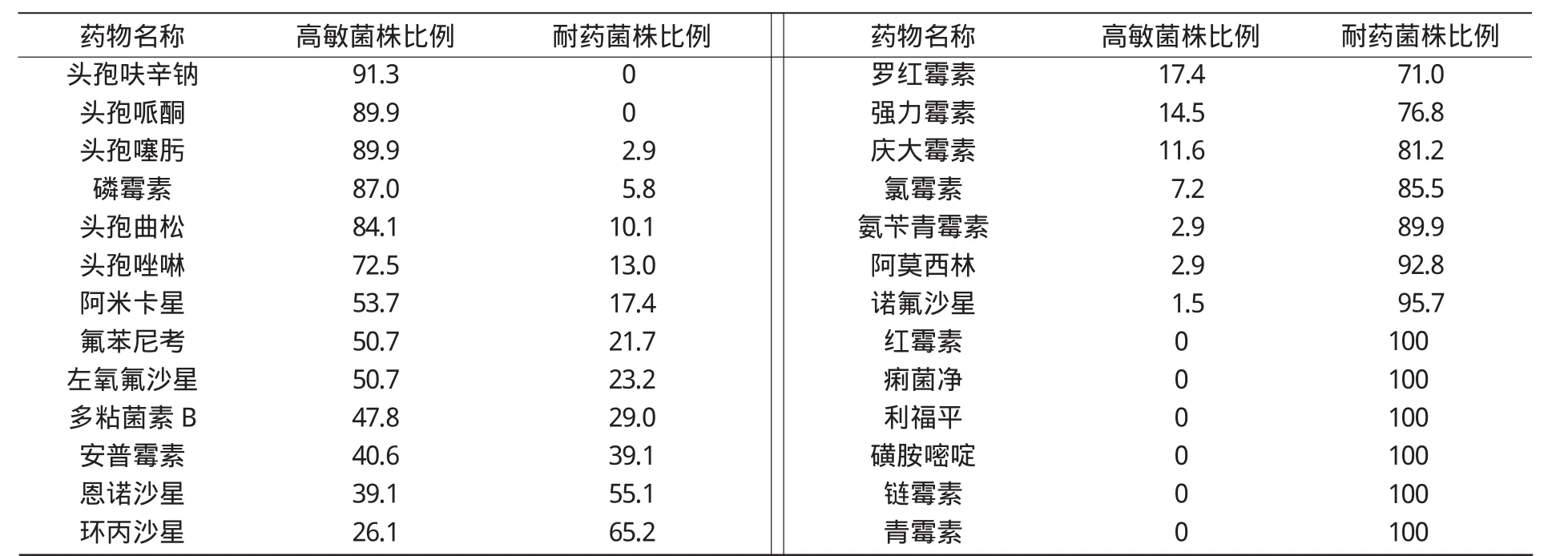
表2 猪大肠杆菌对抗生素的敏感性试验结果 %
由表2可知,本研究分离到的致病性大肠杆菌,除了对头孢呋辛钠、头孢哌酮无耐药菌株外,其余的24种试验药物都存在耐药菌株,所有的致病菌株对青霉素、链霉素、磺胺嘧啶、利福平、痢菌净、红霉素这6种抗生素100%耐药,对诺氟沙星、阿莫西林、氨苄青霉素、氯霉素、庆大霉素、强力霉素、罗红霉素、环丙沙星药物耐药的菌株比例在65%以上;对菌株高度敏感的药物有头孢呋辛钠、头孢哌酮、头孢噻肟、磷霉素,高敏菌株比例在87.0%以上。
69种致病菌株均表现出不同程度的多重耐药,对26种受试抗菌药物,最少的是6耐,有3株,占所有检测菌株的4.3%,最高的是耐24种抗菌药物,有2株(2.9%)。其中,耐15种抗菌药物的菌株最多,有11株(15.9%);其次为14耐和16耐,各7株(各占10.1%);17~23耐的有18株(26.1%)(图 1)。
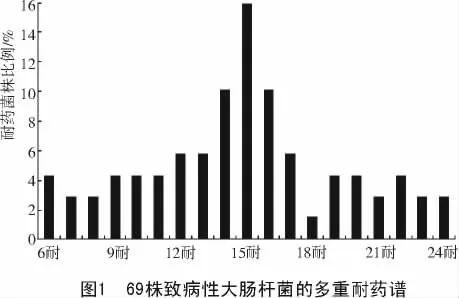
3 讨论与结论
在分离的69株致病性菌株中,有2株不能鉴定出血清型,鉴定出67株致病菌株中共有30种血清型。这说明致病性大肠杆菌的血清型有多样化发展的趋势,虽然流行的致病菌株的血清型比较多,但 O138,O101,O9,O119,O141这 5种血清型的菌株一共有27株,占所有能定型菌株的40.3%,是山西地区流行的优势血清型。在对山西50多个养猪场致病性大肠杆菌血清型调查中发现,同一个猪场暴发大肠杆菌病时,有时可分离出多种血清型的致病菌株,且在不同时期分离出的致病菌株血清型也不完全相同,总会有些改变。不同地域、不同猪场分离出的致病菌株血清型都会有差异。因此,在大肠杆菌的免疫预防中,国内外虽然研制了各种类型的基因工程菌苗与多价灭活菌苗,但由于猪大肠杆菌致病菌血清型众多,所用疫苗结果都不理想,所以,只有选择适合该猪场流行血清型的大肠杆菌菌苗[12],方能有效预防猪大肠杆菌病发生。建议规模化猪场最好多次进行致病性大肠杆菌分离、血清型鉴定,总结本猪场致病性大肠杆菌流行的血清型种类,以便有针对性用多价灭活菌苗进行免疫,预防猪大肠杆菌病。
从药敏试验结果可以看出,分离的69株大肠杆菌对头孢呋辛钠、头孢哌酮均敏感,且高敏比例达89%以上,因此,头孢呋辛钠、头孢哌酮可作为山西地区防治猪大肠杆菌病的首选药物,其余24种抗生素的耐药菌株和高敏菌株均占一定比例,且全都为多重耐药,表明山西地区大肠杆菌耐药性普遍较高,耐药性较高的多数是临床上应用较多和较久的抗菌药。本研究发现,血清型相同但来自不同猪场的致病菌株有完全不同的耐药谱,而来自同一猪场的不同血清型的致病菌株竟然有极其相似的耐药谱,这可能与细菌的耐药性通过质粒介导在细菌间传播和扩散有关。山西地区猪大肠杆菌耐药性高的主要原因是长期不合理使用抗菌药物,在饲料中添加低剂量的抗生素以促进动物生长、提高饲料利用率,在暴发大肠杆菌病时不进行药敏试验,凭自己的主观来判断抗生素的疗效,没有科学依据频繁更换治疗药物,导致细菌的耐药性产生。为了提高抗菌药物的疗效,用药时要严格按照说明,运用合理的剂量与疗程。养殖场的技术人员要细心观察猪群,对发病猪只要隔离饲养,分离出致病菌株进行药敏试验,筛选出最敏感的抗菌药物再进行治疗,且每次发病都要做好记录,并对治疗效果进行评价,一旦猪场有大肠杆菌病暴发,可依据历史记录做出准确的判断,采取科学的治疗方案,将损失降到最低。
长期以来,我们对猪大肠杆菌病的防治以药物治疗为主,也取得了一定的效果,但经过药物治疗后的仔猪,虽然存活下来,但是生长缓慢,饲料转化率低,给养殖业造成了巨大的经济损失。由于致病性猪大肠杆菌对化学药品极易产生耐药性,加之基层饲养者在实际生产中长期盲目地混合用药,造成病原菌的耐药谱越来越广泛,甚至到无药可用的严峻地步,因此,对猪大肠杆菌病应当以预防为主。预防仔猪大肠杆菌病的关键在于消灭传染源和保证仔猪从初乳中获得足够的被动免疫保护,要加强消毒措施,实行全进全出制,对猪舍和外部环境进行彻底消毒,保持猪舍通风、温暖、清洁、干燥,对预产母猪要进行全身体表消毒,防止把体表携带的大肠杆菌传染给仔猪。仔猪在出生后2~3周要依赖母源抗体的保护,因此,要确定本养殖场存在的致病性大肠杆菌的血清型,针对性的给怀孕后期母猪接种疫苗,可提高初乳中特异抗体的水平,以便仔猪获得被动免疫,这对预防仔猪大肠杆菌病具有重要意义。
[1]刘梦元,吴斌,刘建杰,等.规模化猪场大肠杆菌的耐药性监测及血清流行病学调查 [J].中国兽医学报,2004,24(1):16-18.
[2]张越男,张彦明,鄢明华,等.天津地区猪源大肠杆菌对抗菌药物敏感性测定[J].天津农业科学,2008,8(4):18-20.
[3]谢永平,杨威,陈泽祥,等.广西地区猪大肠杆菌血清型调查及耐药性检测[J].广西农业科学,2010,41(4):380-382.
[4]李学伍,张改平.仔猪大肠杆菌病流行菌株的分离与鉴定[J].河南农业科学,2000(8):28-30.
[5]李文刚,杨治田,兰尊海,等.河南省猪致病性大肠杆菌株的鉴定[J].河南农业科学,2001(3):30-31.
[6]王孝友,曾秀,孔路军,等.仔猪黄白痢大肠杆菌的分离鉴定[J].湖北畜牧兽医,2004,23(6):27-29.
[7]史丽华.仔猪致病性大肠杆菌的分离与鉴定[J].中国兽医杂志,2010,46(6):53-54.
[8]周华林,熊江林,王长义,等.猪致病性大肠杆菌的分离鉴定及耐药性分析[J].中国畜牧兽医,2009,36(1):109-111.
[9]孙广力,孙刚,李书华,等.黑龙江省规模化养猪场大肠杆菌病血清型流行病学调查 [J].黑龙江畜牧兽医,2004,32(7):90-92.
[10]陈一兵,苗晓青,高崧,等.猪腹泻病例分离大肠杆菌的血清学分布[J].中国兽医杂志,2008,44(9):36-37.
[11]倪语星,王金良.抗微生物药物敏感性试验规范[M].上海:上海科学技术出版社,2004:16-34.
[12]王福传,张玉焕,李骅,等.猪大肠杆菌灭活菌苗的研制及应用[J].山西农业科学,2000,28(1):82-84.
