乌鲁木齐10号泉水体细菌群落对地震的响应*
2012-09-15强曾军娄恺李珊杨晓芳吴尊凤高小其
张 强曾 军娄 恺李 珊杨晓芳吴尊凤高小其,
1)中国乌鲁木齐830091新疆农业科学院微生物应用研究所
2)中国乌鲁木齐830011新疆维吾尔自治区地震局
3)中国新疆维吾尔自治区石河子832003石河子大学生命科学学院
4)中国乌鲁木齐830046新疆大学生命科学与技术学院
5)中国新疆维吾尔自治区石河子832003石河子大学化学化工学院
乌鲁木齐10号泉水体细菌群落对地震的响应*
张 强1,3)曾 军1)娄 恺1)李 珊1,4)杨晓芳2)吴尊凤1,5)高小其2),
1)中国乌鲁木齐830091新疆农业科学院微生物应用研究所
2)中国乌鲁木齐830011新疆维吾尔自治区地震局
3)中国新疆维吾尔自治区石河子832003石河子大学生命科学学院
4)中国乌鲁木齐830046新疆大学生命科学与技术学院
5)中国新疆维吾尔自治区石河子832003石河子大学化学化工学院
以无震时期细菌群落及水文化学元素信息为背景,阐明有感地震时的泉水细菌群落映震特征.2010年12月—2011年4月,乌鲁木齐周边先后发生了MS3.1和MS3.6两次有感地震.本文采用末端限制性片段长度多态性法(T-RFLP)分析了该时间段内乌鲁木齐10号泉中细菌群落结构、多样性、稳定性、优势类群及特殊类群变化特征.结果表明,水文地球化学指标对有感地震不敏感,泉水细菌群落结构稳定,地震对其优势类群及多样性影响均不显著,但无震时期部分类群(以82,170,176,462 bp为代表)在前后两次地震中丰度变化趋势相似,即震前有小幅上升,震后1—12天内出现极大值,之后丰度逐渐恢复至较低水平,且表现出与震级、震中距具有一定相关性.这表明部分泉水细菌对有感地震映震灵敏.
地震响应 T-RFLP 细菌群落 水文地球化学 泉水
Abstract:The bacterial community structures and hydrogeochemical parameters in aseismic times provide the backdrop for illustrating the response of bacterial community to moderate and strong earthquakes.Water samples were collected from December 2010 to April 2011,during which period two felt earthquakes of MS3.1 and MS3.6 successively occurred near Urumqi.A terminal restriction fragment length polymorphism(T-RFLP)technique was used to analyze the bacterial community structures,diversity,stability and variations of the dominant groups and peculiar species under the seismic action.The results show that some peculiar species abundance generally appeared to vary in similar manners during the pre-and post-earthquake periods,hydrogeochemical parameters were insensitive to the earthquakes,bacterial community structures were stable and earthquakes did not significantly affect the dominant groups and their diversity.The abundance of peculiar species slightly increased in pre-earthquake times,the maximum value appeared within 1 to 12 days after the earthquakes,and then declined to a lower level.Besides,the variations were correlated to earthquake magnitude and epicenter distance.The results suggest that some bacterial species could sensitively respond to earthquakes.
Key words:seismic response;T-RFLP;bacterial community;hydrogeochemical;spring
引言
地震是地壳在内、外应力作用下集聚的构造应力突然释放,产生震动弹性波,从震源向四周传播引起的地面颤动.震级M可分为:微震(MS<2.5),有感地震(2.5≤MS≤5.0),破坏性地震(MS>5.0).目前国内外对地震的前兆异常研究包括生物的震前行为异常(蒋锦昌,陈德玉,2003;Kirschvink,2000)和水文地球化学方法(Perez et al,2008;Suer et al,2008;Stejskal et al,2008;Skelton et al,2008)等多种手段.
微生物是生物圈的基础,在生物地球化学循环中占有极重要地位(Falkowski et al,2008).与其它生物相比,微生物具有迅速感知及适应环境变化的能力(Miller et al,2009;Rowbury,2008),其群落结构对不同的扰动具有抵抗、恢复及功能冗余等响应行为(Allison,Martiny,2008).环境的改变使原来数量很少或竞争力相对较弱的微生物,在适合生长发育的新环境下成为优势种,具有生态性的适应特征.Mitchell等(2009)的研究表明,原核及真核微生物在进化过程中经过重复性选择,具有预测环境变化的特性.胡江春等(2006)证实,在实验室模拟条件下,土壤微生物能响应地震震动影响造成的变化,但野外环境关于微生物类群对地震响应的类似研究则未见报道.地壳流体是沟通地壳应力与固体变形之间关系最敏感的物质.特别值得注意的是地下极端环境微生物,当深大断裂活动时,随着地下流体进入浅部,很有可能成为短临地震预报过硬的指标性信息.乌鲁木齐10号泉位于乌鲁木齐南部的柳树沟—红雁池断裂带上,属于国家地震台网监测基本水化Ⅰ类台.根据泉中水质、气体、氡、汞等测项,较为准确地对新疆乌苏、沙湾、石河子、和静、和硕等6次5级以上地震进行了短临预测(高小其等,2006a).该泉水地下径流处于一个相对封闭的环境,受其它外部因素影响均较小,是探索地下水细菌群落响应地震的优质样地.
本研究采用末端限制性片段长度多态性法(terminal restriction fragment length poly-morphism,简写为T-RFLP),分析乌鲁木齐10号泉水体细菌种群结构动态变化,旨在为地下水微生物是否可用于映震预测提供参考.
1 材料与方法
1.1 PCR(聚合酶链式反应)及T-RFLP原理简介
聚合酶链式反应(polymerase chain reaction,简写为PCR),是通过体外酶促合成特异DNA片段的一种方法,由高温变性,低温退火(复性)及适温延伸等几步反应组成一个周期,循环进行,使目的DNA得以迅速扩增,具有特异性强、灵敏度高、操作简便、省时等特点.
T-RFLP基本原理:首先,根据核糖体小亚基RNA基因(16S r RNA)的保守区设计通用引物,其中一个引物的5′端用荧光物质标记(通常为上游引物),常用的荧光物质有TET(四氯荧光素)(Moeseneder et al,1999)、HEX(六氯荧光素)(Fogel et al,1999)、6-FAM(羧基荧光素)(Hiraishi et al,2000)等;然后,提取待分析样品的总DNA,以它为模板进行PCR扩增,所得到的PCR产物一端就会带有这种荧光标记;之后,将PCR产物用合适的限制性内切酶消化.由于在不同菌的扩增片段内存在核苷酸序列的差异,故酶切位点就会存在差异,因此酶切后就会产生不同长度特征的限制性片段.消化产物用自动测序仪进行检测获得峰值图,只有末端带荧光标记的片段(terminal restriction fragment,简写为T-RF)能够被检测到,而其它没有带荧光标记的片段则检测不到.这些末端标记的片段可以反映微生物群落组成情况,因为不同长度的末端限制性片段可以代表不同的细菌,所以峰值图上的每一个峰值至少代表了一种菌.由于该方法获得的T-RF具有较高的重复性,因此用它来进行微生物的定性和定量分析是比较可靠的(Bernhard,Field,2000).
1.2 样品采集
从2010年12月2日—2011年4月26日,每隔5天采集10号泉泉水2 000 m L,共计34份.将样品用4℃车载运回实验室并立即处理,用孔径0.22μm的无菌微孔滤膜收集菌体,随后将滤膜置于50 m L无菌聚丙烯离心管,加入8 m L GTE缓冲液后(50mmol/L Tris-HCl,40mmol/L EDTA,0.75 mol/L蔗糖,p H 8.3),于-20℃保藏.
1.3 泉水水文地球化学指标测定
每日测定10项地球化学指标,分别为氩、氡、氮、硫化物、甲烷、二氧化碳、氦、氟、水汞及流量.硫化物采用碘量法分析,水中溶解气测试采用SP-2305型气相色谱仪,水汞测试采用XG-4型测汞仪,水氡测试采用FD-125型室内氧钍分析器,流量采用三角堰法.上述具体方法见高小其等(2000)文章.水文地球化学指标前兆异常特征的地震学分析方法参照高小其等(2006b)文章.
1.4 泉水总DNA提取及细菌16S r RNA基因PCR扩增
主要参照Shaheen等(2003)报道的方法,根据泉水特点稍作改进(溶菌酶、蛋白酶K、十二烷基磺酸钠的加入量均根据样品体积按比例增减;水浴时间均延长至2 h;延长静置沉淀DNA的时间,随后加入70%预冷乙醇清洗异丙醇的步骤.其余改进均为离心过程中转速及时间的微调).采用细菌通用引物8F-fluorouracil(5′-AGAGTTTGATCCTGGCTCAG-3′)和926R(5′-CCGTCAATTCCTTTRAGTT T-3′)(Liu et al,1997)进行PCR扩增.PCR反应条件:95℃,6 min;94℃,45 s;56℃,45 s;72℃,90 s;30个循环;72℃,7 min.以无菌水为空白作为阴性对照,每个样品做两个平行PCR扩增.PCR产物以1%琼脂糖凝胶电泳检测,-20℃保存备用.
1.5 T-RFLP酶切分型
用限制性内切酶MspⅠ和HinfⅠ对上述PCR产物分别进行酶切分型.反应体系为MspⅠ15 U,10×T Buffer(缓冲液)2μL,0.1%BSA(牛血清蛋白)2μL,DNA≤1μL,dd H2O(无菌水)补足至20μL;HinfⅠ反应体系为HinfⅠ15 U,10×T Buffer 2μL,DNA≤1μL,dd H2O补足至20μL.混匀后37℃水浴酶切12 h,于80℃作用20 min停止反应.酶切产物送至上海基康生物技术有限公司检测,使用ABI3730测序仪扫描,用Peak Scanner Software V1.0进行结果分析.
1.6 统计分析
单个T-RF的相对峰面积(Ap)通过公式Ap=ni/N×100进行计算.其中ni为单个T-RF的峰面积,N为图谱中所有峰的面积总和(Lukow et al,2000).本文Ap值仅采用了片段长度在50—600 bp(Liu et al,1997)区间,荧光强度≥50的T-RF数值进行计算,且仅采用大于0.05%的T-RFs进行统计分析.以图谱中每一个可统计的T-RF视为一个操作分类单元(operational taxonomic unit,简写为OTU),以T-RF的相对峰面积作为对应的OTU的丰度.分别计算细菌类群物种的香农威纳指数(Shannon-Weiner index,H),优势度指数(Simpson index,D)和均匀度指数(evenness index,E).用SPSS 18.0进行聚类分析.细菌种群定性分析于http:∥mica.ibest.uidaho.edu/pat.php网站进行(特殊性及排序方式等参数均为网站原始最小误差参数).
2 结果
2.1 乌鲁木齐10号泉水体细菌T-RFLP图谱定性分析
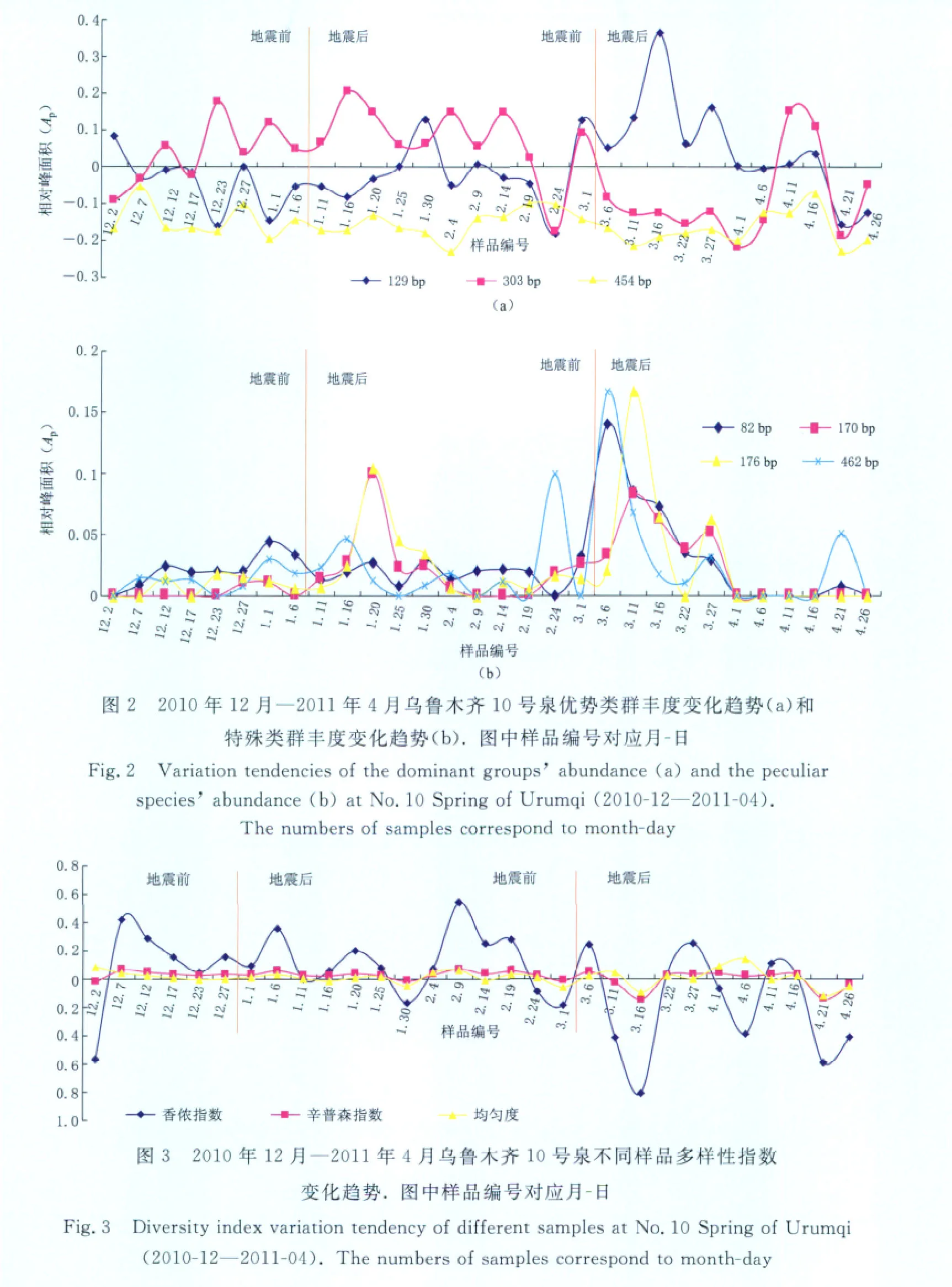
实验共得到T-RFLP指纹图谱34个,限制性内切酶MspⅠ酶切总体效果优于HinfⅠ,因而采用其数据进行多样性分析.乌鲁木齐10号泉水体细类群落结构相对复杂,T-RFs密集于100—200 bp和300—450 bp.其中129,303,454 bp为该泉水体优势类群,普遍存在于所有样品中(图1),且在两次有感地震(2011年1月8日新疆昌吉市与呼图壁县交界3.1级,2011年3月5日新疆昌吉市3.6级)发生前后相对稳定.但T-RFs为82,170,176,462 bp所代表的特殊类群,其丰度出现大幅度波动,并且在地震结束27天后恢复到较低值,有可能成为预警地壳运动的指示菌.
对T-RFs进行在线数据比对,结合本实验室前期对该泉构建的细菌16S r RNA基因克隆文库(李慧等,2011),判断优势类群为129 bp(thiothrix),303 bp(treponema),454 bp(tickettsia/achromobacter),特殊类群为82 bp(flavobacterium),170 bp(anoxybacillus),176 bp(nitrospira/leptotrichia/propionibacterium),462 bp(pseudomonas).
2.2 乌鲁木齐10号泉优势类群及特殊类群的丰度变化趋势
129 bp所代表的优势类群在两次地震前均呈现小幅上升,地震后短期内变化平缓但随后出现一较高值,之后呈现波动式变化,如图2a所示(所有数据均已消除本底,本底为所有时段检测数据的平均值);303 bp类群在地震前后均无明显变化趋势,表现为波动式变化;454 bp代表类群在整个监测期中变化趋势都较为平稳.

图1 乌鲁木齐10号泉部分样品的水样细菌群落T-RFLP图谱(a)2011年1月6日样品;(b)2011年2月14日样品;(c)2011年3月6日样品;(d)2011年4月11日样品Fig.1 T-RFLP profiles of some bacterial samples at No.10 Spring of Urumqi Samples were taken on Jan.6(a),Feb.14(b),March 6(c)and April 11(d),2011,respectively
除82 bp所代表的特殊类群的丰度在两次地震前后呈现出不同变化趋势外,其余3个特殊类群均呈现出相同变化趋势(图2b),即在震前呈现上升趋势,震后不同时期内达到极大值.其中462 bp在两次地震前均出现次高值,170 bp和176 bp代表类群在地震前后丰度变化最大.
2.3 乌鲁木齐10号泉水体细菌多样性指数
在2010年12月—2011年4月的两次地震前后,细菌类群香侬指数无显著变化趋势,持续呈现波动式变化(图3);而优势度与均匀度均相对稳定,无明显变化(所有数据均已消除本底,本底为所有时段检测数据的平均值).
2.4 乌鲁木齐10号泉水体细菌聚类分析
对两次地震前后样品分别进行Ward法(王晓慧等,2009)聚类分析,2010年12月—2011年2月的18个样品聚类无规律可寻(图4a);2011年2—4月的21个样品基本按月份聚类在一起,共分为3个大分支,其中地震发生当月(3月)又分为2个大分支和3个小分支(图4b),地震发生后两天(3月6,7日)群落结构最为相似聚在一起.

图4 乌鲁木齐10号泉不同日期样品间细菌类群聚类分析(a)2010年12月—2011年2月;(b)2011年2—4月Fig.4 Cluster analysis of different samples at No.10 Spring of Urumqi(a)2010-12—2011-02;(b)2011-02—2011-04
2.5 有感地震对10号泉水文地球化学元素的影响
2010年12月—2011年4月,每日测定的10项水文地球化学指标总体未呈现出明显的地震前兆异常,均处于正常的年变化趋势;氮、汞等5项指标变化趋势均较平稳(图5),氩、氡等5项指标呈现波动式变化.

图5 乌鲁木齐10号泉2010年12月—2011年4月10项化学元素变化情况箭头指向两次地震发生的日期Fig.5 Hydrogeochemical change(2010-12—2011-04)at No.10 Spring of Urumqi Arrows point to the dates of the two earthquakes
3 讨论
地球内部元素迁移与区域构造应力有密切关系.乌鲁木齐10号泉渗流路径较长,循环于地下深处,很少受到外部气象和人为因素影响,加之水温及流量年变甚微(崔永,地里夏提·克优木,2004),其水文地球化学指标异常变化可真实表征地壳运动信息,对近场中强震及部分远场强震映震性较强(高小其等,2000),但对震级小于5的映震性相对较弱(赵永红等,2011).2010年12月—2011年4月,该泉10项水文地球化学指标均处于正常年动态变化范围内(图5),对两次有感地震没有明显的前兆异常,进一步证实了上述观点.
本文聚类分析表明,10号泉震中距较远(约80km)且震级较小的有感地震(1月8日)对10号泉干扰较少,地下水生境保持相对稳定的状态,故细菌群落表现为无规律的动态聚类组合(图4a).而震中距较近(约35km)且震级相对较大的地震(3月5日),则对10号泉细菌类群影响较显著,以地震发生当日为界限,表现出明显的聚类趋势(图4b).微生物可迅速地对外界环境变化或者刺激产生响应,表现出如R-策略,K-策略或者R-K连续统等生存策略(Mac Arthur,Wilson,1967).两次有感地震对地下水微生物群落组成及优势类群影响均不显著,可能是由于水体中微生物群落结构组成较为复杂(宋洪宁等,2010).而优势类群的恒定状态在一定程度上可抵消生境变化对微生物的影响(Allison,Martiny,2008),同时修复受损的生态系统(Fuhrman et al,2006),表现出具有较强竞争力的K-策略(Yang,Lou,2011).这种抵制能力对水体微生物活动具有重要意义.
值得注意的是,在无地震发生时,本研究中的一些特殊细菌类群,其丰度保持在相对较低的水平(图2b),但当地震干扰出现后,其丰度在1—12天内迅猛增长(以82,170,176,462 bp为代表);最为特殊的为462 bp类群,在2011年两次有感地震发生前,该类群均出现次高丰度值.与此同时,其余各特殊类群的丰度高值出现日期略微不同.震中距远近及震级大小可能与此有关.这种变化模式符合生物多维进化中的R-策略.R-策略者是“机会主义者”,很容易出现“突然的爆发和猛烈的破产”(李博,2000),其高内禀增长率(内禀增长率为在特定条件下,具有稳定年龄组配的生物种群不受其它因子限制时的最大瞬时增长速率)可在生境发生变化的情况下,迅速通过增加繁殖率来适应环境变化.乌鲁木齐10号泉位于新疆地震断裂带.该生境中的微生物长期受发生于不同地区的不同等级地震扰动影响,在适应性选择机制作用下(Balaban,2004;Acar et al,2008),存在一些可迅速感知且适应地震扰动的特殊细菌类群(即462 bp等所代表的类群),通过提升种群数量的方法来适应环境变化,这也符合R-策略菌的进化机理.最新研究结果表明,大肠杆菌在进化过程中,经过重复的同一干扰作用,会产生预测环境变化的能力(Mitchell et al,2009;Tagkopoulos et al,2008).本研究初步表明,泉水部分特殊细菌类群可响应地震干扰,但仍需进一步验证特殊R-策略菌及具有较强竞争力的K-策略菌的映震性能,积累长期观测数据,从而判断地下水中细菌是否可作为地震监测的新手段.
4 结论
通过实验结果的分析和研究,主要结果如下:
1)乌鲁木齐10号泉水文地球化学指标对发生于乌鲁木齐市周边的近场有感地震响应不敏感,即当有感地震发生前,水文地球化学指标并无明显前兆异常指示.
2)用T-RFLP指纹图谱法对乌鲁木齐10号泉不同日期水体细菌类群进行的检测表明,乌鲁木齐10号泉水体细菌群落结构稳定,近场有感地震对水体细菌优势类群及多样性指数影响不显著.
3)无震时期部分细菌类群(以82 bp等片段为代表),在两次有感地震发生前后其丰度变化趋势相似,即震前有小幅上升,震后1—12天内出现极大值,之后丰度逐渐恢复至较低水平,且表现出与震级、震中距具有一定的相关性.这表明部分泉水细菌对有感地震映震灵敏.
崔永,地里夏提·克优木.2004.乌鲁木齐10号泉溶解气甲烷的3次长趋势异常变化的分析[J].内陆地震,18(4):371--375.
高小其,陈华静,高国英,许秋龙,崔永.2006a.新疆地下流体源兆、场兆、大震远兆特征的统计与分析[J].地震,26(2):83--94.
高小其,陈华静,杨又陵,李志海,许秋龙.2006b.2004年12月26日印尼8.7级强震新疆地区的同震效应[J].地震地磁观测与研究,27(3):40--46.
高小其,许秋龙,张学敏,李艳萍,卢静芳,崔永.2000.乌鲁木齐10号泉流体综合观测及映震灵敏初析[J].内陆地震,14(3):243--251.
胡江春,边疆,王书锦,杜建国.2006.中强地震活动中汞的异常特征及土壤微生物敏感菌的相关性模拟试验[C]∥第十届全国土壤微生物学术讨论会暨第三届全国微生物肥料生产技术研讨会论文(摘要)集.山东泰安:泰山出版社:53.
蒋锦昌,陈德玉.2003.地震生物学概论[M].北京:地震出版社:2--5.
李博.2000.生态学[M].北京:高等教育出版社:76--77.
李慧,曾军,高小其,杨红梅,张涛,杨晓芳,孙建,娄恺.2011.新疆断裂带含硫冷泉泉水细菌群落结构多样性[J].微生物学报,51(5):595--602.
宋洪宁,杜秉海,张明岩,付伟章,路晓萌,李正华,丁延芹.2010.环境因素对东平湖沉积物细菌群落结构的影响[J].微生物学报,50(8):1065--1071.
王晓慧,文湘华,Criddle C,张杰,杨宁宁,赵颖.2009.城市污水处理场活性污泥中氨氧化菌群落结构研究[J].环境科学,20(10):3002--3006.
赵永红,白竣天,李小凡,贾科,陈辉.2011.活动断裂带附近地下水中的氢同位素变化与地震关系研究[J].岩石学报,27(6):1909--1915.
Acar M,Mettetal J T,Qudenaarden V.2008.Stochastic switching as a survival strategy in fluctuation environments[J].Nat Genet,40(4):471--475.
Allison S D,Martiny J B H.2008.Resistance,resilience,and redundancy in microbial communities[J].P Natl Acad Sci,105(SupplⅠ):11512--11519.
Balaban N Q.2004.Bacterial persistence as a phenotypic switch[J].Science,305(5690):1622--1625.
Bernhard A E,Field K G.2000.Identification of nonpoint sources of fecal pollution in coastal waters by using host-specific 16S ribosomal DNA genetic makers from fecal anaerobes[J].Appl Environ Microbiol,66(4):1587--1594.
Falkowski P G,Fenchel T,Delong E F.2008.The microbial engines that drive biogeochemical cycles[J].Science,320(5879):1034--1039.
Fogel G B,Collins C R,Li J.1999.Prokaryotic genome size and SSU r DNA Copy number:estimation of microbial relative abundance from a mixed population[J].Microbiol Ecol,38(2):93--113.
Fuhrman J A,Hewson L,Schwalbach M S,Steele J A,Brown M V,Naeem S.2006.Annually reoccurring bacterial communities are predictable from ocean conditions[J].P Natl Acad Sci,103(35):13104--13109.
Hiraishi A,Lwasaki K,Shinjo H.2000.Terminal restriction pattern analysis of 16S r RNA gene for the characterization of bacterial communities of activated sludge[J].J Bioscie Bioeng,90(2):148--156.
Kirschvink J L.2000.Earthquake prediction by animals:Evolution and sensory perception[J].Bull Seism Soc Amer,90(2):312--323.
Liu W T,Marsh T L,Cheng H,Forney L J.1997.Characterization of microbial diversity by determining Terminal Restriction Fragment Length Polymorphisms of genes encoding 16S r RNA[J].Appl Envirom Microbiol,63(11):4516--4522.
Lukow T,Dunfield P F,Liesack W.2000.Use of T-RFLP technique to assess spatial and temporal changes in the bacterial community structure within an agricultural soil planted with transgenic and non-transgenic potato plants[J].FEMS Microbiol Ecol,32(3):241--247.
Mac Arthur R H,Wilson E O.1967.The Theory of Island Biogeography[M].Princeton:Princeton University Press:68--93.
Miller L D,Russell M H,Alexandre G.2009.Diversity in bacterial chemotactic responses and niche adaptation[J].Adv Appl Microbiol,66:53--75.
Mitchell A,Romano G H,Groisman B,Yona A,Dekel E,Kupiec M,Dahan O,Pilpel Y.2009.Adaptive prediction of environmental changes by microorganisms[J].Nature,460(7252):220--224.
Moeseneder M M,Ameta J M,Muyzer G.1999.Optimization of terminal-restriction fragment length polymorphism analysis for complex marine bacterio-plankton communities and comparison with denaturing gradient gel electrophoresis[J].Appl Environ Microbiol,65(8):3518--3525.
Perez N M,Hernandez P A,Igarashi G,Trujill I,Nakai S,Sumino H,Wakita H.2008.Searching and detecting earthquake geochemical precursors in CO2-rich groundwaters from Galicia,Spain[J].Geochem J,42(1):75--83.
Rowbury R J.2008.Extracellular Sensors and Extracellular Induction Components in Stress Tolerance Induction[M].New York:Springer-Verlag:263--292.
Shaheen B H,Nasreen B,James T H.2003.Depth distribution of microbial diversity in Mono Lake,a meromictic soda Lake in California[J].Appl Environ Microbiol,69(2):1030--1042.
Skelton A,Claesson L,Chakrapani G,Mahanta C,Routh J,Moorth M,Khanna P.2008.Coupling between seismic activity and hydrogeochemistry at the Shillong Plateau,northeastern India[J].Pure Appl Geophys,165(1):45--61.
Stejskal V,Malec J,Novotny O.2008.Variations in discharge and temperature of mineral springs at the Frantiskovy Lazne Spa,Czech Republic,during a nearby earthquake swarm in 1985/1986[J].Stud Geophys Geod,52(4):589--606.
Suer S N,Gulec N,Mutlu H,Hilton D R,Cifter C,Sayin M.2008.Geochemical monitoring of geothermal waters(2002—2004)along the North Anatolian Fault Zone,Turkey:Spatial and temporal variations and relationship to seismic activity[J].Pure Appl Geophys,165(1):17--43.
Tagkopoulos L,Liu Y C,Tavazoie S.2008.Predictive behavior within microbial genetic networks[J].Science,320(5881):1313--1317.
Yang H M,Lou K.2011.Succession and growths stratery of a spring microbial community from KeZhou sinter in China[J].Braz J Microbiol,42(1):41--45.
Seismic response of bacterial community structures at No.10 Spring in Urumqi
Zhang Qiang1,3)Zeng Jun1)Lou Kai1)Li Shan1,4)Yang Xiaofang2)Wu Zunfeng1,5)Gao Xiaoqi2),
1)Institute of Microbiology,Xinjiang Academy of Agricultural Sciences,Urumqi 830091,China
2)Earthquake Administration of Xinjiang Uygur Autonomous Region,Urumqi 830011,China
3)College of Life Science of Shihezi University,Shihezi 832003,China
4)College of Life Science and Technology of Xinjiang University,Urumqi 830046,China
5)College of Chemistry and Chemical Engineering of Shihezi University,Shihezi 832003,China
10.3969/j.issn.0253-3782.2012.05.012
P345
A
国家自然基金(40962006)、地震星火科技攻关课题(XH1029)和新疆维吾尔自治区高技术研究发展项目(201216141)共同资助.
2012-01-08收到初稿,2012-06-18决定采用修改稿.
http:∥www.cnki.net/kcms/detail/11.2021.P.20120830.1420.004.html
张强,曾军,娄恺,李珊,杨晓芳,吴尊凤,高小其.2012.乌鲁木齐10号泉水体细菌群落对地震的响应.地震学报,34(5):706--715.
Zhang Qiang,Zeng Jun,Lou Kai,Li Shan,Yang Xiaofang,Wu Zunfeng,Gao Xiaoqi.2012.Seismic response of bacterial community structures at No.10 Spring in Urumqi.Acta Seismologica Sinica,34(5):706--715.
