碱式硫酸镁晶须水热过程结晶动力学研究
2012-09-15高传慧王传兴许军武玉民李先国
高传慧王传兴许 军武玉民*,李先国
(1青岛科技大学化工学院,青岛 266042)
(2中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛 266100)
碱式硫酸镁晶须水热过程结晶动力学研究
高传慧1王传兴1许 军1武玉民*,1李先国2
(1青岛科技大学化工学院,青岛 266042)
(2中国海洋大学海洋化学理论与工程技术教育部重点实验室,青岛 266100)
采用水热法合成了碱式硫酸镁晶须,利用扫描电镜、透射电镜、X射线能谱仪和X射线衍射仪等对产物的形貌和组成进行表征。通过考察不同温度下SO42-浓度随时间的变化,对碱式硫酸镁晶须的结晶动力学进行了研究。利用MATLAB软件和Runge-Kutta数值解法对实验数据进行处理,得出不同温度下晶须的结晶动力学方程。对晶须的几种生长机理模型进行分析发现,低温和高温的动力学模型不同,反应温度为170℃、180℃、190℃时的动力学模型分别为MB-1、MB-2和MB-3,结晶机理为多核控制表面生长,结晶速率由表面反应控制;反应温度为200℃和210℃时,结晶机理发生了变化,为单核控制表面生长,结晶动力学模型分别为MC-2和 MC-3。
碱式硫酸镁;结晶;动力学;水热合成
0 引 言
近年来,一类附加值较高的功能性晶须碱式硫酸镁晶须逐渐成为无机材料领域的研究热点。碱式硫酸镁晶须的组成一般用通式xMgSO4·yMg(OH)2·zH2O表示,可直接称为xyz型碱式硫酸镁晶须。这类镁盐晶须呈单晶纤维结构,具有与碳纤维、碳化硅晶须相近的高强度和优异的耐腐蚀性,但价格却仅为后者的1/30~1/50。碱式硫酸镁晶须除了具有晶须材料所固有的增强效果之外,同时也是一种无卤阻燃剂,并且还具有无毒、发烟量小的特点,可代替目前广泛使用的含卤阻燃材料,达到既阻燃又增强的目的,是一类发展前景广阔的镁盐升级换代产品[1-3]。
目前,碱式硫酸镁晶须多采用水热法合成。迄今为止,关于碱式硫酸镁的研究主要集中在152型和153 型 产品[4-9],即 MgSO4·5Mg(OH)2·2H2O 和 MgSO4·5Mg(OH)2·3H2O。Yan[10]、Tao[11]等分别以 MgCl2、MgSO4、氨水和 MgSO4、NaOH为原料合成了 MgSO4·5Mg(OH)2·2H2O晶须,并考察了反应条件对晶须形貌的影响;Xiang等[12]则研究了以MgSO4和NaOH为原料水热反应制备MgSO4·5Mg(OH)2·3H2O的工艺条件,发现:只有严格控制反应温度和合适的反应物配比,才能够得到纤维状镁盐晶须产品。虽然对碱式硫酸镁的报道较多,但几乎所有文献都是对晶须合成及表征方法的简单描述,对碱式硫酸镁的生长机理及结晶动力学尚未进行深入的研究。探讨碱式硫酸镁晶须的结晶动力学可为研究晶须的生长提供重要的理论依据,亦可为水热过程中同类产品的制备提供一定的理论指导。本文通过考察水热法制备碱式硫酸镁晶须过程不同温度下SO42-浓度随时间的变化,对 MgSO4·5Mg(OH)2·2H2O晶须的结晶动力学进行了研究。利用MATLAB和Runge-Kutta数值解法对实验数据进行处理,得到了碱式硫酸镁晶须生长的结晶动力学方程。
1 实验部分
1.1 碱式硫酸镁晶须的合成
将8 mL浓度为2 mol·L-1的氨水逐滴滴入20 mL MgCl2、MgSO4混合溶液中并充分搅拌 (Mg2+浓度为 0.5 mol·L-1,MgCl2与 MgSO4物质的量比为 2∶3),得到的悬浊液转移至50 mL内衬聚四氟乙烯的不锈钢反应釜中,分别在170℃、180℃、190℃、200℃、210 ℃下进行反应,分别于反应 1 h、2 h、3 h、5 h、20 h后取出反应釜,室温冷却,测定反应体系中镁离子和硫酸根离子浓度。Mg2+用pH=10的碱性Na-EDTA标准缓冲溶液 (氨水+氯化铵)进行滴定;SO42-离子通过BaSO4重量法测定。
1.2 离子浓度的测定[13]
(1) Mg2+含量分析
取25.00 mL的待测溶液,于250 mL的锥形瓶中,加50 mL的水,5 mL的三乙醇胺,加10 mL的氨-氯化铵缓冲溶液甲,0.1 g铬黑T指示剂,然后用0.02 mol·L-1的EDTA标液滴定至溶液由酒红色变为纯蓝色。镁离子含量按下式计算:
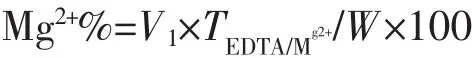
式中:V1:滴定镁离子所用EDTA标准溶液的用量;TEDTA/Mg2+:EDTA标准溶液对镁离子的滴定度,g·mL-1;W:所取样品质量,g。
(2) SO42-含量分析
吸取一定量样品溶液,置于150 mL烧杯中,加1 滴 1 mol·L-1盐酸,加入 5.00 mL 0.02 mol·L-1氯化钡溶液(硫酸根含量大于 0.6%时,加入 10.00 mL),于搅拌器上搅拌片刻,放置5 min,加入5mL或10 mL Mg-EDTA溶液 (与氯化钡量同),10 mL或15 mL无水乙醇 (占总体积30%),5 mL氨性缓冲溶液,4滴铬黑T指示剂,用0.02 mol·L-1EDTA标准溶液滴定至溶液由酒红色变为亮蓝色。另取一份与测定硫酸根时相同的样品溶液,置于150 mL烧杯中,加入5mL氨性缓冲溶液,4滴铬黑T指示剂,然后用0.02mol·L-1EDTA标准溶液滴定至溶液由酒红色变为亮蓝色为止,EDTA用量为镁离子总量。硫酸根含量按下式计算:
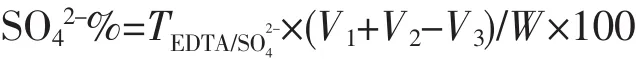
式中:
T:EDTA标准溶液对硫酸根的滴定度,g·mL-1;V1:滴定5.00 mL氯化钡溶液EDTA标准溶液的用量,mL;
V2:滴定镁离子总量EDTA标准溶液的用量,mL;
V3:滴定硫酸根EDTA标准溶液的用量,mL;
W:所取样品质量,g。
1.3 晶须的表征
采用日本电子(JEOL)JSM-6700F型扫描电子显微镜(scanning electron microscopy,SEM)观察产物形貌,测试电压12 kV,放大倍数200~50 000。采用日本理学 (Rigaku)D/max-rB型X射线衍射仪(X-raydiffractometer,XRD)对产物进行表征,铜靶(λ=0.154 2 nm),管电压 40 kV,管电流 50 mA,扫描速率 4°min-1。用日本JEOL JEM-1200EX型透射电子显微镜(transmission electron microscope,TEM) 对产物进行了选区电子衍射分析,加速电压160 kV,放大倍数200~50 000。FT-IR分析采用美国 Thermo-Nicolet Avatar-360傅立叶红外光谱仪,样品与KBr混合压片后测试,波数范围 4 000~400 cm-1。
2 结果与讨论
2.1 产物的形貌与组成分析
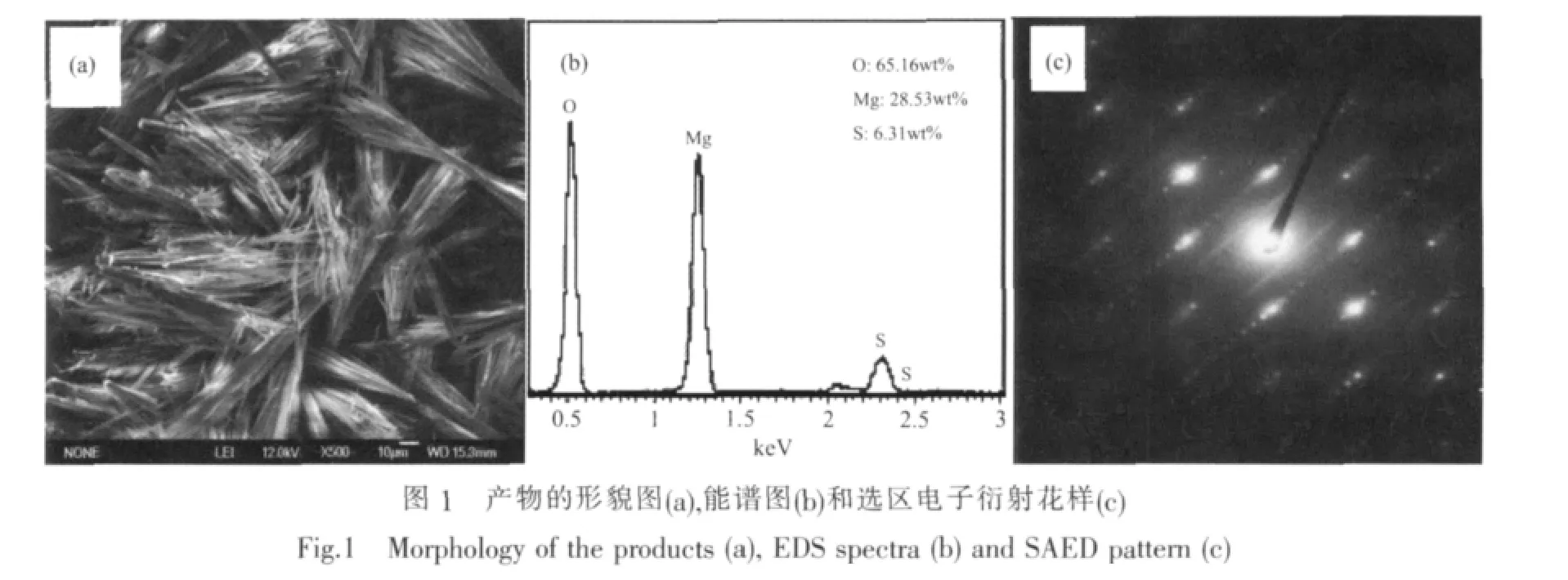
以氯化镁、氨水和硫酸镁为原料,在190℃水热反应5 h所的产物形貌和组成见图1。
SEM照片(图1a)表明,所得的晶须产品呈纤维状,一端聚集成扇形,直径为 0.5~2 μm,长径比为50~200,晶须表面光滑且纤细匀整。晶须的能谱(EDS)分析(图 1b)结果表明,主要元素 O∶Mg∶S 的质量百分比约为 65.16∶28.53∶6.31,与 MgSO4·5Mg(OH)2·2H2O中3种元素的组成基本一致。为了对产物的结构进行进一步研究,对图1a中的晶须进行了选区电子衍射(SAED)分析,如图1c所示。该图谱由很多明锐的衍射点有规律的排列而成,形成的阵列为典型的单晶衍射图谱,这为碱式硫酸镁晶须单晶结构的确定提供了有力的证据。
XRD衍射图(图2)表明产物的衍射峰与MgSO4·5Mg(OH)2·2H2O(PDF No.86-1322)的衍射峰一致,不存在其他杂质峰,且峰强较强,峰型尖锐,表明合成的碱式硫酸镁晶须发育完整,具有较高的结晶度且纯度较高。
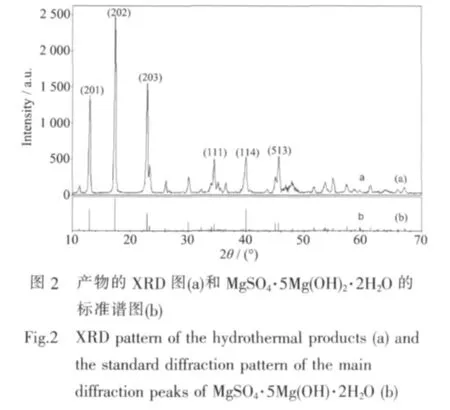

图3为产物的FT-IR谱图,在3 654 cm-1附近有一吸收峰,表明产物中存在-OH键;而在3 449 cm-1附近也有吸收峰,表明还有部分羟基之间形成了氢键。此外在1 654 cm-1附近的吸收峰则是H2O的弯曲振动吸收峰,表明产物中的-OH部分以H2O的形式存在。结晶水合物中的水既能以弱的氢键与阴离子结合,也能以弱的配位键与金属离子结合。其中的配位水处于中心原子的配位层中,以配位键与金属阳离子连接,其光谱与液态水的类似。图3中818 cm-1附近有较强吸收峰,说明在产物中存在H2O与Mg2+间的配位键。
SO42-为四面体结构[14],属Td点群,有9个振动自由度,存在 4 个振动模:V1(A,R),V2(E,R),V3,V4(F,IR+R)。三重简并的反对称伸缩V3(1 105 cm-1)和弯曲模V4是红外和拉曼双活性的,但阳离子和外部环境的不同可造成SO42-的外部势场不同,会使SO42-的正四面体结构畸变,这就使得V3在1 050~1 200 cm-1(强)的范围出现,而 V4在 600~700 cm-1(中强)的范围变动。图3中,在1 115 cm-1和643 cm-1附近各有一强吸收峰,表明产物中存在SO42-。但SO42-的正四面体构型变为畸变四面体,引起SO42-的特征吸收峰型分叉,出现多个吸收峰。
2.2 晶体生长机理模型
高温结晶过程是一个比较复杂的过程,通常包括溶质由液相主体向晶格表面的扩散过程、溶质在固液界面上的化学反应过程和晶体生长过程。从宏观角度来看,晶体的生长过程实际上是晶体-环境相(蒸气、溶液、熔体)界面向环境相中不断推移的过程,也就是包含组成晶体单元的母相从低秩序相向高度有序晶相的转变。从微观角度来看,晶体生长过程可看作是一个“基元”过程,“基元”可以是原子、分子,也可以是具有一定几何构型的原子(分子)聚集体,环境相及生长条件的影响集中体现在基元的形成过程。不同结构的晶体具有不同的生长形态。对于同一晶体,不同的生长条件可能产生不同结构的生长基元,最终形成不同形态的晶体。其生长机理主要包括扩散控制晶体生长、多核控制晶体表面生长、单核控制晶体表面生长以及线性控制晶体表面生长等几种模型[15-21]。对结晶过程而言,主要有以下4种动力学模型:
(1)扩散控制晶体生长模型MA:

(2)多核控制晶体表面生长模型MB:

(3)单核控制晶体表面生长模型MC:

(4)线性控制晶体表面生长模型MD:

式中:幂指数 p为表面反应级数,p=1,2,3,4 的任一整数。当 P为 1,2,3,4 时,生长模型 MB、MC、MD 则分别对应于 MB-1、MB-2、MB-3、MB-4、MC-1、MC-2、MC-3、MC-4、MD-1、MD-2、MD-3、MD-4。
2.3 水热条件下碱式硫酸镁晶须结晶动力学研究
2.3.1 水热温度对晶须形貌的影响
为考察温度对MHSH晶须合成的影响,于150℃、170℃、190℃、210℃ 4个温度下进行水热反应,对产物进行了SEM分析(图4)。可以看出,反应温度为150℃时,产物为片状Mg(OH)2;170℃时,产物为针状晶须与片状Mg(OH)2的混合物;190℃时,片状物消失,产物为纯净的晶须,具有较高的长径比,晶须一端明显的聚集到一起形成扇形;继续升高温度至210℃时,产物形貌变化不大。

2.3.2 水热时间对晶须形貌的影响
图5为镁离子浓度为 0.5 mol·L-1,190 ℃下反应不同时间所得产物的SEM照片。由图可见,反应时间为1 h时,产物全部为片状,没有针状产品出现;反应时间为2 h时,产物中开始出现直径不均匀的针状晶须,但产物仍以片状为主;反应3 h时,晶须逐渐发育完全,产物为一端聚集的扇形晶须,晶须直径约为 0.5~2 μm,长径比为 50~200,但夹杂少量的片状物;反应5 h所得产物为纯净的扇形晶须,外观更加均匀。进一步延长时间至20 h对产物的形貌影响不大。
晶须是一种特殊形态的晶体,其生长有几个明显的阶段,即导致成核的诱导期、作为主生长的初级阶段、二次增厚生长或过生长阶段、减慢或终止生长阶段。从动力学角度分析认为,在水热合成反应制备晶须过程中,始终伴随着晶核形成和长大的过程。随着反应时间的延长,溶液中Mg2+、OH-和SO42-浓度不断降低,过饱和度的减小直接造成了晶须生长速率的降低。因此,反应一段时间后,溶液的过饱和度降低,继续延长时间对晶须的生长已无多大影响。

2.3.3 水热过程晶须的结晶动力学
为了求取水热过程中碱式硫酸镁晶须的生长动力学模型参数,分别测定了170℃、180℃、190℃、200 ℃、210 ℃下反应 1 h、2 h、3 h、5 h、20 h 时反应体系中硫酸根离子浓度,结果见图6。

根据2.2所述,对结晶过程而言,有4种动力学模型,这4种动力学模型可统一写为:

将图6中的数据分别代入式5,并假定反应20 h的浓度为平衡浓度,利用MATLAB软件和Runge-Kutta算法对式5进行积分,可得

其中f(c)、g(c)均为浓度c的函数。若所代入的动力学模型恰能正确的描述碱式硫酸镁的结晶动力学机理,则用g(c)对t作图必是一条直线,相关系数R2越接近于1,模型的吻合性越好,斜率则是速率常数k。不同模型的g(c)~t图的相关系数列于表1。表2为不同温度的结晶动力学模型及速率常数。
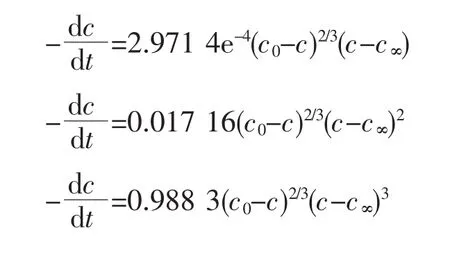
分析表1和2中的数据可知,反应温度为170、180、190℃时的动力学模型分别为MB-1、MB-2和MB-3,结晶机理为多核控制表面生长,结晶速率由表面反应控制。这种机理不需要很高的活化能,机理诱导期短。对应的反应动力学方程分别为:反应温度为200℃和210℃时,结晶机理发生了变化,为单核控制表面生长。此时结晶速率受控于表面反应,这种机理所需要的活化能较高,诱导期较长。动力学方程中(c0-c)2/3或(c0-c)3/4项相当于晶体生长可以得到的表面积,(c-c∞)p项则相当于溶液的过饱和度,是结晶反应的推动力。随结晶反应进行,表面积增大,过饱和度减小,这与晶须的生产过程相吻合。其结晶动力学模型分别为MC-2和MC-3,对应的反应动力学方程分别为:
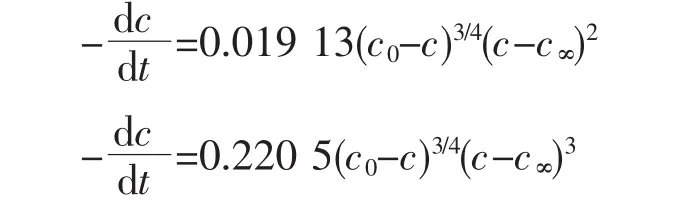
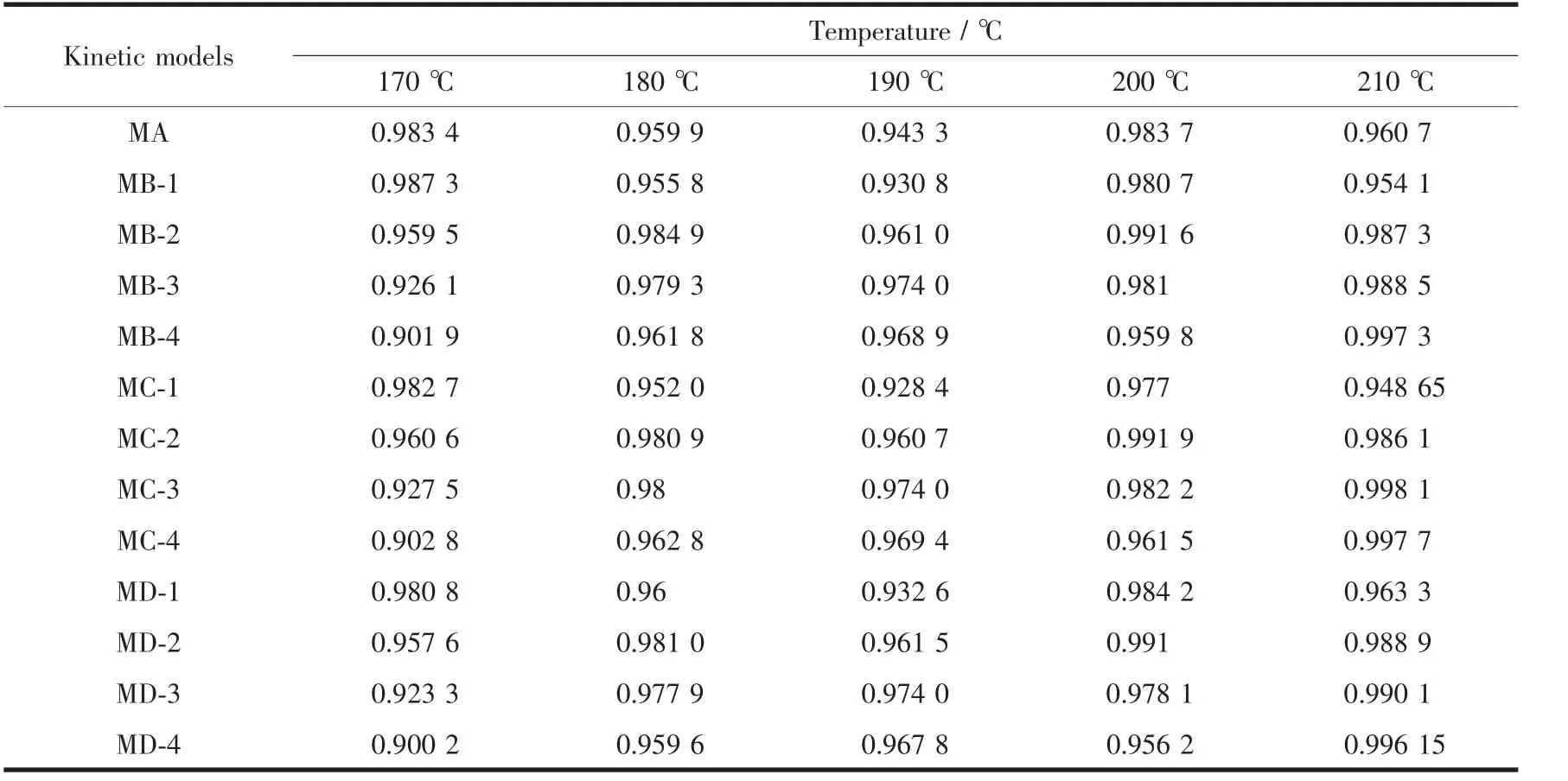
表1 4种动力学模型的g(c)~t图的相关系数Table 1 Correlation coefficient R2of g(c)~t for the four models
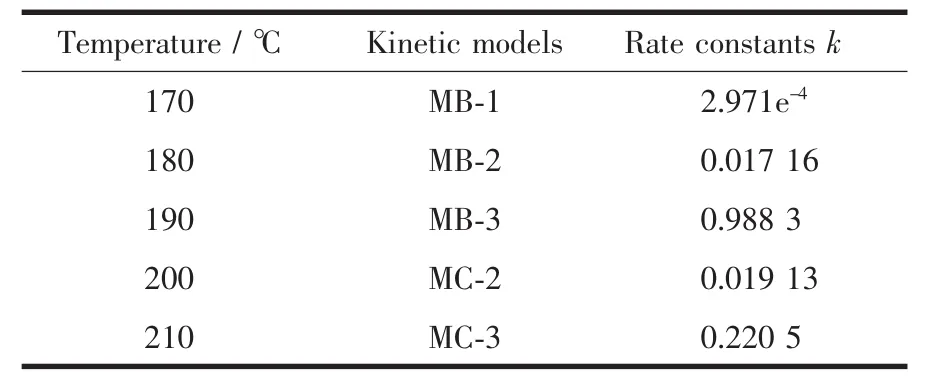
表2 不同温度的结晶动力学模型及速率常数Table 2 Kinetic models and rate constants for different temperature
3 结 论
通过测定不同温度下SO42-浓度随时间的变化,对MHSH晶须的结晶动力学进行了研究。结果表明,在相对较低的反应温度170、180、190℃时,结晶动力学模型分别为MB-1、MB-2和MB-3,是由表面反应控制的多核生长机理;而在相对较高的反应温度200℃和210℃时,结晶动力学模型分别为MC-2和MC-3,是由表面反应控制的单核生长机理。
[1]NAI Xue-Ying(乃学瑛),YE Xiu-Shen(叶秀深),CUI Xiang-Mei(崔香梅),et al.J.Salt Lake Res.(Yanhu Yanjiu),2005,13(3):22-28
[2]Sun X T,Shi W T,Xiang L,et al.Nanoscale Res.Lett.,2008,3(10):386-389
[3]HAN Yue-Xin(韩跃新),LI Li-Xia(李丽匣),YIN Wan-Zhong(印万忠),et al.J.Northeast.Univ.(Dongbei Daxue Xuebao),2009,30(1):133-136
[4]ZHU Li-Xia(朱黎霞),YUE Tao(岳涛),GAO Shi-Yang(高世扬),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2003,19(1):99-102
[5]MA Zhi-Ling(马志岭),JIA Wei(贾巍),GAO Wen-Gui(高 文贵),et al.Inorg.Chem.Ind.(Wujiyan Gongye),2006,38(4):40-41
[6]Ding Y,Zhang G T,Zhang S Y,et al.Mater.Chem.Phys.,2000,12(10):2845-2852
[7]LIU Feng(刘峰),XIANG Lan(向兰),JIN Yong(金涌).J.Inorg.Mater.(Wuji Cailiao Xuebao),2004,19(4):784-788
[8]Lü X T,Bala H,Li M G,et al.Colloids Surf.A,2007,296(1-3):97-103
[9]Gao C H,Li X G,Feng L J,et al.Chem.Eng.J.,2009,150(2-3):551-554
[10]Yan X,Xu D,Xue D.Acta Mater.,2007,55(17):5747-5757
[11]Tao Y,Gao S H,Zhu L X,et al.J.Mol.Struct.,2002,616(1-3):247-252
[12]Xiang L,Liu F,Li J.Mater.Chem.Phys.,2004,87(2-3):424-429
[13]ZHANG Da-Hai(张大海).Thisis for the Doctorate Degree of Ocean University of China(中国海洋大学博士论文).2004.
[14]XUE Jian-Rong(薛建荣).Thisis for the Master Degree of Inner Mongolia University of Technology(内蒙古工业大学硕士论文).2007.
[15]LI Wu(李武),GAO Shi-Yang(高世扬).J.Salt Lake Res.(Yanhu Yanjiu),1994,10(3):1-3
[16]YAO Zhan-Li(姚占力),GAO Shi-Yang(高世扬),ZHU Li-Xia(朱黎霞).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),1995,3(4):419-423
[17]ZHU Li-Xia(朱黎霞),GAO Shi-Yang(高世扬),XIA Shu-Ping(夏树屏),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),1997,13(3):258-264
[18]DUAN He(段鹤),ZHENG Yu-Feng(郑毓峰),ZHANG Xiao-Gang(张校刚),et al.Acta Phys.Sin.(Wuli Xuebao),2005,54(4):1659-1664
[19]WEI Zhong-Qing(魏钟晴),MA Pei-Hua(马培华).J.Salt Lake Res.(Yanhu Yanjiu),1995,11(4):1-4
[20]ZHENG Yan-Qing(郑燕青),SHI Er-Wei(施尔畏),LI Wen-Jun(李汶军),et al.J.Inorg.Mater.(Wuji Cailiao Xuebao),1998,14(3):1-4
[21]WANG Ping(王萍),SHEN Yu-Hua(沈玉华),XIE An-Jian(谢安建).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2010,26(6):1089-1094
Hydrothermal Crystallization Kinetics of Magnesium Hydroxide Sulfate Hydrate Whiskers
GAO Chuan-Hui1WANG Chuan-Xing1XU Jun1WU Yu-Min*,1LI Xian-Guo2
(1College of Chemical Engineering,Qingdao University of Science and Technology,Qingdao,Shandong 266042,China)
(2Key Laboratory of Marine Chemistry Theory and Technology,Ministry of Education,Ocean University of China,Qingdao,Shandong 266100,China)
Magnesium hydroxide sulfate hydrate whiskers were prepared by a hydrothermal method and scanning electron microscope,transmission electron microscope,X-ray powder diffraction and energy dispersive X-ray spectroscopy were employed to investigate composition and morphology of the products.Crystallization kinetics of the whisker was studied by analyzing the change of SO42-ion concentration through the hydrothermal process at different temperatures.Experimental data were handled using software MATLAB and numerical solution of Runge-Kutta and crystallization kinetics equations at different temperatures were obtained according to the above mentioned analysis.The results showed that the mechanism for crystal growth was different when the whiskers were synthesized at different temperatures.When the reaction occurred at 170℃,180℃ and 190℃,the crystallization was controlled by multi-core surface growth,and the dynamic models for the crystallization were MB-1,MB-2 and MB-3,respectively.While it changed to be controlled by single-core surface growth when the reaction temperature was 200℃or 210℃and the dynamic models became MC-2 and MC-3 correspondingly.
magnesium hydroxide sulfate hydrate;crystallization;kinetic;hydrothermal synthesis
O614.22
A
1001-4861(2012)10-2198-07
2012-03-29。收修改稿日期:2012-04-23。
国家自然科学基金(No.21106075)和山东省博士后创新项目专项资金(No.201003052)资助项目。
*通讯联系人。E-mail:wuyumin005@163.com
