过渡金属离子掺杂Zn3(OH)2V2O7·2H2O的合成及其光催化性质
2012-09-15蒋亚琪贺淳晓贾艳艳谢兆雄
蒋亚琪贺淳晓 贾艳艳 谢兆雄
(厦门大学固体表面物理化学国家重点实验室,厦门大学化学化工学院化学系,厦门 361005)
过渡金属离子掺杂Zn3(OH)2V2O7·2H2O的合成及其光催化性质
蒋亚琪*贺淳晓 贾艳艳 谢兆雄
(厦门大学固体表面物理化学国家重点实验室,厦门大学化学化工学院化学系,厦门 361005)
利用水热法合成了3d过渡金属离子掺杂Zn3(OH)2V2O7·2H2O的微米花结构,其分子式可表达为Zn3-3xM3x(OH)2V2O7·2H2O(其中 M=Cu,Co,Ni,Mn;0.001≤x≤0.20)。应用 XRD、SEM、TEM、UV-Vis DRS、EDX 和 BET 等分析测试技术对产物进行了表征。结构和形貌分析结果显示过渡金属离子掺杂后产物仍保持Zn3(OH)2V2O7·2H2O的六方晶体结构,微米花由主晶面为(0001)的纳米片组装而成。紫外-可见漫反射光谱显示过渡金属离子掺杂后带边吸收红移,其中以Cu的掺杂产物Zn3-3xCu3x(OH)2V2O7·2H2O最为明显,带边吸收扩展到可见光区。首次对Zn3(OH)2V2O7·2H2O及其不同金属离子掺杂产物Zn3-3xM3x(OH)2V2O7·2H2O进行了可见光催化降解有机污染物的研究,结果显示与其它产物相比掺0.1at%Cu的Zn2.997Cu0.003(OH)2V2O7·2H2O对亚甲基蓝(MB)的可见光催化降解效果最好。对掺杂离子种类、掺杂离子浓度对产物可见光催化性质的影响也进行了考察。
过渡金属离子;掺杂;Zn3(OH)2V2O7·2H2O;可见光催化
0 引 言
随着全球工业化的不断发展,环境污染日益严重,治理环境已成为当今社会最迫切需要解决的难题之一。近年来,基于金属氧化物纳米材料的光催化氧化技术为治理废水、清除环境中的有毒物质提供了一条新途径[1-3],据文献报道,二氧化钛[4-6]、钒酸铋[7-9]、钨酸铋[10-11]、硫铟锌[12]、磷酸银[13]及钒酸锌[14]等均具有优良的光催化活性,对甲基橙(MO)、亚甲基蓝(MB)、刚果红(CR)及罗丹明B染料等都有很好的光降解效果。众所周知,纳米材料的尺寸和形貌可以显著影响材料的光电性质和光催化性质,因此,如何合成出特定晶面裸露的纳米晶以增强材料的光催化性质受到广泛的研究和关注。例如,Han[4]等通过水热法合成的具有89%(001)面裸露的TiO2纳米片,其光催化活性大大超过商业光催化剂P25;Ye[9]等合成的具有(001)面裸露的BiVO4纳米片提高了可见光催化降解罗丹明B的效率。
根据文献的理论计算结果,V的3d轨道能量低于其它第一过渡系的过渡金属,可降低能带中导带的能级,因此,含V氧化物及其复合氧化物可作为潜在的可见光催化材料[15]。焦钒酸锌Zn3(OH)2V2O7·2H2O是一种重要的过渡金属钒酸盐,其晶体结构属六方晶系,结构由Zn-O四面体层和V-O八面体层交替连接成多孔的网络结构[16]。Zn3(OH)2V2O7·2H2O的带隙约3.4 eV,最近有文献报道Zn3(OH)2V2O7·2H2O在紫外光条件下可催化降解有机污染物亚甲基蓝,并且它在锂离子电池负极材料、荧光材料等方面也有潜在的应用[17-18]。作为高效光催化剂的重要因素是一方面具有较小的半导体带隙和合适的带边位置,半导体带边吸收可扩展到可见光区,充分利用太阳能;另一方面是光诱导产生的光生电子和空穴对能有效分离,减少复合。目前通过对光催化材料的改性,包括如金属或非金属离子掺杂、形成固熔体和染料敏化等手段以减小带隙、控制能带结构和改善可见光驱动活性,达到改善半导体光催化性质的目的[19-22]。其中过渡金属离子的掺杂,可在本征半导体中形成中间能带、引入缺陷位,从而扩展光吸收范围,提高光催化活性。以对高效光催化剂TiO2的研究为例,Choi[23]曾报道在掺杂的20余种过渡金属离子中,Fe3+、Mo5+、Os3+、Ru3+、Re5+、V4+和 Rh3+等离子的掺杂显著改善了TiO2的光催化氧化和还原性质。研究发现掺杂金属离子的d轨道电子组态、d轨道电子的给电子能力、掺杂浓度和掺杂元素的分布等均对催化性质产生影响。同时,少量掺杂离子的存在有利于减少半导体光生电子和空穴的复合,提高光量子产率,改善光催化性能[24-27]。
因此,本研究工作选择 Cu2+、Co2+、Ni2+、Mn2+作为掺杂离子,采用水热法制备了3d过渡金属离子掺杂Zn3(OH)2V2O7·2H2O的微米花结构。首次在可见光条件下考察了产物对有机污染物亚甲基蓝(MB)的光催化活性。同时,对过渡金属离子的掺杂量、掺杂离子种类等对产物光催化活性的影响也进行了考察。本研究工作为半导体材料的改性、掺杂提供了实验依据。
1 实验部分
1.1 Zn3-3xM3x(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)的制备
按Zn3-3xM3x(OH)2V2O7·2H2O化学式中元素的计量比分别称取Zn(NO3)2·6H2O、NaVO3和相应重量的硝 酸 盐 (Cu(NO3)2·3H2O,Co(NO3)2·6H2O,Ni(NO3)2·6H2O或Mn(NO3)2),加入到32 mL去离子水中。将混合物磁力搅拌30 min后转移到40 mL容量的聚四氟乙烯反应釜中,反应温度60℃、反应时间20 h。产物经过离心分离后,依次用去离子水和无水乙醇多次洗涤,干燥备用。
1.2 测试表征
产物相分析X射线粉末衍射(XRD)采用Philips Panalytical Xpert X射线衍射仪 (Cu靶Kα辐射,λ=0.154 06 nm,工作电压 40 kV,工作电流 30 mA);产物的形貌和结构分析采用日本Hitachi S-4800扫描电子显微镜(SEM)和JEOL JEM-2100透射电子显微镜 (TEM,加速电压200 kV);产物的元素分析由Hitachi S-4800扫描电子显微镜搭载的能量色散X射线光谱仪(EDX)完成;紫外-可见漫反射光谱(UVVis DRS)测试采用美国Varian Cary-5000紫外-可见光度计;样品的比表面积利用美国麦克仪器公司ASAP-2020比表面积和孔隙率测试仪在77 K测试N2的等温吸脱附曲线并按照Brunauer-Emmett-Teller(BET)方法计算得到。所有的SEM样品均为产物的乙醇悬浮液滴加到硅片上制作而成。所有的TEM样品均为产物的乙醇悬浮液滴加到包覆碳膜的铜网上制作而成。
1.3 光催化性能测试
(1)光催化降解亚甲基蓝效率测定:在反应器中加入50 mg所合成的光催化剂样品和100 mL去离子水。超声分散后,在此悬浮液中加入1 mL 1.0×10-5mol·L-1的亚甲基蓝(MB)水溶液。反应悬浮液采用78-1型磁力搅拌器 (江苏金坛市环宇科学仪器厂)在暗环境下充分搅拌30 min,使MB达到吸附饱和(吸光度标记为A0)。用500 W的Xe灯(420 nm滤光片滤去紫外光)进行可见光照射,液面与灯的距离为20 cm,每隔30 min取定量悬浊液离心分离,用日本日立公司Hitachi UV-2550紫外可见分光光度计测定离心后上层清液的吸光度 (标记为At),吸收波长为664 nm。催化剂对MB的降解效率,按MB浓度随时间的变化表示。所有光催化实验都在(25±2)℃条件下完成。
(2)对苯二甲酸(TA)荧光探针实验:TA与羟基自由基(·OH)反应生成 2-羟基对苯二甲酸(TAOH),受320 nm光的激发TAOH有强的荧光发射,峰值426 nm。因此,通过TA荧光探针法可测定光催化剂产生·OH的能力[28]。实验具体步骤如下,在反应器中制备 3.6 mmol·L-1TA 和 0.01 mol·L-1NaOH 的碱性溶液100 mL,经超声分散后加入50 mg所合成的催化剂。反应悬浮液采用78-1型磁力搅拌器在暗环境下充分搅拌30 min。用500 W的Xe灯 (用420 nm滤光片滤去紫外光)进行可见光照射,液面与灯的距离为20 cm,每隔1 h取定量悬浊液离心分离,用日本日立公司F-7000荧光光谱仪测定离心后上层清液的荧光强度(Xe灯光源,激发波长320 nm)。所有光反应实验都在(25±2)℃条件下完成。
2 结果与讨论
2.1 物相及形貌表征
对纯Zn3(OH)2V2O7·2H2O和过渡金属离子掺杂浓度 0.1at.%的 Zn2.997M0.003(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)以及Cu2+离子不同掺杂浓度的Zn3-3xCu3x(OH)2V2O7·2H2O(x=0.001、0.01、0.05、0.20)进行了 X 射线粉末衍射。如XRD图(图1)所示,所有样品的衍射峰均可与六方晶系Zn3(OH)2V2O7·2H2O(PDF No.87-0417)的标准衍射峰完好匹配,而且衍射图中没有出现任何杂峰,表明合成的产物保持六方相Zn3(OH)2V2O7·2H2O结构,且产物纯度高。未掺杂样品Zn3(OH)2V2O7·2H2O与金属离子掺杂浓度0.1at%的4个样品 Zn2.997M0.003(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)的衍射峰峰形尖锐、半峰宽较窄,说明样品有很好的结晶度。而且,如图1g所示Cu2+的掺杂浓度达到20.0at%也没有其它杂相如Cu的氧化物的衍射峰出现,说明过渡金属离子可以以较大的原子比均匀地掺杂在Zn3(OH)2V2O7·2H2O的晶体结构中,部分取代结构中的Zn2+。仔细观察Cu2+不同掺杂浓度的样品 Zn3-3xCu3x(OH)2V2O7·2H2O(图 1d-g),可发现随着Cu2+掺杂浓度的增大样品XRD的峰形变宽,衍射峰位置不同程度地发生偏移。图1的内嵌图(局部放大图)清楚地显示,与纯 Zn3(OH)2V2O7·2H2O(图 1o)相比,随着Cu2+掺杂浓度的增加样品衍射峰的2角逐渐向高角度方向移动,掺杂浓度达到5.0at%和20.0at%的掺杂样品其峰位移更加明显。利用X′pert Highscore程序对XRD图进行谱峰拟合(profile fitting)后得到较精确的半峰宽数据,再据此利用Scherrer公式 D=kλ/(βcosθ)计算得到样品的平均晶粒度。同时,我们还应用结构精修程序对掺杂样品进行了晶胞参数精修,样品的晶胞参数和计算得到的平均晶粒度数据综合列于表1。从表1可看出,与纯Zn3V2O7(OH)2·2H2O相比,由于金属离子的掺杂,样品的晶胞参数出现不同程度的膨胀或收缩。例如,随着Cu掺杂量的增加,晶体结构收缩、晶胞体积减小,并且样品晶胞体积的收缩量随着掺杂量的增大呈现增大的趋势。原因应该是由于半径较小的Cu2+(r=0.072 nm) 掺杂后取代 Zn2+的位置 (r=0.074 nm)造成的。平均晶粒度的计算结果表明由于离子掺杂,样品的平均晶粒度变小,0.1at%M掺杂样品的平均晶粒度在 29.2~31.0 nm 之间。随着 Cu2+掺杂浓度的增加平均晶粒度逐渐减小,其晶粒度从零掺杂的 29.8 nm 逐渐减小到 21.5 nm(20.0at%Cu)。上述对样品粉末衍射花样的结构分析不仅证明了掺杂离子不是像有些半导体材料的掺杂那样,其掺杂离子仅以氧化物的形态分散在主体结构中[29],而是进入本体材料Zn3V2O7(OH)2·2H2O的晶格相中;同时结果还证实了掺杂离子浓度对晶胞结构参数和样品晶粒度的影响。除此之外,我们还合成了过渡金属离子不同掺杂浓度的样品Zn3-3xM3x(OH)2V2O7·2H2O(M=Co,Ni,Mn;x=0.001,0.01,0.05,0.20)。对所有样品的EDX分析测定结果显示样品中M的掺杂浓度均与投料比基本保持一致。
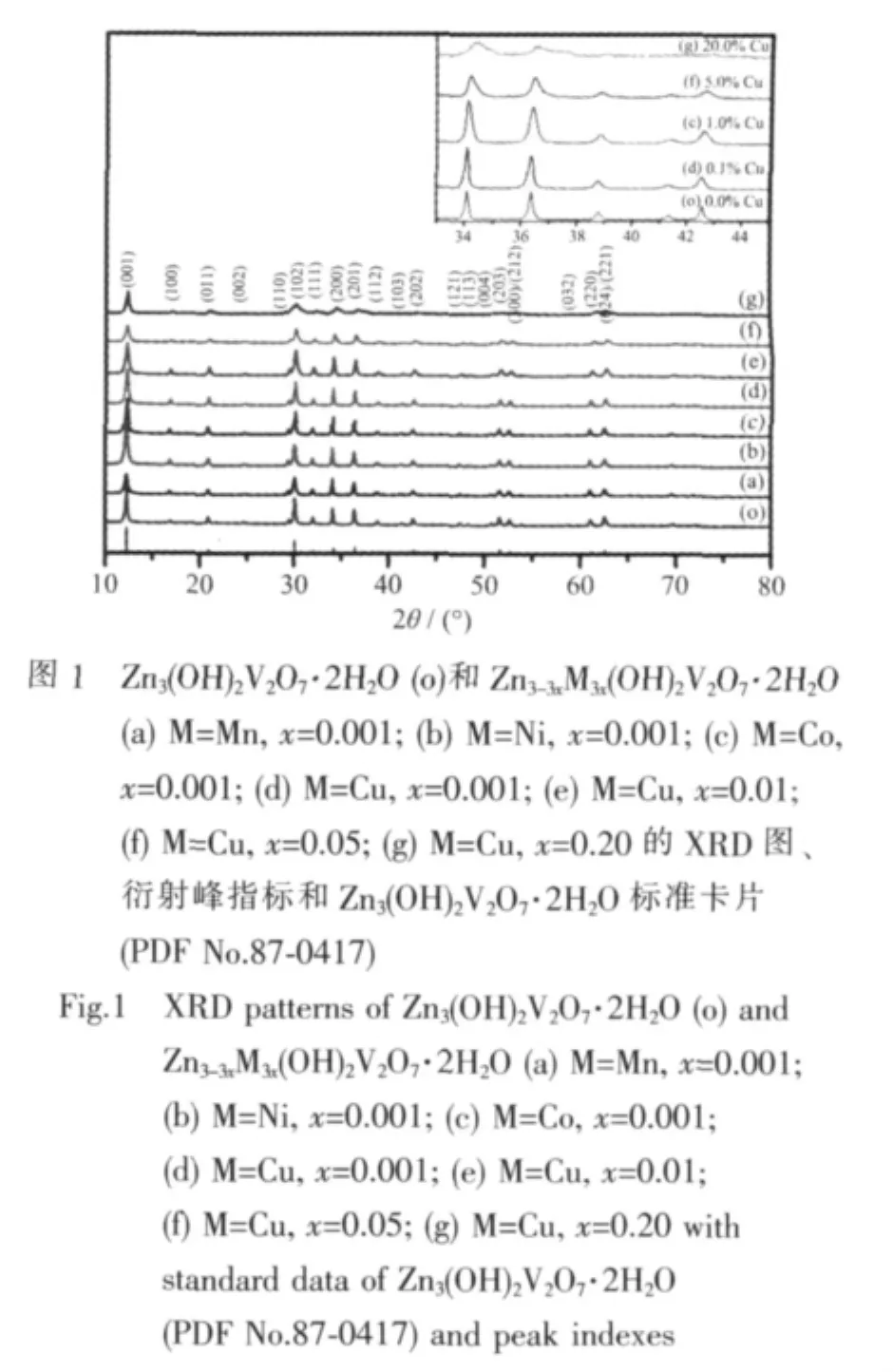
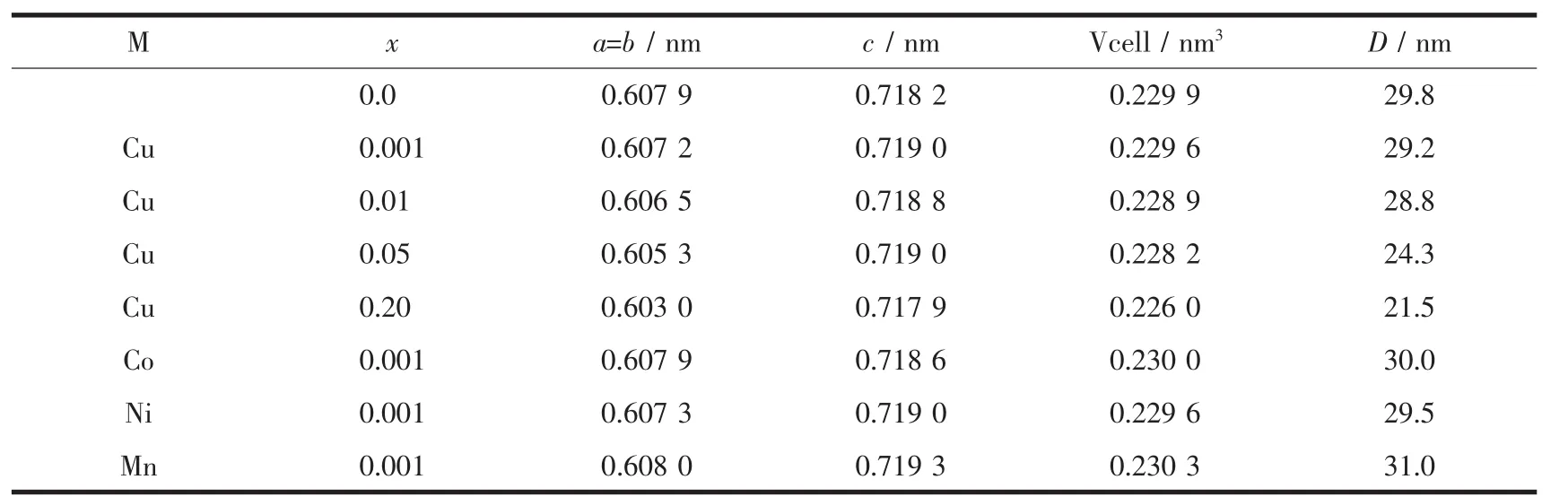
表1 Zn3-3xM3x(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)的晶胞参数及平均晶粒度Table 1 Lattice parameters of a set of Zn3-3xM3x(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)

图2 是Zn3(OH)2V2O7·2H2O 和 0.1at%M 掺杂样品 Zn2.997M0.003(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)的扫描电子显微(SEM)图、透射电子显微(TEM)图以及选区电子衍射(SAED)图。从图 2a-b Zn3(OH)2V2O7·2H2O低倍和高倍SEM图来看,样品都是约4 μm左右的类花状微米多级结构,每个微米花都由约20 nm厚,1.5 μm 左右大小的纳米片组成。图 2c~f是不同过渡金属离子掺杂 Zn3(OH)2V2O7·2H2O(0.1at%M)的SEM图,它们与Zn3(OH)2V2O7·2H2O相比,除花状的尺寸变小外,形貌没有发生明显的变化。对纯Zn3(OH)2V2O7·2H2O 以 及 Zn2.997M0.003(OH)2V2O7·2H2O进行了比表面积测试 (表2),从表2中可以看出掺杂 浓 度 0.1at%M的样 品 Zn2.997M0.003(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)的比表面积(18.21~19.05 m2·g-1)比未掺杂样品 Zn3(OH)2V2O7·2H2O的比表面积(16.40 m2·g-1)略大,说明掺杂后的产物颗粒变小。与前述平均晶粒度的计算结果相吻合。对Zn3(OH)2V2O7·2H2O 及 Zn2.997Cu0.003(OH)2V2O7·2H2O的单 个 微米花结构还进行了透射电镜分析,从图2g和2h可以清晰地观察到两者均是微米类花状结构。从选区电子衍射图(图2g和2h的内嵌图)可观察到其电子衍射斑点均呈现规则的六次轴对称性,均可指标化为六方相晶体 Zn3(OH)2V2O7·2H2O[0001]方向的衍射。电镜分析结果表明过渡金属离子掺杂的Zn2.997M0.003(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)微米花由主晶面为(0001)面的单晶纳米片组装而成,片与片之间如花瓣有一定的空隙。为了进一步了解掺杂对样品晶体生长的影响,我们还对Cu不同掺杂浓度的样品 Zn3-3xCu3x(OH)2V2O7·2H2O(x=0.001,0.01,0.05,0.20)进行了 SEM、TEM 表征(图 3)和 BET 测试(表2)。从SEM图(图3a-d)中可以看出,与未掺杂样品(图2b和2g)相比较,随着Cu2+掺杂浓度的增加,掺杂样品Zn3-3xM3x(OH)2V2O7·2H2O的花状结构尺寸逐渐变小,当掺杂量为20.0at%时,形貌由片状转化为颗粒。TEM图(图3e~h)给出了更清晰的图像,可以看出当Cu掺杂量为0.1at%时,材料还保持花状形貌,但花状尺寸由未掺杂的~4 μm减小到~1.5 μm;当掺杂量增至1.0at%时,材料结构少部分还保持花状,但大部分已经散开成片;当掺杂量为5.0at%时,材料已经完全散开成不规则的片状,片的尺寸~1 μm;掺杂量为20.0%,样品的形貌已经基本颗粒化,少量片状结构的大小~200 nm。因此,实验结果表明离子掺杂对微纳米晶体结构的生长有一定的阻碍作用,随着掺杂量增加材料形貌由微米片花结构向纳米颗粒转化。表2的BET测试结果显示随着 Cu2+掺杂浓度由 0.1at%增加至 5.0at.%,由于花状结构转化成片状和片状分散度降低等原因的影响,导致比表面积呈下降的趋势,由 19.05 m2·g-1降为 10.17 m2·g-1;但当 Cu2+掺杂浓度增至 20.0at%时,形貌基本颗粒化,其比表面积为 13.80 m2·g-1。

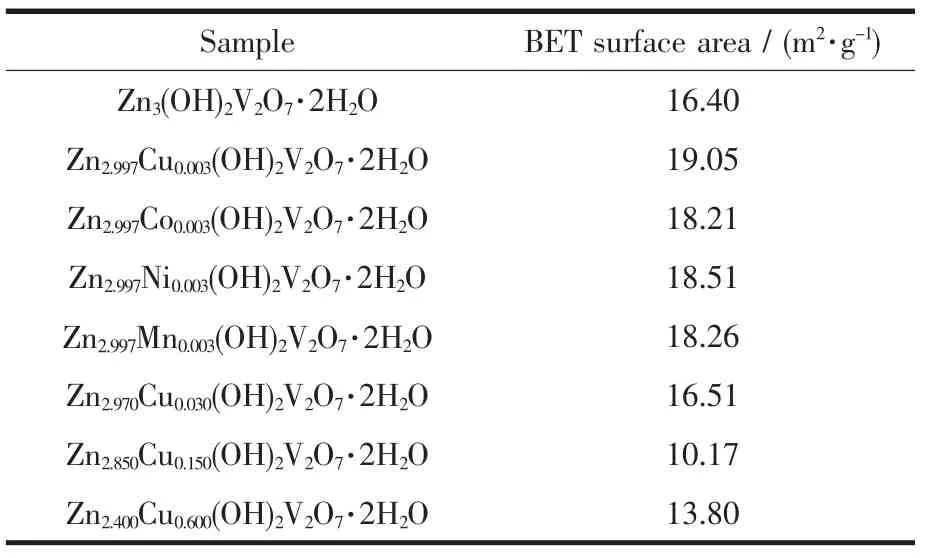
表2 Zn3(OH)2V2O7·2H2O 和 Zn3-3xM3x(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)的比表面积Table 2 BET surface areas of Zn3(OH)2V2O7·2H2O and Zn3-3xM3x(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)
2.2 紫外可见漫反射光谱
图4a是Zn3(OH)2V2O7·2H2O 和 0.1at%过渡金属离子掺杂Zn2.997M0.003(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)的紫外-可见漫反射光谱。从图中可以看出,Zn3(OH)2V2O7·2H2O 的吸收边为 375.1 nm,而经过过渡金属离子掺杂后产物的带边吸收均有不同程度的红 移,其中以 Cu2+掺 杂 产 物 Zn2.997Cu0.003(OH)2V2O7·2H2O的红移最为明显,其吸收边约为385.9 nm。根据Wood和Tauc[30]计算法推算出Zn3(OH)2V2O7·2H2O的直接带隙为3.30 eV,与文献报道的 3.4 eV相近,但比理论计算的3.03 eV大[14,16],同时推算出Zn2.997Cu0.003(OH)2V2O7·2H2O的直接带隙约为3.21 eV。仔细观察紫外-可见漫反射光谱还可发现其在500~650 nm处有一个微弱的吸收峰(图4a的插图),应该是由于掺杂引起的吸收红移。在前人的研究中也发生过类似的紫外-可见漫反射谱的红移现象。如Zou等[31]合成的 Ni掺杂InTaO4除在 300~400 nm处有强的吸收外,在420~520 nm附近还有一微弱的可见吸收,研究证实正是由于Ni3d轨道的参与,In0.9Ni0.1TaO4的带隙由 2.6 eV 减小为 2.3 eV,导致样品在可见光区的微弱吸收,改善了其可见光条件下催化光解水的能力。对Cu2+不同掺杂浓度的Zn3-3xCu3x(OH)2V2O7·2H2O也进行了 UV-Vis DRS分析,图4b显示随着Cu2+掺杂量的增加,吸收红移更加明显,预示掺杂产物固体能带的带隙减小,可见光驱动活性增强。离子掺杂常常导致半导体带边吸收向低能方向移动,如Cao[32]等在对TiO2掺杂Sn4+的研究中发现,Sn4+在本体能带之间形成电子给体能级,使实际带隙减少0.4 eV,大大改善了TiO2的可见光驱动活性。不同离子的掺杂对本体固体能带的影响机理比较复杂,根据据文献综述,与掺杂离子的d轨道电子组态、d轨道电子的给电子能力、离子半径、离子浓度、掺杂元素的分布等因素有关[33]。
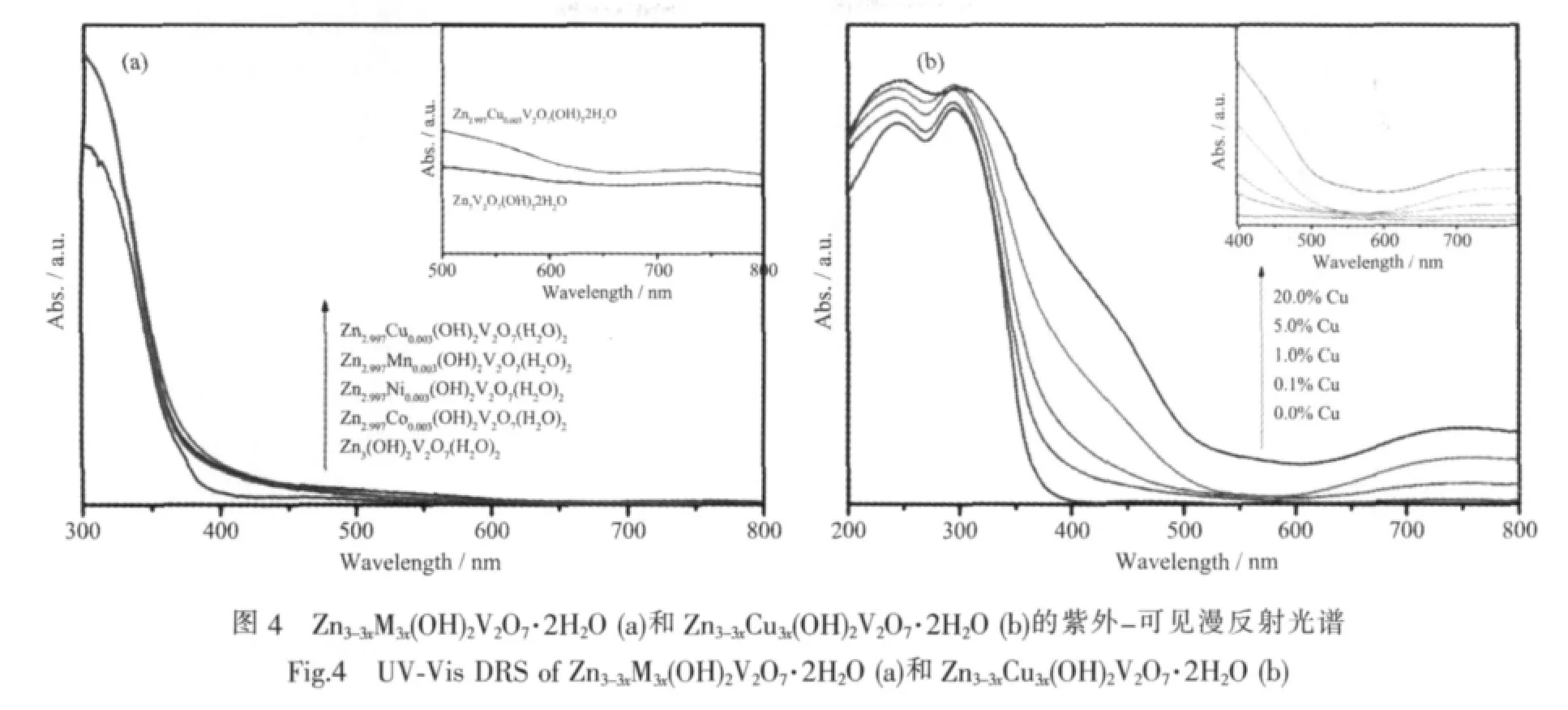
2.3 可见光催化性质
2.3.1 掺杂离子对可见光催化活性的影响
为了考察过渡金属离子掺杂对催化活性的影响,对未掺杂及对掺杂浓度为 0.1at%的 Zn2.997M0.003(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)进行了可见光条件下降解亚甲基蓝的实验,结果如图5所示。从图中可以看出,过渡金属离子掺杂后产物的光催化降解效率均有不同程度的提高,其中以Cu2+掺杂产物Zn2.997Cu0.003(OH)2V2O7·2H2O 提高最多。可见光催化效率提高的次序依次是掺杂 Mn2+<Ni2+<Co2+<Cu2+,与不同掺杂产物的UV-Vis DRS(图4a)光谱中带边吸收的红移规律相一致。结果说明与其它掺杂离子相比,Cu2+的定域d轨道电子、离子半径等均更加有利于与本体结构Zn3(OH)2V2O7·2H2O中导带/价带电子的相互作用,有效减小带隙,提高可见光激发光生电子和光生空穴对的能力,从而有效改善本体材料的可见光催化性质。在3d过渡金属中Cu可能是一个好的掺杂元素,如Kudo等[34]合成的Cu掺杂ZnS(Zn0.957Cu0.043S)能够可见光(420 nm)催化裂解水制H2;研究发现Cu2+掺杂的CaTiO3也是一个好的可见光催化剂[35]。由表 2 的结果来看,Zn2.997Cu0.003(OH)2V2O7·2H2O的比表面积19.05 m2·g-1高于其它3个掺杂样品,是其光催化性能优于其它样品的另一个因素。
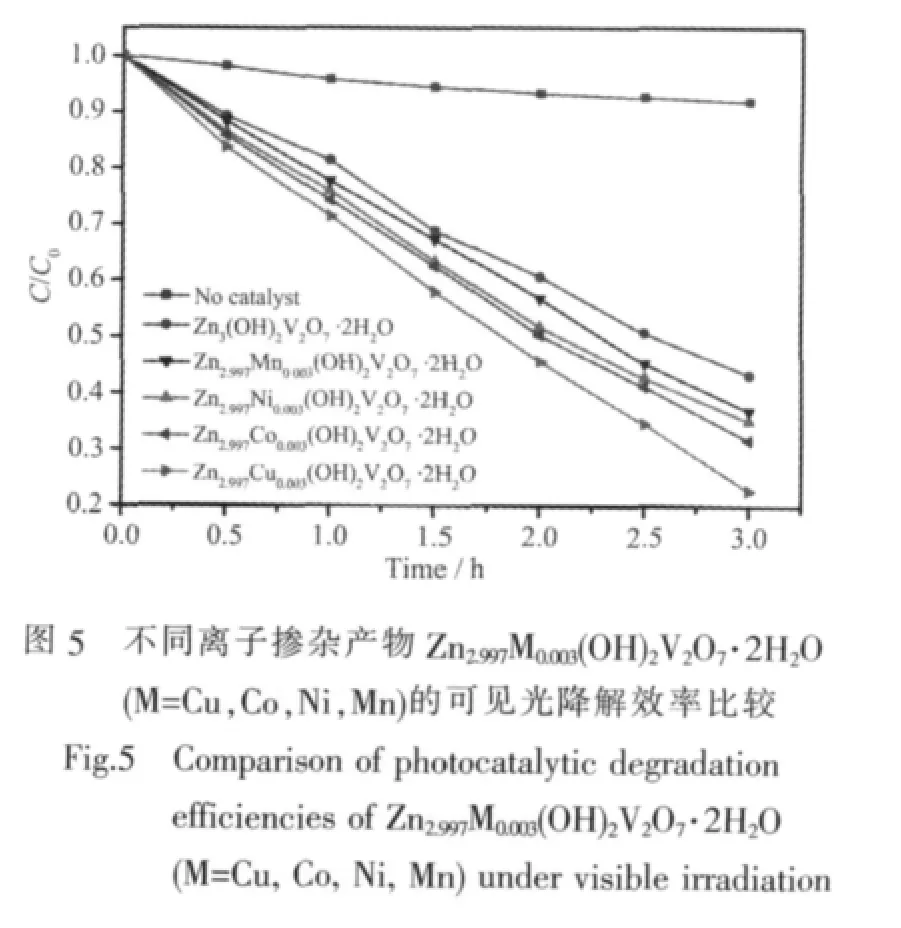
在可见光条件下比较了Zn2.997Cu0.003(OH)2V2O7·2H2O与P25的光催化性质,结果如图6所示。图6a显示可见光条件下Zn2.997Cu0.003(OH)2V2O7·2H2O的催化效率略高。由于P25的比表面积较大,约50 m2·g-1,如果进行比表面积归一化处理后,可以发现单位面积Zn2.997Cu0.003(OH)2V2O7·2H2O的可见光催化活性明显优于P25(图6b),其提高的原因可能是因为Zn3(OH)2V2O7·2H2O和P25都是宽禁带化合物,吸收光的范围在紫外光区。但前者的掺杂样品Zn2.997Cu0.003(OH)2V2O7·2H2O通过Cu2+掺杂在导带和禁带之间形成杂质能级,从而缩短了禁带宽度,扩展了光吸收范围,样品可以在可见光区吸收光子并激发产生电子-空穴对;而且,合成样品的高分散的二维片花状结构使用其更易于达到电子-空穴对的快速分离[4]。


利用TA作为荧光探针检测催化过程中产生的强氧化物种羟基自由基(·OH)是最近发展出的一种表征催化剂性质的新方法[28,36]。TA在碱性条件下与·OH反应生成的TAOH,在426 nm有强的荧光发射峰。选择0.1at.%M的4个掺杂样品Zn2.997M0.003(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn) 分别进行了 TA荧光探针实验。图7a是Zn2.997Cu0.003(OH)2V2O7·2H2O在含3.6 mmol·L-1TA的碱性溶液中不同可见光照射时间的上层清液荧光光谱图,激发光320 nm,峰值426 nm的荧光发射峰对应的正是TAOH的特征峰。由图可见随着反应时间增加,荧光峰越强,表明溶液中不断生成的·OH与TA反应,使溶液中TAOH浓度不断增加。图7b是Zn2.997M0.003(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn)作为可见光催化剂得到的TAOH荧光发射强度与反应时间的关系曲线。从图中可以看出,在任何反应时间区间内Zn2.997Cu0.003(OH)2V2O7·2H2O光催化反应后上层清液的荧光都最强,表明Cu2+掺杂产物产生强氧化物种OH的能力最强。TA荧光探针实验结果与不同掺杂离子产物对MB的可见光催化实验相一致,进一步证明与其它掺杂样品相比,Zn2.997Cu0.003(OH)2V2O7·2H2O在光催化反应过程中光的使用效率最高,可见光催化活性最强。
2.3.2 Cu掺杂浓度对可见光催化活性的影响
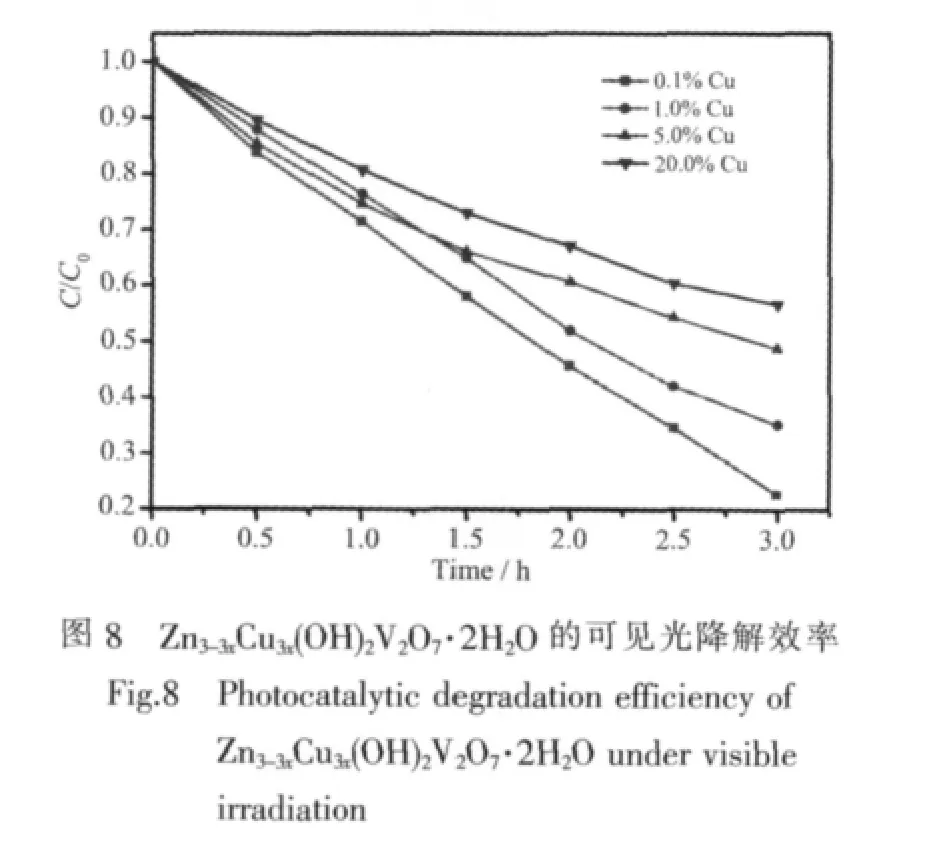
图8是Cu掺杂浓度0.1at%、1.0at%、5.0at%和20.0at%4个掺杂样品 Zn3-3xCu3x(OH)2V2O7·2H2O对MB的可见光降解效率比较图。从图中可以看出,0.1at%和1.0at%Cu的掺杂有利于提高Zn3(OH)2V2O7·2H2O的可见光催化活性,而继续增加掺杂离子浓度(如5.0at%和20.0at%)反而降低了Zn3(OH)2V2O7·2H2O的可见光催化活性。原因是由于过渡金属离子的掺杂可能在半导体价带附近形成给电子能级,减小带隙,增加可见光驱动活性;而且掺杂离子的存在有利于在光催化剂粒子中心和表面之间产生电势差,从而抑制电子-空穴对的加速复合,改善催化活性[32]。在本文中,少量Cu2+的掺杂确实明显改善了Zn3(OH)2V2O7·2H2O的可见光催化降解活性。但是,当离子的掺杂浓度继续增加时,掺杂离子可能作为光生电子-空穴对复合中心,掺杂浓度越大,复合位点越多,会导致光生电子-空穴对的快速复合,因而降低本体材料的光催化活性。因此,离子掺杂不是越多越好,而是存在一个最佳的掺杂浓度。在本研究中,0.1at%Cu掺杂的样品光催化效果最佳。
3 结 论
利用水热法合成了3d过渡金属离子掺杂的Zn3-3xM3x(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn;0.001≤x≤0.20)微米花结构。微米花由主晶面为(0001)的纳米片自组装而成。掺杂后的产物保持Zn3(OH)2V2O7·2H2O的六方晶体结构,但其固体能带的带边吸收因掺杂离子发生红移。掺杂产物Zn3-3xCu3x(OH)2V2O7·2H2O的带边吸收扩展到可见光区。对产物的可见光催化降解MB和TA荧光探针实验结果均表明,掺杂0.1at%Cu的样品 Zn2.997Cu0.003(OH)2V2O7·2H2O具有最佳的可见光催化活性。
[1]Legrini O,Oliveros E,Braun A M.Chem.Rev.,1993,93(2):671-698
[2]Hoffmann M R,Martin S T,Bahnemann D W,et al.Chem.Rev.,1995,95(1):69-96
[3]Bi Y P,Ouyang S X,Ye J H.J.Am.Chem.Soc.,2011,133:6490-6492
[4]Han X G,Kuang Q,Xie Z Z,et al.J.Am.Chem.Soc.,2009,131:3152-3153
[5]Pan J,Liu G,Lu G Q,et al.Angew.Chem.Int.Ed.,2011,50:1-6
[6]XUE Bin(薛斌),LIU Run(刘润),XU Zhu-De(徐铸德),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2009,25(1):1-6
[7]Kudo A,Omori K,Kato H.J.Am.Chem.Soc.,1999,121:11459-11467
[8]LIU Jing-Bing(刘晶冰),ZHANG Hui-Ming(张慧明),WANG Hao(汪浩),et al.Chinese J.Inorg.Chem.(Wuji HuaxueXuebao),2008,24(5):777-780
[9]Xi G C,Ye J H.Chem.Comm.,2010,46:1893-1895
[10]Amano F,Yamakate A,Ohtani B,et al.J.Am.Chem.Soc.,2008,130:17650-17651
[11]ZHANG Jian(章剑),ZHANG Yan(章燕),SHEN Yu-Hua(沈玉华),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2012,28(4):739-744
[12]Chen Z C,Li D Z,Fu X Z,et al.J.Phys.Chem.C,2009,113(11):4433-4440
[13]WANG Yun-Fang(王韵芳),FAN Cai-Mei(樊彩梅).Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2012,28(2):347-351
[14]Shi R,Wang Y J,Zhu Y F,et al.J.Mater.Chem.,2011,21:6313-6320
[15]Oshikiri M,Boero M,Ye J,et al.J.Phys.Chem.C,2002,117(15):7313-7318
[16]Zavalij P Y,Zhang F,Whittingham M S.Solid State Sci.,2002,4:591-597
[17]Ni S B,He D Y,Wang X H,et al.Mater.Lett.,2009,63:2459-2461
[18]Ni S B,Wang X H,He D Y,et al.Mater.Chem.Phys.,2010,124:803-808
[19]YAN Jian-Hui(阎建辉),HUANG Ke-Long(黄可龙),LIU Su-Qin(刘素琴),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2007,23(6):1005-1010
[20]CHEN Xiao-Yun(陈孝云),ZHANG Shu-Hui(张淑慧),HUANG Bi-Zhu(黄碧珠),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2012,28(2):307-313
[21]Robertson N.Angew.Chem.Int.Ed.,2008,47:1012-1014
[22]Wu G S,Nishikawa T,Chen A C,et al.Chem.Mater.,2007,19(18):4530-4537
[23]Choi W,Termin A,Hoffmann M R.J.Phys.Chem.,1994,98:13669-13679
[24]Zhang K,Jing D W,Guo L J,et al.Int.J.Hydrogen Energy,2010,35:2048-2057
[25]GUO Quan-Hui(郭泉辉),YANG Jian-Jun(杨建军),LI Qing-Lin(李庆霖),et al.Chem.Res.(Huaxue Yanjiu),2002,13(4):1008-1011
[26]Chen J H,Yao M S,Wang X L.J.Nanopart Res.,2008,10:163-171
[27]CHANG Lin(常琳),LIU Jing-Bing(刘晶冰),WANG Jin-Shu(王金淑),etal.ChineseJ.Inorg.Chem.(WujiHuaxueXuebao),2010,26(5):744-748
[28]Hirakawa T,Nosaka Y.Langmuir,2002,18(8):3247-3254
[29]Xu H,Li H M,Wu C D,et al.Mater.Sci.Eng.B,2008,147:52-56
[30]Wood D L,Tauc J.Phys.Rev.B,1972,5(8):3144-3151
[31]Zou Z G,Ye J H,Sayama K,et al.Nature,2001,414:625-627
[32]Cao Y,Yang W,Zhang W,et al.New J.Chem.,2004,28:218-222
[33]Chen X B,Shen S H,Mao S,et al.Chem.Rev.,2010,110(11):6503-6570
[34]Kuao A,Sekizawa M.Catal.Lett.,1999,58:241-243
[35]Nishimoto S,Matsuda M,Miyake M.Chem.Lett.,2006,35:308-309
[36]Xu D S,Li J M.Chem.Commun.,2010,46:2301-2303
Preparation,Characterization and Photocatalytic Properties of Transition Metal Ions Doping Zn3(OH)2V2O7·2H2O
JIANG Ya-Qi*HE Chun-Xiao JIA Yan-Yan XIE Zhao-Xiong
(State Key Laboratory of Physical Chemistry of Solid Surfaces,Department of Chemistry,College of Chemistry and Chemical Engineering,Xiamen University,Xiamen,Fujiang 361005,China)
Transition metal ions doping Zn3(OH)2V2O7·2H2O with micro flowerlike morphologies were successfully synthesized by a surfactant-free hydrothermal method,which formula can be presented as Zn3-3xM3x(OH)2V2O7·2H2O(M=Cu,Co,Ni,Mn;0.001≤x≤0.20).The as-prepared micro flowerlike structures were characterized by means of XRD,SEM,TEM,UV-Vis DRS,EDX and BET techniques.The results of structure and morphology analysis showed that 3d transition metal ions doped samples remained Zn3(OH)2V2O7·2H2O hexagonal structure,and the micro flowerlike structures were assembly of 2D nanosheets with(0001)main crystal facets.In UV-Vis DRS test,the spectra of as-prepared doping samples displayed red-shifts in the band-edge,and the red-shift value of Cu2+doped sample was largest.It was the first time undoping and transition metal ions doping Zn3(OH)2V2O7·2H2O were used as the photocatalysts for organic pollutant degradation under visible light irradiation.It was found that 0.1at%Cu doped sample Zn2.997Cu0.003(OH)2V2O7·2H2O exhibited the highest photocatalytic activity for visible degradation of methylene blue (MB)among the doping and undoping analogues.Moreover,the influence facts including type and doping concentration of transition metal ions on the visible-light-driven photocatalytic activity of Zn3-3xM3x(OH)2V2O7·2H2O were also investigated.
transition metal ion;doping;Zn3(OH)2V2O7·2H2O;visible photocatalysis
O614;O643.3
A
1001-4861(2012)10-2170-09
2012-01-24。收修改稿日期:2012-05-11。
国家自然科学基金(No.21073145)和国家重点研究发展计划(No.2011CBA00508)资助项目。
*通讯联系人。E-mail:yqjiang@xmu.edu.cn;会员登记号:S06N5685M1202。
