纳米钙钛矿型LaFe1-xNixO3(x=0~1.0)的制备及其在紫外光激发下的电化学性能
2012-09-15胡合合罗永春2康龙张国庆齐文娟
胡合合罗永春*,,2康 龙张国庆齐文娟
(1兰州理工大学材料科学与工程学院,兰州 730050)
(2兰州理工大学甘肃省有色金属新材料省部共建国家重点实验室,兰州 730050)
纳米钙钛矿型LaFe1-xNixO3(x=0~1.0)的制备及其在紫外光激发下的电化学性能
胡合合1罗永春*,1,2康 龙1张国庆1齐文娟1
(1兰州理工大学材料科学与工程学院,兰州 730050)
(2兰州理工大学甘肃省有色金属新材料省部共建国家重点实验室,兰州 730050)
本文采用溶胶-凝胶法制备了 LaFe1-xNixO3(x=0,0.2,0.4,0.6,0.8,1.0) 纳米晶粉末,利用 XRD、TEM 和电化学测试方法对LaFe1-xNixO3材料的相结构、形貌、成分组成和其在碱液中的充放电性能以及电化学动力学性能等方面进行了表征和分析,同时对电极受紫外光激发前后的电化学行为进行了对比研究。XRD和TEM分析表明,用硝酸盐作为原材料和溶胶-凝胶方法可制备出单一相结构的纳米晶钙钛矿型LaFe1-xNixO3复合氧化物,随Ni替代量x的增大,LaFe1-xNixO3的相结构由正交结构向菱面体结构转变,其分子体积和晶粒尺寸呈现减小的趋势。电化学研究结果表明,紫外光激发前,LaFe1-xNixO3电极的放电容量随x的增加而逐渐增大;光激发后,电极的放电容量和交换电流Io与未激发前相比显著提高,当x=0.4时其放电容量具有最大值483.1 mAh·g-1,Io值由光激发前的 3.54~11.58 mA·g-1大幅增加至激发后的 8.37~ 40.11 mA·g-1。
LaFe1-xNixO3;紫外光激发;电化学性能
钙钛矿型氧化物(ABO3)因其晶体结构特殊及A位和B位掺杂能力都很强而呈现出丰富多样的物理化学性能,成为化学、物理和材料科学等领域研究的热点[1-4]。近年来,日本学者Esaka[5]和国内夏熙等[6-13]分别对 ACe1-xMxO3-δ(A=Sr,Ba;M=稀土元素)、Ca1-xBixMnO3(0.05≤x≤0.5)和 La1-xSrxMO3(0≤x≤0.4;M=Fe,Cr,Mn,Ti,V) 等钙钛矿型氧化物在碱性溶液中的电化学行为进行了初步研究,发现该氧化物在碱性溶液中具有一定的电化学反应活性和较高的充放电容量(380~630 mAh·g-1),表明 ABO3氧化物作为镍氢电池负极材料不仅具有可行性,而且其低成本、易活化和高放电容量使其今后有可能应用于高能镍氢电池,因而极具潜在和重要的应用价值。但上述国内外研究工作目前尚处于起步和探索阶段,其中仍存在一些尚未搞清的重要问题,如La1-xSrxMO3(x=0~0.4;M=Fe,Cr)体系的电化学储氢机理不明确,放电容量受环境温度影响较大,且其电化学反应动力学性能较差,交换电流密度和扩散系数均比传统储氢合金电极小几个数量级[7-10]。由于钙钛矿型氧化物为半导体材料,其电导率显然是限制其电化学性能发挥的重要因素之一。研究表明,LaNiO3是钙态矿型复合氧化物中唯一的金属型化合物且存在有序化的氧空位,其A位掺杂会造成晶格上有序化氧空位增多而降低电导率,而B位掺杂可显著提高其电催化性能[14];另一方面,半导体电极反应的速率由电极表面自由载流子的浓度决定,也受光照和自由载流子复合过程的影响[15]。因此,本文选择具有较高放电容量的LaFeO3为基体,对其B位的Fe用Ni元素进行替代,同时对该氧化物电极反应过程进行紫外光辐射激发,从电导率和光辐射辅助电催化两方面入手来改善电极的电化学反应动力学性能。由于复合氧化物LaFe1-xNixO3(x=0~1.0)相组成和结构与制备方法及原材料有密切关系[16],本文依据相关文献研究结果,以金属硝酸盐作为初始原料,选择溶胶-凝胶方法制备纳米晶 LaFe1-xNixO3(x=0,0.2,0.4,0.6,0.8,1.0)复合氧化物。
1 实验部分
1.1 LaFe1-xNixO3纳米粉体的制备和表征
以 LaFe1-xNixO3(x=0,0.2,0.4,0.6,0.8,1.0)样 品成分设计为标准,分别称取适合化学计量比的硝酸镧[La(NO3)3·6H2O]、硝酸铁[Fe(NO3)3·9H2O]和硝酸镍[Ni(NO3)2·6H2O],溶于适量去离子水中,按照物质的量比和质量比 m柠檬酸/m乙二醇=11.2加入柠檬酸和乙二醇分别作为配位剂和分散剂,加入氨水调节pH=7.5。将配置好的均匀前躯体溶液在80℃下恒温水浴搅拌至溶胶生成,在120℃恒温干燥后得到干凝胶,再研磨成粉后在350℃燃烧,得到的无定形粉末经研磨后在700℃下煅烧2 h。
煅烧后的粉末产物相结构分析在Rigaku D/max-2400型X射线衍射仪上进行,采用Cu靶Kα射线(λ=0.154 18 nm),工作电压和电流分别为 40 kV 和 100 mA,扫描速率为 0.02°·s-1,扫描范围为15°~90°。XRD衍射数据用最新PDF卡片数据库和Jade5.0软件进行检索分析。用JEM-2010透射电镜对煅烧后的LaFe1-xNixO3粉末进行表面形貌和能谱(EDS)分析。
1.2 电化学性能测试
充放电性能测试在由计算机控制的LANDS6800型电池测试仪上进行。测试体系为正极(辅助电极)和负极(研究电极)组成简易开口电池。按质量比为1∶4的比例分别称取100 mg的LaFe1-xNixO3和400 mg的镍粉,混合均匀后在15 MPa下冷压成直径为10 mm的圆柱型薄片作为负极用研究电极,以烧结的Ni(OH)2/NiOOH为正极用辅助电极,电解液为7 mol·L-1的KOH溶液。整个电池装置置于60℃的恒温水浴锅中。测试的充电电流密度为62.5 mA·g-1,充电时间为 7 h,静置 10 min 后,再以 32.5 mA·g-1的电流密度放电,截止电压为-0.6 V(相对于Ni(OH)2/NiOOH)。
电化学交流阻抗、交换电流密度和离子扩散系数的测试均在CHI600A电化学工作站上采用开口三电极系统测试,正极采用容量过剩的烧结Ni(OH)2/NiOOH电极,参比电极为Hg/HgO电极,电解液为7 mol·L-1的KOH溶液,测试温度为60℃。电化学交流阻抗的测试参数为:放电深度(DOD)为50%,频率扫描范围为10 kHz~5 mHz,交流电位的扰动幅度为5 mV;交换电流密度由线性极化曲线得到,测试参数为:放电深度(DOD)为 50%,扫描速度为 0.1 mV·s-1,电位扫描范围为-5~+5 mV(相对开路电位);LaFe1-xNixO3电极的离子扩散系数采用恒电位阶跃放电方法得到,测试在电极满充状态下进行,+600 mV电位阶跃下放电3 600 s。
为了考察LaFe1-xNixO3电极在紫外光辐射激发下的电化学性能,采用ZF7三用紫外分析仪作为紫外光源,在进行电化学性能(充放电性能、电化学交流阻抗、交换电流密度和离子扩散系数)测试时将波长为254 nm的紫外光持续垂直照射于待测电极上,测试参数均与上述一致。
2 结果与讨论
2.1 LaFe1-xNixO3粉末的相结构、微观形貌和成分分析
图1为煅烧后 LaFe1-xNixO3(x=0,0.2,0.4,0.6,0.8,1.0)粉体的 XRD 图,表1为用 jade5.0 进行分析和计算所得各样品的相组成和晶体结构参数,考虑到不同相结构的晶胞中所含分子数不同,用Vo表示各晶胞中每个分子(LaFe1-xNixO3)的体积。从图1及表1结果看出,各样品的XRD图均与钙钛矿型结构的标准谱相匹配,无杂相峰存在,随Ni替代量x的增大,LaFe1-xNixO3粉体的XRD衍射峰位整体向右偏移,且峰形变宽,说明本实验所制备的纳米粉体形成单一相结构的LaFe1-xNixO3钙钛矿型复合氧化物。由PDF标准谱可知,当x≥0.2时,由于发生结构畸变导致其XRD图上部分衍射峰出现由单峰分离为双峰或三峰现象,但由于纳米粉体的衍射峰宽化效应及仪器的分辨率限制,其双峰或三峰现象未被观察 到 。Proskurnina等研究表明[17],LaFe1-xNixO3在0.0≤x≤0.4 和 0.6≤x≤0.8 范围内可分别形成正交型(Orthorhombic)和菱面体(Rhombohedral)结构的单相复合氧化物,x=0.5则处于正交结构和菱面体结构两相共存的过渡区。由XRD图分析可知,随着x增大,LaFe1-xNixO3粉体的晶体结构按正交→菱面体结构发生转变,且替代量 x=0,0.2,0.4,0.6,0.8,1.0 时均为单相,这与文献[16]报道一致。另一方面,Ni的加入导致该氧化物的晶体结构局部发生畸变,晶格参数也随组成呈现规律性变化。Goldschmidt提出容差因子 t在 0.75~1.0 范围内可形成稳定的 ABO3钙钛矿结构,其容差因子 t可按 t=(rA+rO)/[1.414(rB+rO)]计算[18]。在 LaFeO3中,rA、rB和 rO分别为 La3+、Fe3+和 O2-离子半径,其值为rLa3+=0.136 nm、rFe3+=0.064 5 nm 和rO2-=0.132 nm,Ni元素替代Fe元素后的 rB按 rB=(1-x)rFe3++xrNi3+或rB=(1-x)rFe3++xrNi2+计算,其中rNi3+和rNi2+分别为0.060和0.069 nm。当B位替代离子为Ni3+时,LaFe1-xNixO3(x=0~1.0)的容差因子 t分别为 0.965(x=0)、0.969(x=0.2)、0.973(x=0.4)、0.978(x=0.6)、0.983(x=0.8)和 0.987(x=1.0),而当替代离子为 Ni2+时,其容差因子 t分别为 0.965(x=0)、0.960(x=0.2)、0.956(x=0.4)、0.951(x=0.6)、0.947(x=0.8)和 0.943(x=1.0)。因此,理论上Ni元素均可以+3价或+2价进入LaFeO3晶格中,并在x=0~1范围内保持ABO3钙钛矿结构。但表1结果表明,LaFe1-xNixO3分子体积Vo随Ni替代量x的增大而减小,由于Fe3+离子半径为0.064 5 nm,而Ni3+和 N2+的分别为 0.060 nm 和 0.069 nm,所以 Ni离子应以+3价进入晶格才符合Vo随x增大而减小的现象。此外,通过对XRD衍射峰型拟合和谢乐公式计算结果表明,随Ni替代量x的增加,LaFe1-xNixO3的晶粒尺寸呈现减小趋势。
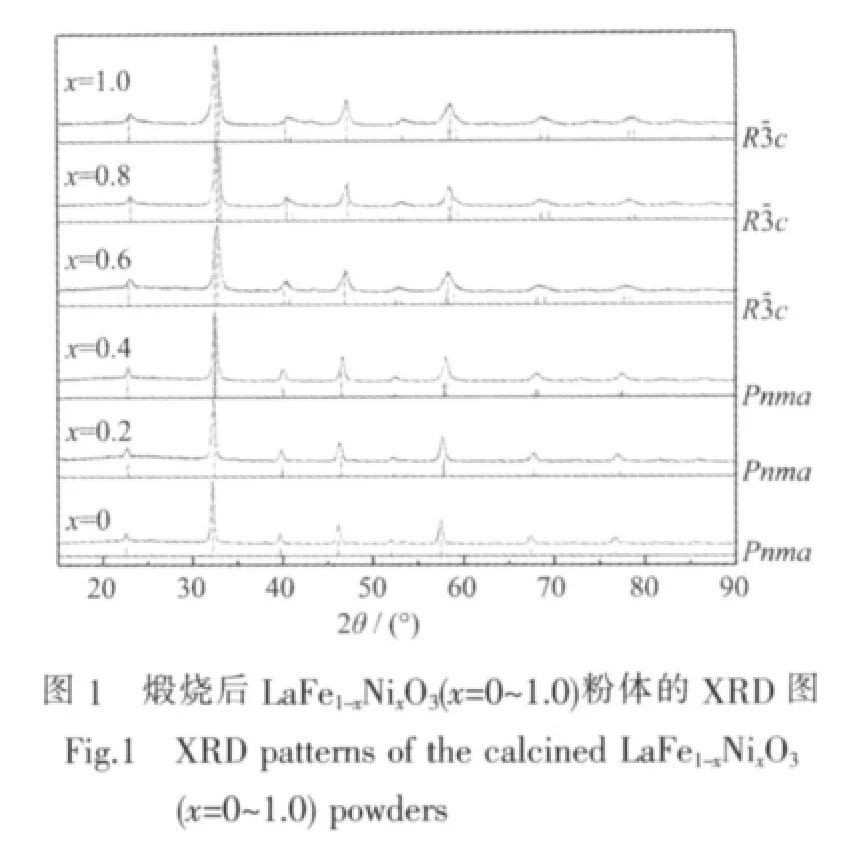
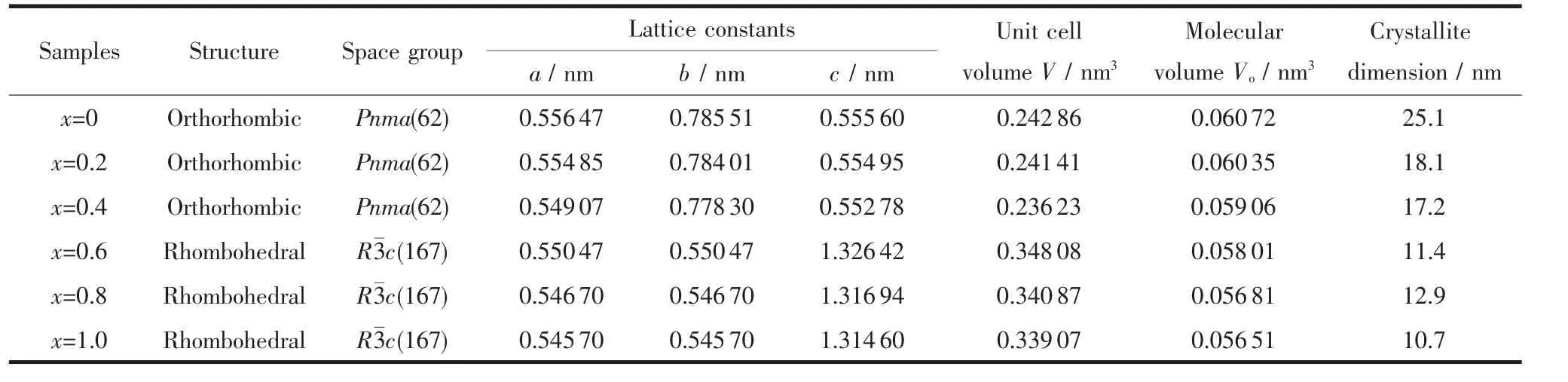
表1 煅烧后LaFe1-xNixO3(x=0~1.0)粉体的相组成及晶体结构参数Table 1 Phase structure and crystal structure paramaters of the calcined LaFe1-xNixO3(x=0~1.0)powders
煅烧后纳米LaFe1-xNixO3粉体的TEM照片和EDS分析图谱如图2中所示。LaFe1-xNixO3粉体的单颗粒大小约为30~50 nm,存在团聚现象,且整体呈现多孔网络状形态,这主要是由制备时添加的大量有机物分解生成的气体所致。由于粉体颗粒的团聚及多晶颗粒的形成,粉体的表观颗粒尺寸较由XRD图拟合计算所得的晶粒尺寸大得多。表2为由LaFe1-xNixO3EDS谱得到的各元素原子百分比,其比例值与样品成分设计时的比例基本一致,存在少量偏差可能是由于透射电镜上的EDS能谱电子束斑较小(25 nm)不具统计效果及背底干扰造成的。

2.2 LaFe1-xNixO3粉末的电化学性能
2.2.1 LaFe1-xNixO3(x=0~1.0)电极紫外光激发前后的充放电特性
图3(a)是LaFe1-xNixO3(x=0,0.2,0.4,0.6,0.8,1.0)电极的第一次充放电曲线。由图3(a)可知,LaFe1-xNixO3电极的充放电曲线均有较宽的电压平台出现,随x增大,LaFe1-xNixO3电极的充电电压平台保持不变,均维持在-1.35 V左右,但其放电电压平台随着x的增大而上升,当 x≥0.6 时,LaFe1-xNixO3电极分别在-0.95 V和-1.05 V附近出现两个放电电压平台。对于钙钛矿型氧化物在碱性溶液中充放电行为的解释可归为以下几点:Esaka等[5]认为氢以质子形式进入到ACe1-xMxO3-δ(A=Sr,Ba;M=稀土元素)中并引起 B 位元素Ce变价,其充放电电位与Ce的变价密切相关;而Deng等[11]则认为氢主要以氢原子形式而非质子形式进入到LaFeO3中形成固溶体,电极充放电电位由其吸/放氢电位决定。根据 Faraday定律,由LaFe1-xNixO3中B位元素变价提供的理论容量值约为 109~110 mAh·g-1。因此可认为对于 LaFe1-xNixO3,当x<0.6时,电极的容量主要由氢原子嵌入到LaFe1-xNixO3中所贡献,表现为-0.95 V处的放电平台;当x≥0.6时,电极的容量由氢原子的嵌入和B位元素变价共同贡献,表现为-0.95和-1.05 V两处放电平台。

图3(b)是LaFe1-xNixO3(x=0,0.2,0.4,0.6,0.8,1.0)电极受紫外光激发下的首次充放电曲线。对比图3(a)与(b)图可见,受紫外光激发后,LaFe1-xNixO3电极的充电电压平台基本保持不变,放电电压平台均有所上升。当 x=0.6,0.8,1.0 时,受激发后的电极在-1.05 V处的电压平台与未激发时宽度基本保持一致,可见激发后电极容量的增加主要与在-0.95 V左右发生的电化学吸/放氢反应所贡献。
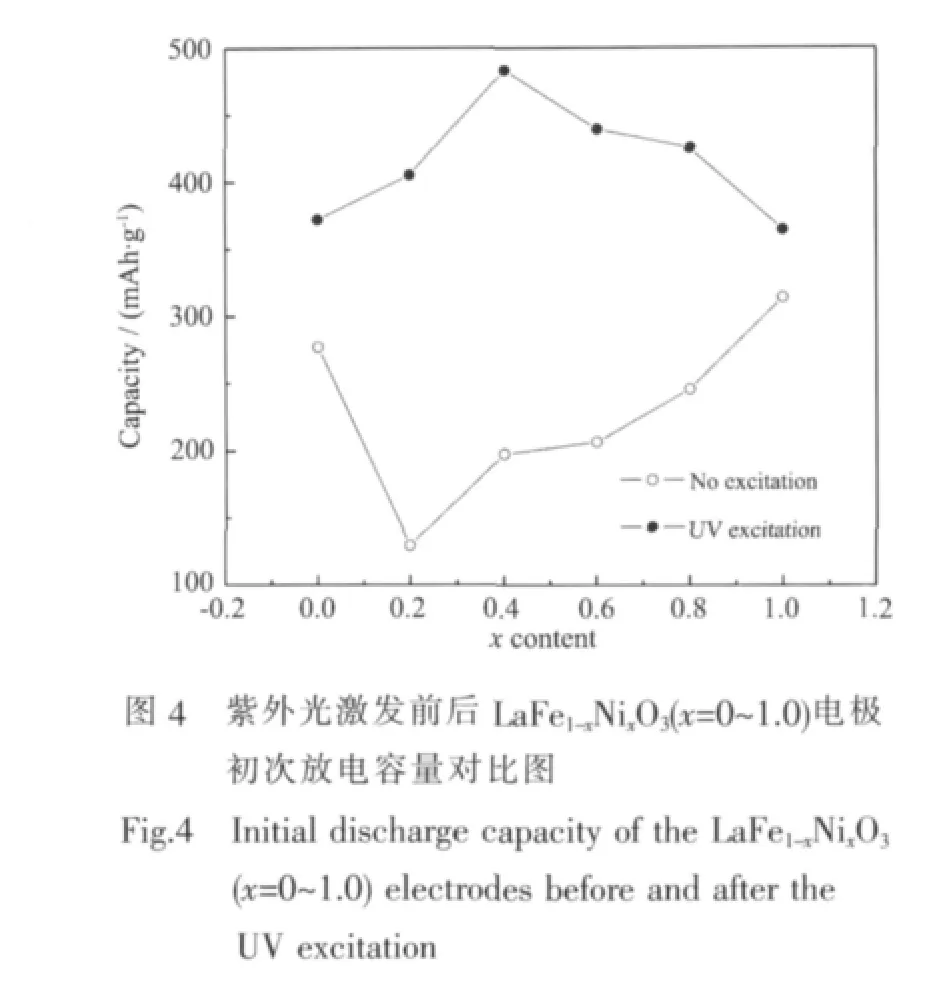
图4为紫外光激发前后 LaFe1-xNixO3(x=0~1.0)电极初次放电容量的对比图。未受紫外光激发时,LaFe1-xNixO3(x=0,0.2,0.4,0.6,0.8,1.0)电极的初次放电容量分别 277、129.5、197.5、206.3、245.5 和 313.7 mAh·g-1,即用Ni替代Fe后,随替代量x的增大,LaFe1-xNixO3电极的初次放电容量逐渐增加,当B位的Fe完全被Ni替代形成LaNiO3时,其放电容量达到最大。LaFe1-xNixO3放电性能明显提高可以用超交换导电机理来解释:LaNiO3是一种导电性良好的金属氧化物,LaNiO3没有禁带,其导带由Ni3+的d电子与O的p电子间相互作用形成的[19~21],即形成-O-Ni-O-导电通道。对 LaMO3(M=Fe、Ni),由于-M-O-的距离最短而成为电子传递输送通道,若LaFeO3中的Fe为Ni所替换形成固溶体,则在导电性差的通道-OFe-O-中增加了导电性好的-O-Ni-O-通道,从而大大改善了固溶体的导电性。有研究表明,LaFe1-xNixO3样品室温下的电阻率随掺杂量x的增加而下降,其值从 8×103Ω·cm(x=0.2)下降到 6×10-3Ω·cm(x=0.7),变化幅度达6个数量级[22]。因此根据文献[11],未受紫外光激发时LaFe1-xNixO3电极的充放电过程可表示为:
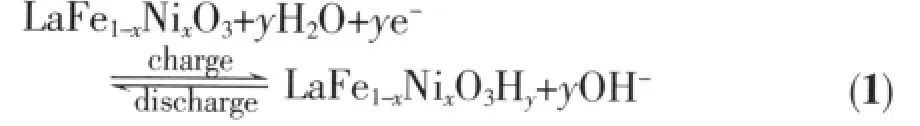
随着Ni替代量x的增加,由于LaFe1-xNixO3电极的电导率提高,电极电化学反应所需电子的传输能力得到提高,从而体现为放电容量的增大。
受到紫外光激发后,LaFe1-xNixO3(x=0,0.2,0.4,0.6,0.8,1.0)电极的初次放电容量分别为 372、405.1、483.1、439、425 和 364.1 mAh·g-1,其值均明显高于未受激发时电极的放电容量。由于LaFe1-xNixO3氧化物的禁带宽度Eg≤2.6 eV,因此在波长λ=254 nm的紫外光照射下,LaFe1-xNixO3半导体价带中的电子将被激发跃迁到导带,而在价带中留下相应的空穴。根据半导体/溶液界面的能级模型理论[15],受到光激发的LaFe1-xNixO3电极与溶液接触达到平衡后,由于受半导体内空间电荷层的影响,充电时P型半导体LaFe1-xNixO3电极导带中的光生电子e-(少子)将向半导体表面运动,而价带中的光生空穴h+将向半导体本体运动,此时电子-空穴对在空间电荷层作用下被有效分离,大大降低了电子-空穴对的复合几率,电极电导率大大提高,同时由于迁移到LaFe1-xNixO3电极表面的光生电子e-具有很强的还原性,可将电极表面吸附的H+还原为H原子,其反应如式(2)所示:
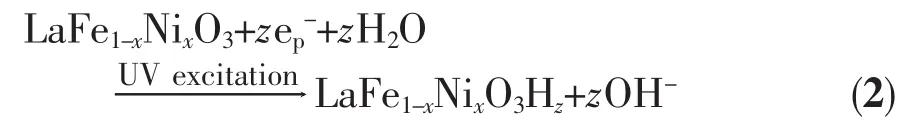
式(2)中e-p表示LaFe1-xNixO3电极受到紫外光激发后的光生电子。显然受紫外光激发后,由于在氧化物电导率的提高以及电极表面光生电子催化反应影响的共同作用下,使得LaFe1-xNixO3电极的阴极充电反应显著增强,由式(1)和(2)得到光激发后电极充电反应式(3)如下:
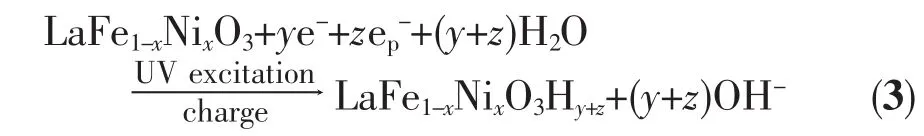
在满充状态下,由于LaFe1-xNixO3Hy+z电极充电过程中其导带被大量电子注入,同时其表面空间电荷层的多数载流子由空穴转变为电子,致使空间电荷层性质由P型转变为N型[15],此时LaFe1-xNixO3Hy+z电极导带中的光生电子e-将向半导体本体运动,而价带中的光生空穴h+将向半导表面体运动,由于迁移到LaFe1-xNixO3Hy+z电极表面的h+具有很强的得电子能力,可将电极中的H氧化为H+,如式(4)所示:
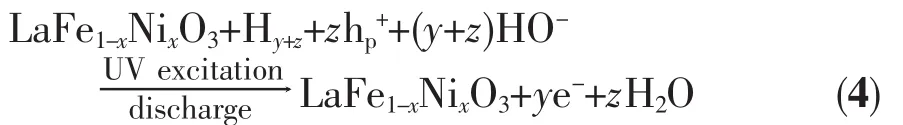
式(4)中h-p表示LaFe1-xNixO3电极受到紫外光激发后的光生空穴。将(3)式与(4)式合并可得到受紫外光激发时LaFe1-xNixO3电极的充放电过程总反应式,如式(5)所示:
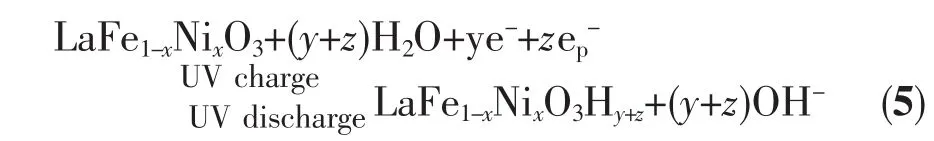
通过以上分析可知,一方面紫外光激发和Ni元素掺杂均能大幅提高LaFe1-xNixO3半导体电极的电子电导率,同时LaFe1-xNixO3电极受紫外光激发产生的电子-空穴对在空间电荷层作用下被有效分离,其少子迁移到电极表面参与电化学反应,从而降低了电极表面反应的活化能使反应活性增强。因此,紫外光照射后LaFe1-xNixO3电极化电化学反应活性的增强和电导率的提高是其放电容量显著提高的主要原因。
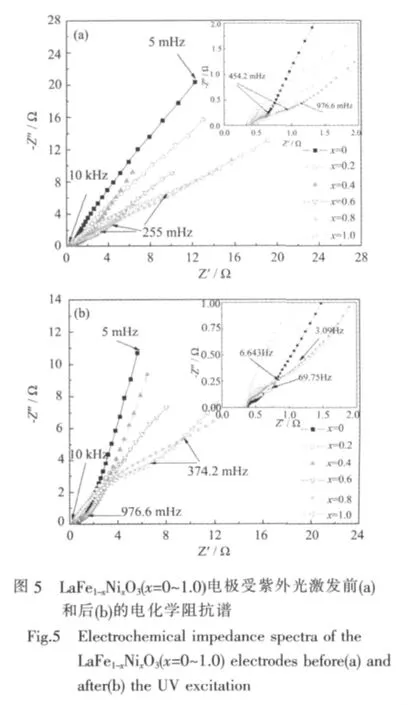
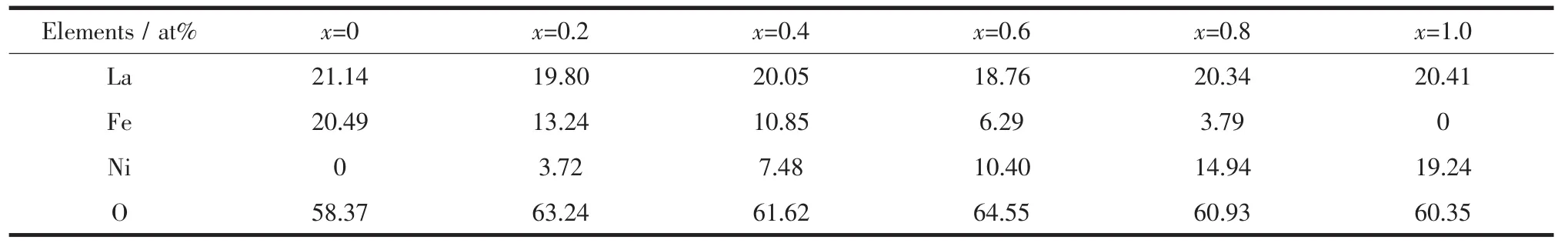
表2 由EDS谱得到的LaFe1-xNixO3(x=0~1.0)粉体的各元素原子百分比Table 2 Atomic percentage of the elements in LaFe1-xNixO3(x=0~1.0)powders obtained by EDS spectra
2.2.2 LaFe1-xNixO3(x=0~1.0)电极紫外光激发前后的动力学性能
用EIS阻抗图谱方法研究了替代量x对LaFe1-xNixO3电极动力学性能的影响,结果如图5所示。图5(a)表明,未受紫外光激发时,随Ni替代量x的增加,LaFe1-xNixO3电极阻抗谱中高频区的半圆半径增大,电极的表面电荷迁移电阻增大,表面电催化活性降低,这与文献[14]中对LaNiO3进行B位Fe掺杂可改善其电催化活性相一致。如图5(b)所示,受紫外光激发后,LaFe1-xNixO3电极阻抗谱中高频区的半圆半径减小,电极表面的电催化活性得到改善。
交换电流密度和扩散系数是表征动力学性能的两个重要指标。图6是LaFe1-xNixO3(x=0~1.0)电极受紫外光激发前后的线性极化曲线。交换电流密度Io可用下列公式计算:

其中R为气体常数,T为绝对温度,F为法拉第常数,I(t)为极化电流,η(t)为过电位,计算结果列于表3。结果表明,紫外光激发前后,随着x的增大,LaFe1-xNixO3电极的交换电流密度Io均呈逐渐减小趋势,但电极的交换电流密度Io值由激发前的3.54~11.58(mA·g-1) 大幅增加至激发后的 8.37~40.11(mA·g-1),说明光激发明显增强了电极表面的电催化反应活性。由图5和表3可知,激发前后交换电流密度Io的变化规律均与交流阻抗谱所得的电催化活性的变化性规律一致。
为了研究 LaFe1-xNixO3(x=0~1.0)电极中氢原子的扩散系数,测得电极受紫外光激发前后的恒电位放电曲线,如图7所示。根据Nishina等[23]的球形扩散模型理论,Zheng等[24]认为当放电时间足够长时,扩散电流与时间的关系遵循下列公式:
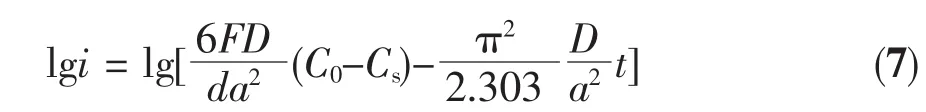
其中i为扩散电流密度(mA·g-1),D为氢原子扩散系数(cm2·s-1),d为样品颗粒的密度(g·cm-3),a为样品颗粒的半径(cm),t为放电时间(s),只要通过实验做出lgi与t的关系曲线,再进行线性拟合即可得到D/a2的值,根据之前测得的样品颗粒半径25 nm,即可求得LaFe1-xNixO3电极的离子扩散系数D,计算结果列于表3。由表3可知,激发前LaFe1-xNixO3电极的氢原子扩散系数D随替代量x的增加而增大,这与Ni替代后晶胞体积减小不利于扩散的规律似乎不符。这是因为随Ni含量的增加,LaFe1-xNixO3晶胞体积虽然减小但其粉末颗粒尺寸显著减小,颗粒尺寸越小则有利于提高氧化物体相中氢的扩散,当晶粒尺寸对离子扩散的影响占据相对优势时,导致LaFe1-xNixO3电极扩散系数随Ni含量的增加而增大。受到紫外光激发后,电极的氢原子扩散系数D随替代量x增加的变化规律相似,但激发后的离子扩散系数D值明显高于激发前的D值。
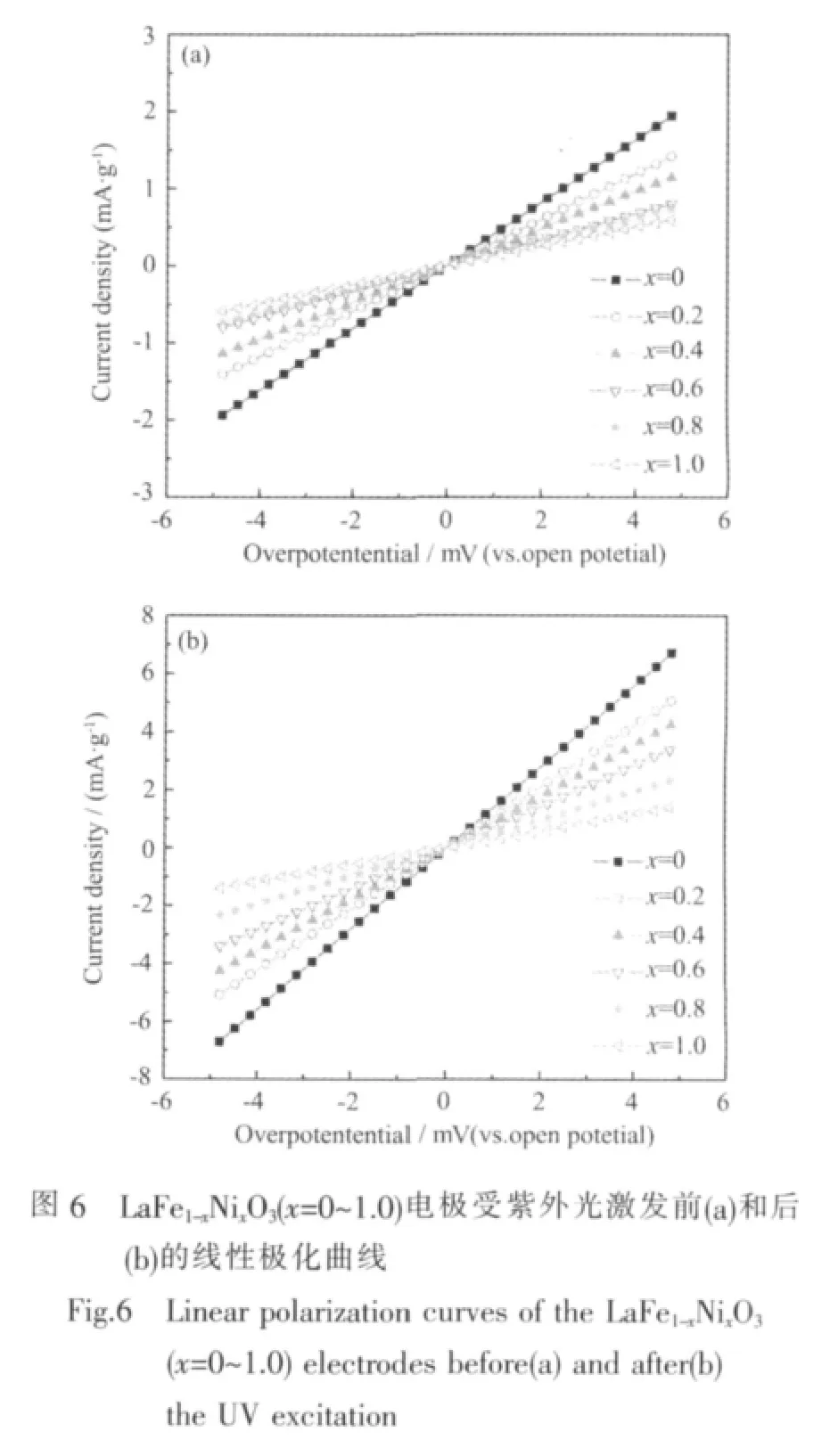

表3 LaFe1-xNixO3(x=0~1.0)电极受紫外光激发前后的交换电流密度Io及扩散系数DTable 3 Exchange current density Ioand diffusion coefficient D of the LaFe1-xNixO3(x=0~1.0)electrodes before and after the UV excitation
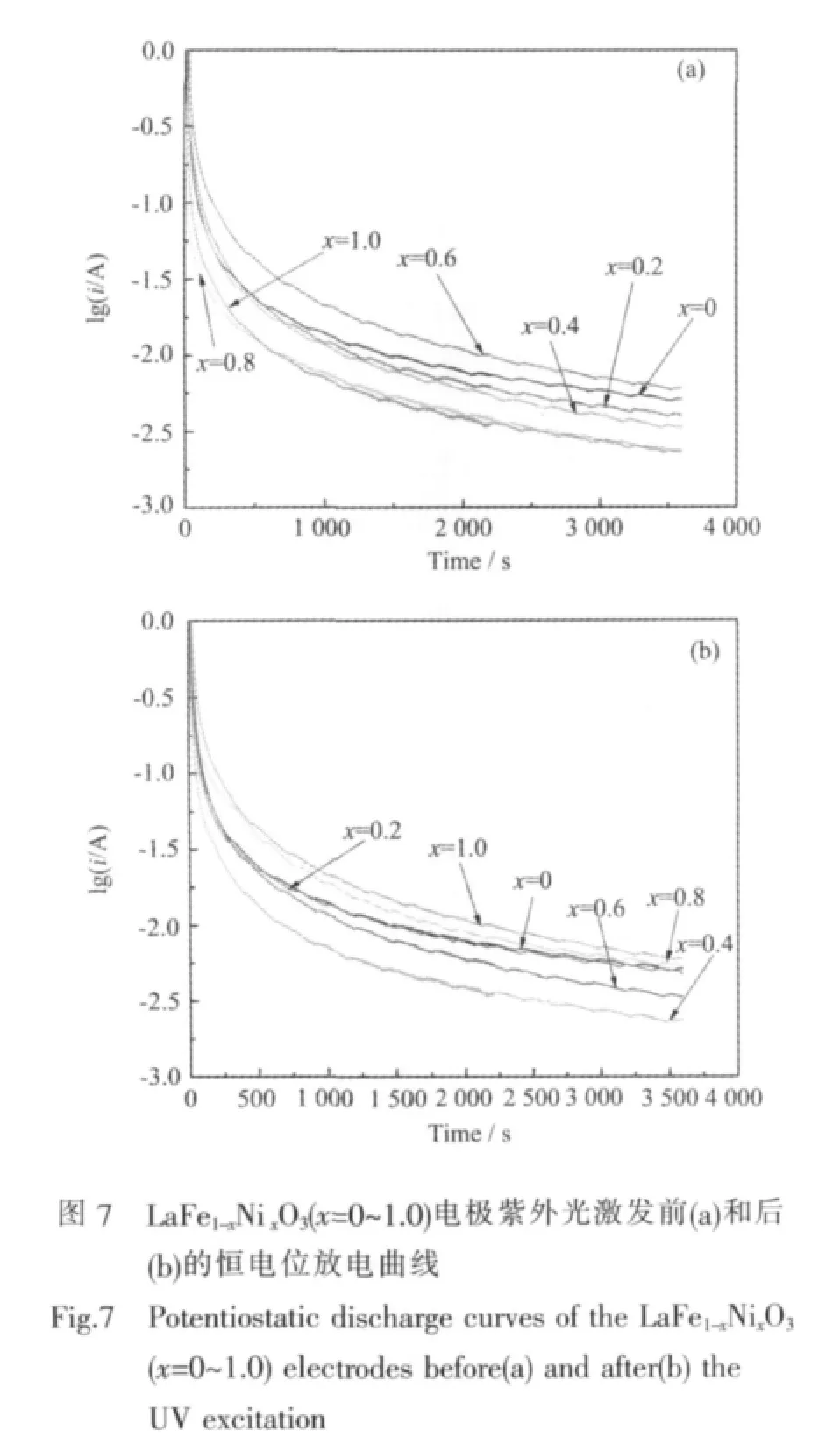
结合上述电极动力学测试结果,对图4中LaFe1-xNixO3电极在紫外光激发前后的放电容量变化规律做进一步分析如下:受紫外光激发前,虽然LaFe1-xNixO3电极的交换电流密度Io随x的增大呈逐渐减小趋势,但由于LaFe1-xNixO3电极的电导率随x的增加可提高几个数量级[22],据此可认为,紫外光激发前,电导率是限制LaFe1-xNixO3电极放电容量的主要控制因素,因而随Ni替代量x增加时其电极放电容量呈逐渐增大的变化规律。当紫外光激发后,LaFe1-xNixO3电极的电导率虽也有很大提高,但由于其交换电流密度Io随x增大而减小的变化幅值比较大,而离子扩散系数D值变化不明显,此时,Io对电极放电容量的影响开始显现,成为限制电极放电容量的主要因素之一,最终在Io、电导率和D的共同影响下,导致LaFe1-xNixO3电极的初次放电容量随x的增加表现为先增大后减小的趋势,当x=0.4时电极容量出现最大值 483.1 mAh·g-1。
3 结 论
(1)以硝酸盐为原材料和溶胶-凝胶法可制备出具有单一相结构的纳米晶钙钛矿型LaFe1-xNixO3复合氧化物,随Ni替代量x的增大,LaFe1-xNixO3的相结构由正交结构向菱面体结构转变,其分子体积和晶粒尺寸均呈现减小的趋势。
(2)紫外光激发前,LaFe1-xNixO3电极的放电容量随x的增加而逐渐增大;光激发后,电极的放电容量与未激发前相比显著提高,随替代量x的增加,电极放电容量表现为先增大后减小规律,在x=0.4时其放电容量具有最大值 483.1 mAh·g-1。
(3)激发前后的LaFe1-xNixO3电极随x的增大其交换电流密度Io均呈减小趋势,离子扩散系数D值虽有所增大但变化不明显;光激发后电极的Io显著增强,其值由激发前的 3.54~11.58 mA·g-1大幅增加至激发后的 8.37~40.11 mA·g-1。
[1]YU Jie(于洁),MA Wen-Hui(马文会),QING Bo(秦博),et al.J.Rare Earths(Zhongguo Xitu Xuebao),2005,23(6):83-86
[2]Lü H,Zhao B Y,Wu Y J,et al.Mater.Res.Bull.,2007,42:1999-2012
[3]ZHENG Yao(郑尧),ZHOU Wei(周嵬),RAN Ran(冉然),et al.Chin.Chem.Bull.(Huaxue Tongbao),2008,30(2/3):413-421
[4]LIU Yan-Yan(刘妍妍),LIU Fa-Min(刘发民),SHI Xia(石霞).Acta Phys.Sin.(Wuli Xuebao),2008,57(11):7274-7278
[5]Esaka T,Sakaguchi H,Kobayashi S.Solid State Ionics,2004,166:351-357
[6]Xia X,Li X Q,Cu J J,et al.Acta Chim.Sin.,2004,62(23):2355-2360
[7]Deng G,Chen Y G,Tao M D,et al.Electrochim.Acta,2009,54:3910-3914
[8]Deng G,Chen Y G,Tao M D,et al.Hydrogen Energy,2009,34:5568-5573
[9]Deng G,Chen Y G,Tao M D,et al.Acta Chim.Sin,2009,67:2001-2004
[10]Deng G,Chen Y G,Tao M D,et al.Electrochim.Acta,2010,55:884-886
[11]Deng G,Chen Y G,Tao M D,et al.Electrochim.Acta.2010,55:1120-1124
[12]Song M,Chen Y G,Tao M D,et al.Rare Earths,2010,28(4):596
[13]Song M,Chen Y G,Tao M D,et al.Electrochim.Acta,2010,55:3103-3108
[14]SONG Shi-Dong(宋世栋),TANG Zhi-Yuan(唐致远),PAN Li-Zhu(潘丽珠),et al.Acta Chim.Sin.(Huaxue Xuebao),2005,63(5):363-371
[15]LI Di(李荻).Electrochemical principle.3rd Ed.(电化学原理·3版).Beijing:Beijing University of Aeronautics and Astronautics Press,2008:304-318
[16]Provendier H,Petit C,Schmitt J L,et al.Mater,Sci.,1999,34:4121-4127
[17]Proskurnina N V,Voronin V I,Cherepanov V A,et al.Prog,Solid State Chem,2007,35:233-239
[18]Aleksandrov K S.Phase Transitions in the Crystals of Haloids Compounds ABX3.Novosibirsk:Nauka;1981:266
[19]Sreedhar K,Honig J M,Darvin M,et al.Phys.Rev.,1992,46:6382-6386
[20]Choisnet J,Evarestov R A,Tupitsyn I I,et al.Phys Solids,1996,57:1839
[21]Rajeev K P,Shivashanka G V,Raychaudhuri A K.Solid State Communication,1991,79(7):591
[22]WANG Cheng-Jian(王成建),WEI Jian-Hua(魏建华),CHEN Yan-Xue(陈延学),et al.J.Rare Earths(Zhongguo Xitu Xuebao).1999,17(3):219-222
[23]Nishina T,Ura H,Uchida I.Electrochem.Soc.,1997,144:1273
[24]Zheng G.,Popov B N,White R E.Electrochem.Soc.,1995,142:2695
Preparation of Nano-Crystalline Perovskite-Type LaFe1-xNixO3(x=0~1.0)and the Electrochemical Properties under UV Excitation
HU He-He1LUO Yong-Chun*,1,2KANG Long1ZHANG Guo-Qing1QI Wen-Juan1
(1College of Materials Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,China)
(2State Key Laboratory of Gansu Advanced Non-Ferrous Metal Materials,Lanzhou University of Technology,Lanzhou 730050,China)
LaFe1-xNixO3(x=0,0.2,0.4,0.6,0.8,1.0)nano-crystalline powders were synthesized by sol-gel method.The phase structure,morphology and composition of the LaFe1-xNixO3were characterized by X-ray diffraction(XRD)and transmission electron microscopy (TEM).The charge-discharge performance and electrochemical kinetics properties of the oxides in alkaline solution were characterized by electrochemical methods,meanwhile the electrochemical behavior of the electrodes before and after UV excitation was comparatively studied.It was found that single phase nano-crystalline perovskite-type LaFe1-xNixO3composite oxides was obtained by sol-gel method with nitrate as raw materials.As the substitute amount x increasing,the phase structures of LaFe1-xNixO3transform from orthorhombic to rhombohedral type,the both molecular volumes and the grain sizes decreased.Electrochemical experimental results show that,with increasing x of Ni doping,the discharge capacity of LaFe1-xNixO3electrodes increased gradually before the UV excitation,while the discharge capacity and the exchange current density Iosignificantly enhanced under visible light irradiation.After the UV excitation,the largest discharge capacities could be up to 483.1 mAh·g-1and the exchange current density Ioincreased by a wide margin from 3.54~11.58 mA·g-1before the UV excitation to 8.37~40.11 mA·g-1.
LaFe1-xNixO3;UV excitation;electrochemical performance
TQ139.2;TQ152
A
1001-4861(2012)10-2130-09
2012-03-08。收修改稿日期:2012-05-03。
国家自然科学基金(No.21063008)及甘肃省教育厅导师业务经费专项资助项目。
*通讯联系人。E-mail:luoyc@lut.cn
