益生菌对实验性结肠炎大鼠肠黏膜 TLR2、TLR4表达及 NF-κB活性的影响
2012-09-14曹艳菊
曹艳菊
解放军第306医院消化内科,北京 100101
益生菌对实验性结肠炎大鼠肠黏膜 TLR2、TLR4表达及 NF-κB活性的影响
曹艳菊
解放军第306医院消化内科,北京 100101
目的 通过检测益生菌对实验性结肠炎大鼠肠黏膜上皮细胞(IECs)Toll样受体(Toll Like recefor,TLR)、TLR4表达及肠黏膜核因子,kappa B活化的影响,探讨益生菌预防与辅助治疗溃疡性结肠炎的作用机制。方法 将30只雄性SD大鼠随机分为3组,即正常对照组(N)、模型组(M)、益生菌组(P)。正常对照组正常饲养,不予任何处理;模型组给予含5% 葡聚糖硫酸钠 dextran sulfate sodium的饮用水10 d建立亚急性结肠炎模型,第11 d开始常规饲养观察2周;益生菌组则在建立模型后给予双歧三联活菌500 mg·kg-1·d-1灌胃,1次/d,共2周;2周后处死所有大鼠,观察疾病活动指数 (DAI),进行组织学评分 (HPS)和分离ICEs并提取ICE中的总RNA,用RT-PCR法检测TLR2、TLR4的表达;采用免疫组织化学方法检测NF-κB的活性情况。结果 益生菌组的症状、组织损害程度均较模型组明显减轻;模型组和益生菌组TLR2和TLR4的表达均明显高于正常对照组(P<0.001);与模型组比较,益生菌组TLR2的表达增加(P<0.05),而TLR4的表达则明显下降(P<0.001);模型组NF-κB活性明显高于益生菌组和正常对照组(P<0.001),益生菌组与正常对照组NF-κB活性比较差异无统计学意义(P>0.05)。结论 益生菌通过促使TLR2表达进一步增加,并可抑制TLR4的表达,进而控制NF-κB的活性,并在缓解肠道炎症中发挥作用。
益生菌;葡聚糖硫酸钠;结肠炎;Toll样受体;核因子kappa B(NF-κB)
溃疡性结肠炎(ulcerative colitis,UC)的发病机制目前尚未完全明了,目前认为是基因易感性、肠道细菌及自身免疫反应协同作用的结果[1]。近年来,随着人们生活水平的提高,饮食结构及生活方式的改变,UC在我国的发病率有逐年上升的趋势。当前治疗仍以5-氨基水杨酸类、糖皮质激素和免疫抑制剂等为主,这些治疗有不良反应严重、停药后易复发等缺点。益生菌是临床广泛应用的一类微生态制剂,研究[2-3]表明益生菌对UC具有缓解作用,而且对UC复发有一定预防作用,但其作用机制尚不明确。本研究通过葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的实验性结肠炎大鼠模型,观察益生菌对DSS结肠炎的疗效及对病变肠黏膜上皮细胞(intestinal epithelial cells,IECs)中 Toll样受体(toll like receptor,TLR)TLR2、TLR4 表达及黏膜中NF-κB活性的影响,旨在探讨益生菌治疗UC的机制。
1 材料与方法
1.1 实验动物及分组 10~12周龄雄性SD大鼠30只,体质量(200±10)g(购自北京大学第一医院实验动物中心),随机分为正常对照组、模型组和益生菌组,每组10只,饲养于恒温、恒湿清洁级动物实验室。
1.2 主要试剂 葡聚糖硫酸钠(DSS),分子量5 KD,购自Sigma公司;RT-PCR试剂盒购自TaKaRa公司;NF-κB检测所需一抗及二抗购自Santa Cruz公司;益生菌:双歧三联活菌(含双歧杆菌、乳酸杆菌、肠球菌,活菌量>5.0×107CFU/210 mg),上海医药有限公司信宜制药总厂。
1.3 UC动物模型的建立及处理 造模前大鼠在清洁级动物房饲养1周,之后模型组及益生菌治疗组大鼠按照Cooper等[4-5]经典方法,给予含5%DSS饮用水10 d建立亚急性UC动物模型。第11 d开始模型组常规饲养观察;益生菌组则给予双歧三联活菌500 mg·kg-1·d-1灌胃,1 次/d,共 2 周,此期间对照组和模型组给予等容量生理盐水灌胃;正常对照组不予DSS及益生菌干预,仅同步常规饲养观察。观察各组大鼠的体质量、大便性状及便血情况。灌胃2周后将所有大鼠拉颈处死,分离全结肠,纵行剖开肠管,用冷生理盐水冲洗展平,肉眼观察结肠黏膜损伤程度,分别取远段、中段、近段结肠组织约0.5cm×0.5 cm各一块,进行组织病理学观察及免疫组化检测NF-κB活化。剩余结肠组织用以检测TLR2和TLR4的表达。
1.4 肠上皮细胞的提取 将取得的肠道组织翻转,使肠内膜向外,用冷D-Hanks液充分冲洗去除黏附在黏膜的粪便,将肠组织置于含5.0 mmol/L EDTA和145 μg/mL DTT的 D-Hanks液中 37℃摇床 90 min,以3 000 r/min离心15 min,取沉淀即为肠上皮细胞。
1.5 RT-PCR检测上皮细胞(IECs)中的TLR2和TLR4 的表达[6-7]
1.5.1 RT-PCR方法:提取IECs的总RNA检测TLR2和TLR4的表达。引物分别为:TLR2(FWD:ttgctcctgcgaactcctat,REV:gctttcttgggcttcctctt);TLR4(FWD:gctttcacctctgccttcac,REV:cgaggcttttccatccaata);NADPH(FWD:accacagtccatgccatcac,REV:tccaccaccctgttgctgta)。RT反应体系:dNTP Mixture 1 μL;10 ×RT Buffer 1 μL;Rnase Free H2O 3.75 μL;RNase Inhibitor 0.25 μL;MgCl22 μL;AMV Reverse Transcriptase 0.5 μL;oligo dT-Adaptor primer 0.5 μL;total RNA 1 μL。RT 反应条件:42℃ 30 min;99℃ 5 min,5℃ 5 min,1个循环。PCR 反应体系:PCR Reverse Prime 0.5 μL;PCR FWD Prime 0.5 μL;5 μ PCR Buffer 10 μL;DH2O 28.75 μL;Taq 0.25 μL。PCR 反应条件:TLR2:预变性 94 ℃ 2 min,1个循环,再变性94℃ 30 s;退火52.8℃ 30 s;72℃延伸2 min,共30个循环,再72℃延伸5 min。TLR4除退火温度为54.3℃外,其余条件与 TLR2相同。
1.5.2 电泳成像:反应结束后取5 μL反应产物进行琼脂糖凝胶电泳,凝胶图像分析仪成像分析,将各组标本TLR2与TLR4所得条带的灰度值(平均光密度值×条带面积)与相应的NADPH条带的灰度值相比,得出标本mRNA的相对量。
1.6 活化的 NF-κB检测 采用免疫组织化学方法[8]:应用标准的三步法(标记的链酶亲和素-生物素法,即LSAB法)进行检测。一抗为NF-κB p65亚基的特异性单克隆抗体;二抗为生物素标记山羊抗鼠IgG抗体。NF-κB活化的评分标准[9]:取400×倍视野4个进行评分,每个视野中 NF-κB阳性细胞百分比(0~1)%为0分,(2~5)%为1分,(6~10)%为2分,(11~25)%为3分。取其平均分。
1.7统计学方法应用SPSS 13.0软件。数据以¯x±s表示。组间差异比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 一般情况 模型组及益生菌组DSS灌胃后,平均3~5 d出现典型症状(活动及进食量明显减少、腹泻、便血、体质量下降等)。益生菌组在建模后经2周双歧三联活菌灌胃治疗,腹泻、便血症状明显好转,体质量不再下降;模型组症状一直持续无减轻,体质量继续下降;正常对照组则无上述典型症状出现,而且体质量逐渐增加。
2.2 组织病理学变化 模型组肠黏膜、黏膜下见大量炎性细胞浸润,溃疡边缘腺体增生较重,结构紊乱,隐窝脓肿形成,杯状细胞减少,黏膜下层出血、水肿(见图1)。益生菌治疗组黏膜、黏膜下层炎性细胞浸润明显减少,黏膜充血、水肿明显减轻,溃疡减少或消失(见图2)。正常对照组肠上皮腺体排列整齐,腺体间有较多杯状细胞,固有层少量淋巴细胞浸润(见图3)。
2.3 肠黏膜细胞TLR2、TLR4的表达 模型组和益生菌组TLR2和TLR4的表达均明显高于正常对照组(P<0.001);与模型组比较,益生菌组TLR2的表达增加(P<0.05),而 TLR4的表达则明显下降(P<0.001,见表2)。
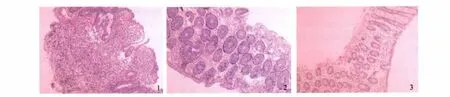
图1 模型组大鼠结肠黏膜组织病理情况HE染色(40×);图2 益生菌组大鼠结肠黏膜组织病理情况HE染色(40×);图3 正常对照组大鼠结肠黏膜组织病理情况HE染色(40×)Fig 1 The histopathology condition in model group HE染色(40×);Fig 2 The histopathology condition in probiotics group HE染色(40×);Fig 3 The histopathology condition in normal control groupHE染色(40×)
表2 各组肠黏膜细胞TLR2及TLR4的表达±s)Tab 2 The expression of TLR2 and TLR4 in IECs± s)

表2 各组肠黏膜细胞TLR2及TLR4的表达±s)Tab 2 The expression of TLR2 and TLR4 in IECs± s)
与益生菌组比较,*P <0.001,**P <0.05
组别TLR2 TLR4正常对照组 0.23 ±0.06* 0.26 ±0.08*模型组 0.61±0.07** 0.96±0.06*益生菌组0.70 ±0.09 0.45 ±0.08
2.4 活化的NF-κB免疫组织化学染色及半定量分析
正常对照组仅偶见NF-κB活化细胞(阳性细胞)。模型组的NF-κB阳性细胞明显增多,主要见于固有层中,高倍镜下可见染色主要位于细胞核,呈棕褐色。相比之下,模型组NF-κB评分明显高于益生菌组 (P<0.001)和正常对照组 (P<0.001);益生菌组与正常对照组比较差异无统计学意义 (P>0.05,见表3)。
表3 各组活化的NF-κB评分s)Tab 3 The activation score of NF-κB in colon mucosa± s)
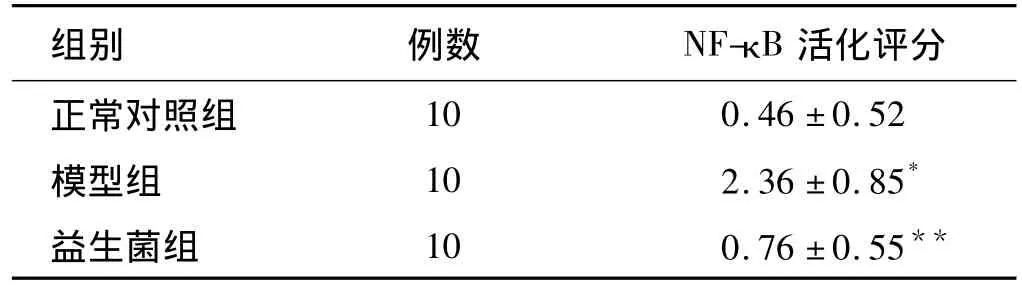
表3 各组活化的NF-κB评分s)Tab 3 The activation score of NF-κB in colon mucosa± s)
与正常对照组及益生菌组比较,*P<0.001;与正常对照组比较,**P >0.05
组别 例数 NF-κB 活化评分正常对照组10 0.46 ±0.52模型组 10 2.36 ±0.85*益生菌组 10 0.76 ±0.55**
3 讨论
近年来国内外研究表明[10],溃疡性结肠炎与肠道菌群失调密切相关,在活动性UC患者肠黏膜表面革兰氏阳性的有益菌如双歧杆菌和乳酸杆菌是缺失的,相反革兰氏阴性菌,特别是大肠杆菌、变形杆菌、拟杆菌在黏膜表面浓度增加。肠道菌群失调可能是UC的诱发因素及复发的关键因素。作者[11-13]之前对应用抗生素导致肠道菌群失调及结肠炎的研究发现,在抗生素应用过程中,肠道的生理性菌群受到破坏,导致条件致病菌大量繁殖,并激发肠黏膜免疫炎症反应,导致结肠炎,当用抗生素治疗同时补充益生菌,则明显降低肠道菌群失调和结肠炎的发生,从正反两方面证明了菌群紊乱与结肠炎关系密切。Toll样受体(toll-like receptors,TLRs)家族是近年来发现的具有重要意义的先天性免疫跨膜受体和信号转导受体,能够特异性地识别病原微生物。革兰阴性细菌细胞壁成分脂多糖(lipopolysaccharide,LPS)可以诱导肠上皮细胞TLR4表达增加,并通过与TLR4的结合激活NF-κB信号传导通路,引起前炎症因子TNF-α、IL-1表达增加,后者再进一步激活NF-κB,继而诱发一系列炎症反应,且不断放大[7,14]。近年来研究[15-17]表明 UC 时结肠上皮细胞TLR4表达大量增加,同时NF-κB呈过度激活状态,且与病情活动性和严重性明显相关。当肠道菌群与宿主之间的平衡被打破,尤其是革兰阴性细菌增加时,LPS诱导TLR4-NF-κB途径激活,炎症反应不断放大。因此,维持肠道微生态平衡,抑制或阻断TLR4-NF-κB信号通路,将成为控制溃疡性结肠炎病情及预防其复发的新靶向[18-19]。TLR2能够识别革兰阳性菌、革兰阴性菌、真菌、螺旋体及支原体等多种细菌的细胞壁成分,在多种微生物所致的急慢性感染中均具有重要作用[20]。益生菌多为革兰阳性菌,可被TLR2特异性识别。目前关于TLR2在UC发病机制中的作用尚不明确。正常情况下肠上皮细胞仅表达微量的TLR2和TLR4,肠道细菌通过TLRs短暂的激活NF-κB信号转导通路,对宿主起保护作用[19]。张素真等[7]应用双歧杆菌干预由DSS诱导的UC小鼠的研究表明,双歧杆菌可以诱导UC小鼠肠黏膜TLR2表达增加,同时抑制TLR4、IL-1及TNF-α的表达,而且黏膜炎症明显轻微。表明TLR2与双歧杆菌结合通过某种机制抑制了TLR4-NF-κB信号通路,下调黏膜炎症反应。而马原[6]的研究结果显示,实验性UC大鼠肠黏膜TLR2、TLR4的表达均明显增加,双歧杆菌干预后肠黏膜炎症明显减轻,且TLR2、TLR4的表达均明显下调,TLR2的表达及其对益生菌干预反应与张素真等的研究结果并不一致。本研究应用双歧三联活菌干预由DSS诱导的UC大鼠,结果表明,结肠炎大鼠肠黏膜TLR2和TLR4的表达均明显增加,益生菌干预后肠黏膜炎症明显减轻,TLR2表达进一步增加,而TLR4的表达则明显下调,与张素真的研究结果基本一致。而且从本研究设计可看出结肠炎本身即可导致TLR2的表达增加,原因可能由于TLR2特异性较差,既可识别革兰阳性菌,也可识别革兰阴性菌、真菌等多种细菌,导致菌群失调时TLR2和TLR4的表达均明显增加。推测补充益生菌,则以激活TLR2的表达占优势,同时抑制了革兰氏阴性菌及TLR4的表达,进而使NF-κB活化受到抑制,炎症得到控制。我们检测的肠黏膜NF-κB活化结果也显示NF-κB活性降低。推测双歧三联活菌通过上调肠黏膜细胞TLR2的表达,进而抑制TLR4-NF-κB通路,从而在缓解肠道炎症中发挥作用。
综上所述,本研究表明,实验性UC大鼠肠黏膜TLR2、TLR4高表达,并且NF-κB处于激活状态,益生菌干预可增加TLR2的表达、抑制TLR4表达及NF-κB活化,推测益生菌对溃疡性结肠炎肠道炎症的缓解作用是通过上调TLR2表达、抑制TLR4-NF-κB信号传导途径完成的。
[1] Hanaper SB.Inflammatory bowel disease:epidemiology,pathogenesis and therapeutic opportunities [J].Inflamm Bowel Dis,2006,12(s1):S3-S9.
[2] Hegazy SK,El-Bedewy MM.Effect of probiotics on pro-inflammatory cytokines and NF-kappaB actication in ulcerative colitis[J].World J Gastroenterol,2010,16(33):4145-4151.
[3] Zocco MA,dal Verme LZ,Cremonini F,et al.Efficacy of Lactobacillus GG in maintaining remission of ulcerative colitis[J].Aliment Pharmacol Ther,2006,23(11):1567-1574.
[4] Cooper HS,Murthy SN,Shah RS,et al.Clinicopathologic study of dextran sulfate sodium experimental murine colitis[J].Lab Invest,1993,69(2):238-249.
[5] Kitajima S,Takuma S,Morimoto M.Histological analysis of murine colitis induced by dextran sulfate sodium of different molecular weights[J].Exp Anim,2000,49(1):9-15.
[6] Ma Y.The intervention role of bifidobacteria on gene expression of Toll-like receptor in rat with ulcerative colitis[J].Chin J Cell Mol Immunol,2011,27(3):327-328.
马原.双歧杆菌对溃疡性结肠炎大鼠肠Toll样受体基因表达的干预作用[J].细胞与分子免疫学杂志,2011,27(3):327-328.
[7] Zhang SZ,Zhang DC.Study on the mechanism of action of bifidobacteria in DSS induced UC[J].Chinese Journal of Microecology,2008,20(2):147-149,153.
张素真,张德纯.双歧杆菌缓解DSS诱导的溃疡性结肠炎作用机制的研究[J].中国微生态学杂志,2008,20(2):147-149,153.
[8] Kaltschmidt C,Kaltschmidt B,Henkel T,et al.Selective recognition of the activated form of transcription factor NF-κB by a monoclonal antibody[J].Biol Chem Hoppe Seyler,1995,376(1):9-16.
[9] Bantel H,Berg C,Vieth M,et al.Mesalazine inhibits activation of transcription factor NF-κB in inflamed mucosa of patients with ulcerative colitis[J].Am J Gastroenterol,2000,95(12):3452-3457.
[10] Sang LX,Chang B,Zhang WL,et al.Remission induction and maintenance effect of probiotics on ulcerative colitis:a meta-analysis[J].World J Gastroenterol,2010,16(15):1908-1915.
[11] Cao YJ,Zhang YS,Xu LZ,et al.Prevention of antibiotic-associated diarrhea with microecological modulators [J].Chin J Nosocomiol,2007,17(1):17-19.
曹艳菊,张豫生,许连壮,等.微生态制剂对抗生素相关性腹泻预防作用的研究[J].中华医院感染学杂志,2007,17(1):17-19.
[12] Cao YJ,Qu CM,Yuan Q,et al.Control of intestinal flora alteration induced by eradication therapy of helicobacter pylori infection in the elders[J].Chin J Gastro Hepa,2005,14(2):195-196,199.
曹艳菊,屈昌民,袁群,等.老年人抗生素相关性肠道菌群失调的防治[J].胃肠病学和肝病学杂志,2005,14(2):195-196,199.
[13] Cao YJ,Zhang YS,Qu CM,et al.Prevention of antibiotic-associated diarrhea induced by eradication therapy of helicobacter pylori infection[J].Chin J Nosocomiol,2006,16(5):559-560,581.
曹艳菊,张豫生,屈昌民,等.幽门螺杆菌治疗中抗生素相关性腹泻的预防[J].中华医院感染学杂志,2006,16(5):559-560,581.
[14] Dobrovolshaia MA,Medvedev AE,Thomas KE,et al.Induction of in vitro reprogramming by Toll-like receptor(TLR)2 and TLR4 agonists in murine macrophages:effects of TLR“homotolerance”versus“heterotolerance”on NF-κB signaling pathway components [J].J Immunol,2003,170(1):508-519.
[15] Gribar SC,Anand RJ,Sodhi CP,et al.The role of epithelial Toll-like receptor signaling in the pathogenesis of intestinal inflammation[J].J Leukoc Biol,2008,83(3):493-498.
[16] Fukata M,Abreu MT.TLR4 signaling in the intestine in health and disease[J].Biochem Soc Trans,2007,35(6):1473-1478.
[17] Liu YP,Li YQ.Expression and significance of nuclear factor-κB in ulcerative colitis[J].Chin J Gastroenterol,2006,11(2):103-106.
刘一品,李延青.核因子-κB的表达在溃疡性结肠炎发病机制中的意义[J].胃肠病学,2006,11(2):103-106.
[18] Turcotte JF,Huynh HQ.Treatment with the probiotic VSL#3 as an adjunctive therapy in relapsing mild-to-moderate ulcerative colitis significantly reduces ulcerative colitis disease activity[J].Evid Based Med,2011,16(4):108-109.
[19] Jackson EL,Hamlin PJ,Ford AC.VSL#3 and remission in active ulcerative colitis:larger studies required [J].Am J Gastroenterol,2011,106(3):547.
[20] Qin W,Zhou GH.Study progress of toll-like receptors and intestinal related diseases [J].Medical Recapitulate,2010,16(19):2921-2924.
秦稳,周国华.TOLL样受体与肠道相关疾病的研究进展[J].医学综述,2010,16(19):2921-2924.
The effects of probiotics on expression of TLR2,TLR4 and activation of NF-κB in rats with DSS-induced colitis
CAO Yanju
Department of Gastroenterology,306 Hospital of Chinese PLA,Beijing 100101,China
ObjectiveTo detect the expression of TLR2,TLR4 and activation of NF-κB in colon mucosa in rats with DSS-induced colitis,and to investigate the mechanism of probiotics in ulcertive colitis.MethodsThirty male SD rats were divided randomly into three groups:normal control group(N),model group(M)and probiotics group(P).Subacute colitis was induced with 5%DSS in drinking water for 10 d in group M and group P.After DSS exposure,the rats in group P were subjected to oral administration of bifido-bacterium solution(500 mg·kg-1·d-1)for 2 weeks.In group M and group N,oral saline was administered.Disease activity index(DAI)and histopathological score(HPS)were observed.The expression of TLR2 and TLR4 in IECs were tested by RT-PCR.The activation of NF-κB in colon mucosa was further studied by immuno-histochemistry.ResultsDAI and HPS in group P were significant lower than those in group M.The expression of TLR2 and TLR4 in group M and P were increased markedly(P<0.001).Compared with the group M,expression of TLR2 was increased(P <0.05)and expression of TLR4 was decreased(P <0.001)in group P.The activation of NF-κB in group M was increased significantly than those in group P and group N(P <0.001).There was no difference in the activation of NF-κB between group N and group P(P >0.05).ConclusionThe bifidobacterium(probiotics)may exert their effects in DSS induced UC by the expression of TLR2,then inhibit the expression of TLR4 and the activation of NF-κB.
Probiotic;Dextran sulfate sodium(DSS);Ulcerative colitis;Toll like receptor(TLR);Nuclear factor kappa B(NF-κB)
R574.62
A
1006-5709(2012)08-0760-04
2012-04-18
10.3969/j.issn.1006-5709.2012.08.022
