炎症对脂肪酸负荷的肾细胞FAT/CD36表达的影响*
2012-09-14万克强廖俊蕾陈压西阮雄中
万克强, 廖俊蕾, 赵 蕾, 李 青, 陈压西, 阮雄中
(重庆医科大学脂糖代谢性疾病重庆市重点实验室,教育部感染性疾病分子生物学重点实验室,重庆400016)
慢性肾脏疾病患者往往有不同程度的脂质代谢紊乱,它既是许多原发或继发性肾脏疾病的常见临床表现,又参与了肾脏疾病的发生发展。研究发现,在肾脏疾病早期就会有血清游离脂肪酸(free fattyacid,FFA)增高。肾脏是FFA重要的代谢器官,也是脂肪酸β氧化产生能量的主要场所。脂肪酸在肾脏细胞的异常跨膜转运对慢性肾脏疾病的发生和发展起了不可忽视的作用。随着慢性肾脏疾病的发展,机体往往出现全身持续低度的炎症反应,而炎症可进一步加重肾脏损害的进程。近来研究表明,炎症可以通过干扰介导细胞内脂质代谢平衡的一些分子表达,改变脂质在体内的转运和分布,导致脂质过多地沉积在组织细胞内,造成组织器官损害[1-3]。脂肪酸转运蛋白(fatty acid transporter,FAT/CD36)在调节脂肪酸在肾脏的跨膜转运起到重要作用。正常状态下,FAT/CD36作为B类清道夫受体在巨噬细胞有一定表达,而有实验发现糖尿病大鼠巨噬细胞CD36表达较正常组增加[4],则提示与一些病理改变有关。炎症是否能干扰肾细胞FAT/CD36表达而进一步导致肾脏细胞脂肪酸代谢紊乱却鲜见报道。因此本研究旨在应用人系膜细胞(human mesangial cells,HMCs)和肾小管上皮细胞HK-2作为体外实验模型,初步观察在炎症和脂肪酸负荷状态下肾细胞FAT/CD36的表达以及胞内脂质的积聚情况。
材料和方法
1 材料
改良型 RPMI-1640培养基、胎牛血清(Hy-Clone);软脂酸、油红O(Sigma);肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)(PeproTech Asia);白细胞介素6(interleukin-6,IL-6)(SinoBio);Trizol RNA提取剂、PrimeScript® RT reagent kit和SYBR® Premix Ex TaqTMⅡ(TaKaRa);细胞总蛋白提取试剂盒(Keygen);PCR引物通过TaqMan Primer Express软件设计,上海生物工程公司合成;β-actin兔单抗IgG、FAT/CD36兔单抗IgG和goat anti-rabbit IgG-HRP(Santa Cruz)。
2 主要方法
2.1 细胞培养 HMCs用含10%胎牛血清及1%胰岛素-转铁蛋白-亚硒酸钠(insulin-transferrinsodium selenite,ITS)的改良型 RPMI-1640培养基,HK-2细胞用含10%胎牛血清的改良型RPMI-1640培养基,在37℃、5%CO2孵箱培养,1~2 d换液,3~4 d传代。
2.2 实验分组 将汇合度达90%的HMCs和HK-2细胞更换无脂肪酸培养基RPMI-1640+0.2%牛血清白蛋白(bovine serum albumin,BSA)培养24 h,将不同浓度软脂酸(0 mmol/L、0.02 mmol/L、0.04 mmol/L、0.08 mmol/L、0.16 mmol/L、0.32 mmol/L)处理 HMCs和 HK-2细胞 24 h,观察 FAT/CD36 mRNA和蛋白的表达。进一步选取软脂酸0.04 mnol/L,再联合炎症因子处理细胞,分为6组:(1)对照组 (control):RPMI-1640+0.2%BSA;(2)软脂酸组 (palmitate):RPMI-1640+0.2%BSA+0.04 mmol/L软脂酸;(3)TNF-α组:RPMI-1640+0.2%BSA+25 μg/L TNF-α;(4)IL-6组:RPMI-1640+0.2%BSA+20 μg/L IL-6;(5)软脂酸联合TNF-α组(palmitate+TNF-α):RPMI-1640+0.2%BSA+0.04 mmol/L palmitate+25 μg/L TNF-α;(6)软脂酸联合IL-6组(palmitate+IL-6):RPMI-1640+0.2%BSA+0.04 mmol/L palmitate+20 μg/L IL-6,培养24 h后做相应检测。
2.3 实时定量PCR检测FAT/CD36的mRNA表达 Trizol法提取细胞总RNA,在PrimeScript® RT Enzyme MixⅠ作用下逆转成cDNA,反转录条件是:37℃ 15 min,85℃ 5 s。以2 μL cDNA作实时定量PCR检测FAT/CD36 mRNA表达,同时以 β-actin作为内参照,扩增反应:50℃ 2 min,95℃ 5min预变性;95℃ 20 s,55℃ 20 s,40个循环。反应体系为 25 μL。数据计算步骤是:ΔCt=CtFAT/CD36-Ctβ-actin;ΔΔCt= 处理组 ΔCt-对照组 ΔCt;处理组FAT/CD36 mRNA 表达为对照组的 2-ΔΔCt倍,即处理组FAT/CD36 mRNA相对表达量。设计的引物序列见表1。

表1 实时定量PCR引物序列Table 1.Human TaqMan primers for real-time PCR
2.4 Western blotting检测FAT/CD36蛋白表达 提取的细胞总蛋白用BCA法蛋白定量并标化统一浓度,上样50~100 μg至6%SDS-PAGE凝胶电泳,再电转至硝酸纤维素膜。5%脱脂牛奶37℃封闭1 h,兔抗FAT/CD36单克隆抗体(1∶200)和兔抗β-actin单克隆抗体(1∶3 000),4℃孵育过夜。TBST清洗3次,10 min/次,Ⅱ抗均是1∶7 500稀释比例37℃孵育1.5 h。TBST清洗3次,10 min/次,ECL光化学法显色。
2.5 油红O染色 将细胞种入6孔板,进行细胞爬片油红 O染色:PBS清洗3次,10%甲醛盐固定30 min;PBS清洗2次,1,2-丙二醇孵育2 min后吸尽,油红O染色30 min;双蒸水清洗3次,苏木素复染2 min;洗净后甘油明胶封片。
2.6 酶比色法检测细胞内甘油三脂(triglyceride,TG)水平 收集细胞沉淀加入正庚烷、异丙醇混合抽提剂(2∶3.5)。超声破碎细胞,离心后上清真空干燥后比色法进行TG定量,而沉淀用1 mol/L NaOH溶解。24 h后进行Lowry总蛋白定量,计算TG与细胞总蛋白含量的比值,即各组TG相对含量。
2.7 ELISA检测细胞内FFA水平 收集细胞沉淀加入氯仿、正庚烷、甲醇混合抽提剂(56∶42∶2)。超声破碎细胞,离心后上清真空干燥,ELISA进行FFA定量,而沉淀用1 mol/L NaOH溶解。24 h后进行Lowry总蛋白定量,计算FFA与细胞总蛋白含量的比值,即各组FFA相对含量。
3 统计学处理
采用SPSS 13.0软件,进行方差分析比较不同处理组各项指标的差异,数据以均数±标准差(±s)表示。以P<0.05为差异有统计学意义。
结 果
1 不同浓度脂肪酸对HMCs和HK-2细胞 FAT/CD36 mRNA表达的影响
当负荷的软脂酸浓度的增加,2种细胞FAT/CD36 mRNA表达也随之增加,呈剂量依赖性。其中,HMCs在0.16 mmol/L软脂酸浓度下、HK-2细胞在0.08 mmol/L软脂酸浓度下FAT/CD36 mRNA表达相对于0 mmol/L浓度组有增加,差异有统计学意义(P<0.05)。在0.32 mmol/L组2种细胞 FAT/CD36 mRNA表达相对于0 mmol/L浓度组增加更明显(P <0.01),见图1。

Figure 1.Palmitate up-regulated the mRNA expression of FAT/CD36 in a concentration-dependent manner in HMCs and HK-2 cells.±s.n=6.*P<0.05,**P<0.01 vs 0 mmol/L palmitate group.图1 软脂酸呈浓度依赖性上调HMCs和HK-2 FAT/CD36 mRNA表达
2 不同浓度脂肪酸对HMCs和HK-2细胞 FAT/CD36蛋白表达的影响
Western blotting显示,不同浓度的软脂酸处理HMCs和HK-2细胞24 h后,随着软脂酸的浓度增加,2种细胞FAT/CD36蛋白表达也增加,与细胞FAT/CD36 mRNA表达结果一致,见图2。
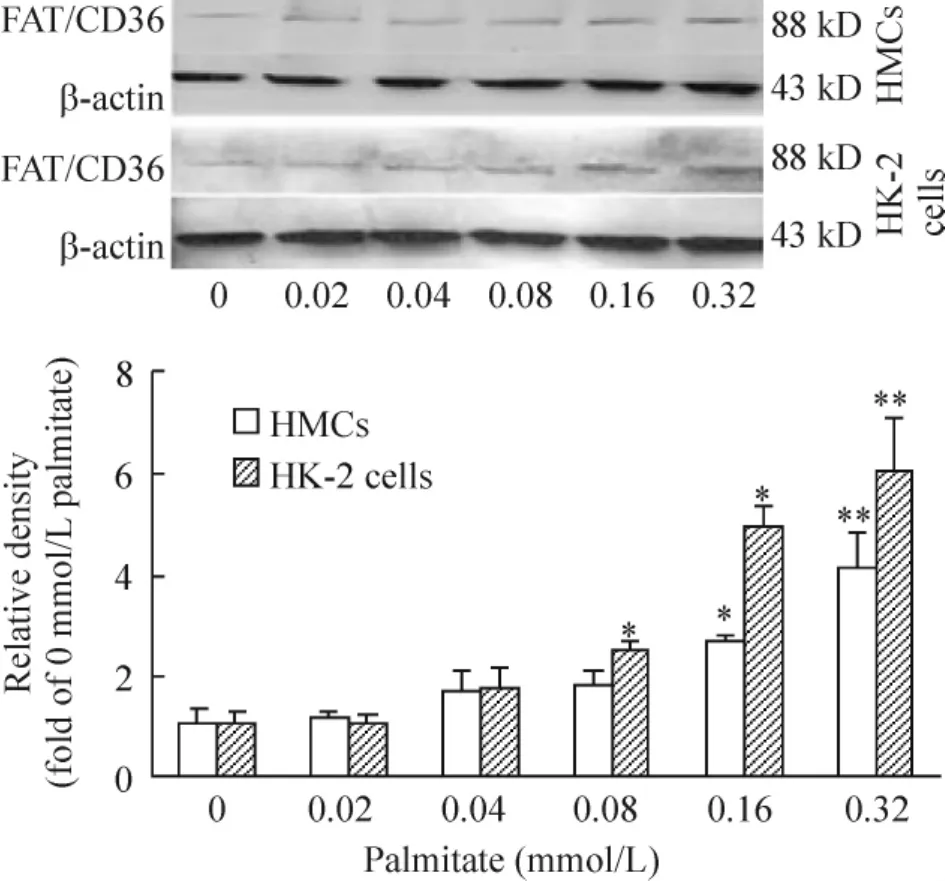
Figure 2.Palmitate up-regulated the protein expression of FAT/CD36 in a concentration-dependent manner in HMCs and HK-2 cells.±s.n=3.*P<0.05,**P<0.01 vs 0 mmol/L palmitate group.图2 软脂酸呈浓度依赖性上调HMCs和HK-2 FAT/CD36蛋白表达
3 TNF-α和IL-6对脂肪酸负荷的HMCs和HK-2细胞FAT/CD36 mRNA表达的影响
25 μg/L TNF-α 和20 μg/L IL-6炎症因子组与对照组相比,单纯炎症因子组FAT/CD36 mRNA表达均有增加,且有统计学意义(P<0.05)。TNF-α组和IL-6组联合0.04 mmol/L软脂酸处理组与单纯软脂酸处理组相比,FAT/CD36 mRNA表达均明显增加,差异显著(P<0.05),见图3。

Figure 3.Effects of palmitate(0.04 mmol/L)combined with TNF-α or IL-6 on the mRNA expression of FAT/CD36 in HMCs and HK-2 cells.±s.n=6.*P<0.05 vs control group;#P <0.05 vs palmitate group.图3 软脂酸联合TNF-α和IL-6对HMCs和HK-2细胞FAT/CD36 mRNA表达的影响
4 TNF-α和IL-6对脂肪酸负荷的HMCs和HK-2细胞FAT/CD36蛋白表达的影响
Western blotting显示,TNF-α 25 μg/L和IL-6 20 μg/L处理的负荷有0.04 mmol/L软脂酸的HMCs和HK-2细胞FAT/CD36蛋白表达明显增加,与mRNA表达结果一致,见图4。
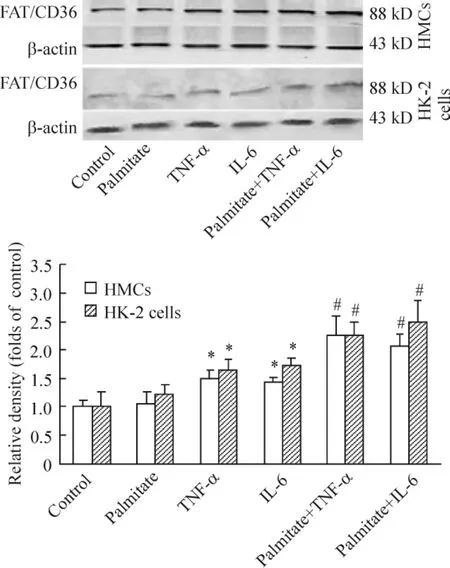
Figure 4.Effects of palmitate(0.04 mmol/L)combined with TNF-α or IL-6 on the protein expression of FAT/CD36 in HMCs and HK-2.±s.n=3.*P<0.05 vs control group;#P <0.05 vs palmitate group.图4 TNF-α和IL-6对软脂酸负荷的HMCs和HK-2细胞FAT/CD36蛋白表达的影响
5 TNF-α和IL-6对脂肪酸负荷的HMCs和HK-2细胞内脂质积聚的影响
油红O染色显示,在低浓度软脂酸下,HMCs和HK-2细胞内脂质出现轻微增加;TNF-α和IL-6处理后,红染明显增加,脂质明显增多;而联合处理的肾细胞较单纯软脂酸处理的细胞,脂质进一步积聚。同时检测HMCs和HK-2细胞内TG含量,结果与油红O染色结果一致,见图5、6。
通过酶免疫分析法检测HMCs和HK-2细胞内FFA含量,并计算其相对量。0.04 mmol/L软脂酸组与对照组相比,HMCs和HK-2细胞内FFA均增加不明显;联合处理组肾细胞相对于单纯软脂酸组来说,HMCs和HK-2细胞内FFA增加更明显,差异显著(P <0.05),见图7。
讨 论
近来研究认为,脂质代谢紊乱是慢性肾脏疾病发生发展的关键环节,当机体处于代谢综合征状态下,可以引起肾脏内脂质沉积和肾损伤[5]。“脂质肾毒性学说”认为,体内长期保持高游离脂肪酸水平,可以诱导肾细胞凋亡及促使糖尿病的发生,同时肾脏损害又可以导致脂质代谢紊乱[6-8]。肾细胞脂肪酸的摄取代谢过程中有许多代谢酶参与,其中脂肪酸转运酶FAT/CD36是参与肾细胞脂肪酸代谢重要酶之一。FAT/CD36广泛存在于骨骼肌细胞、心肌细胞、脂肪细胞以及血管内皮细胞等各种组织细胞中,扮演着清道夫受体的角色,又参与长链脂肪酸转运、胰岛素抵抗和动脉粥样硬化形成的过程。Chabowski等[9]研究 ZDF(Zucker diabetic fatty)大鼠在糖尿病前期胰岛素抵抗阶段,高脂喂养的青年大鼠出现骨骼肌FAT/CD36表达增加,同时使脂肪酸转运增加66%,而且高脂饮食的小型猪同样出现脂质代谢紊乱,胸主动脉、肝组织、肾组织FAT/CD36表达均增加。本研究也在体外实验中得出:脂肪酸负荷的肾细胞FAT/CD36表达增加,胞内脂质积聚增多。高浓度脂肪酸刺激细胞FAT/CD36 mRNA和蛋白的表达,当细胞FAT/CD36增加时,脂肪酸的摄取也会增多。Kuchibhotla等[10]研究认为FAT/CD36可能不仅参与摄入修饰的脂蛋白所致动脉粥样硬化的过程,而且参与促进动脉粥样硬化的炎症过程。本实验中,在炎症因子刺激下的肾细胞FAT/CD36表达也增加,说明炎症反应与组织细胞FAT/CD36的表达可能存在一个潜在的互动机制。
近来相关研究认为,慢性肾脏疾病随着肾功能进行性损害常表现出以单核巨噬细胞系统激活,伴随TNF-α、IL-6和C-反应蛋白等促炎症因子释放的慢性炎症过程[11]。炎症可以刺激肾小球系膜细胞分泌多种炎症细胞因子,如IL-6、IL-1,而这些细胞因子可通过旁分泌或自分泌的方式使炎症效应不断放大,最终导致肾小球硬化和糖尿病肾病发生[12]。我们课题组通过大量体外实验证实并提出:炎症不仅可以改变脂质代谢平衡,而且还是脂质诱导肾脏损害的中间环节与关键因素[13-14]。
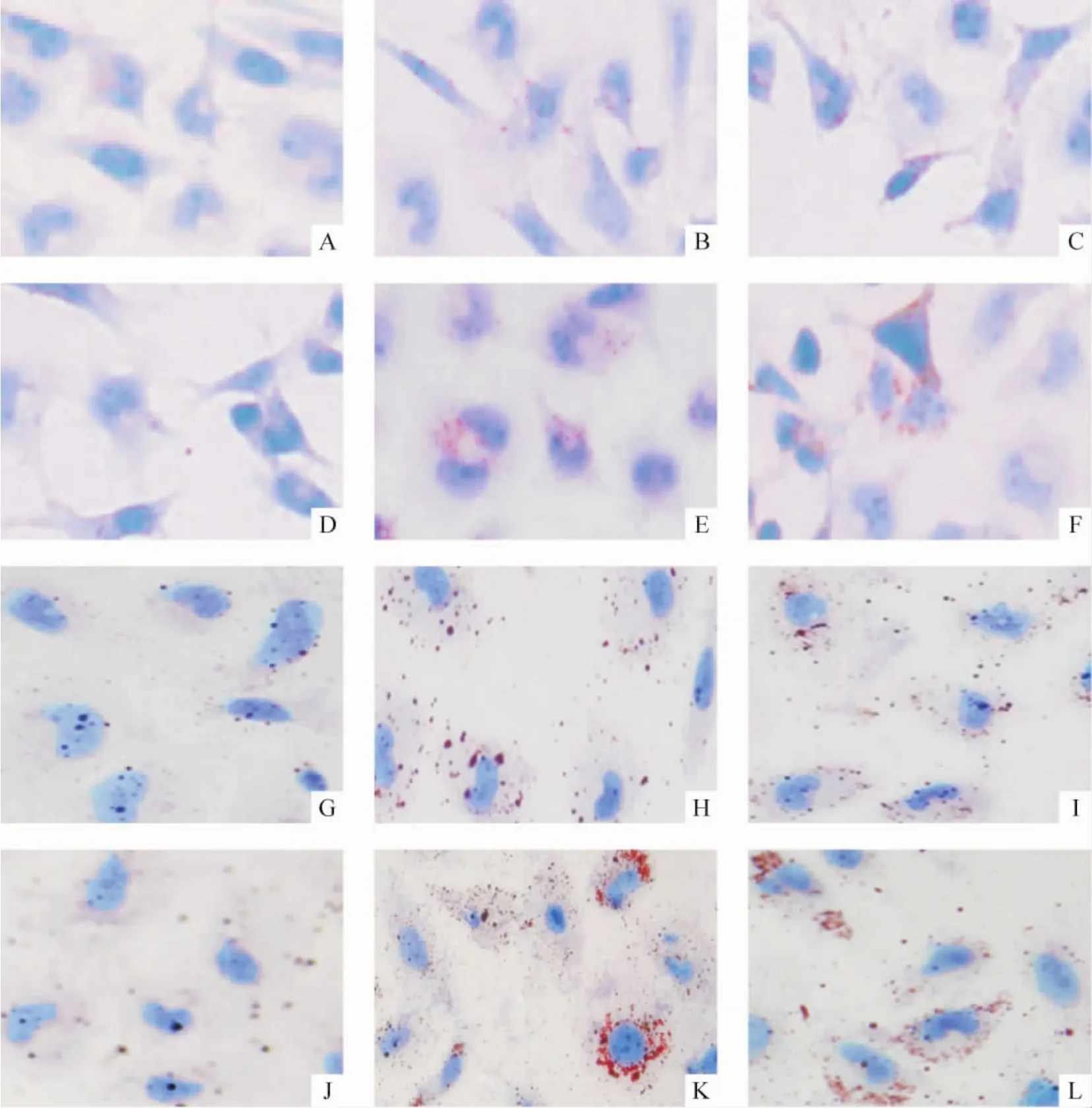
Figure 5.Lipid accumulation in HMCs and HK-2 cells examined by oil red O staining after palmitate treatment combined with TNF-α or IL-6(×400).A-F:HMCs;G-L:HK-2;A,G:control;B,H:TNF-α 25 μg/L;C,I:IL-6 20 μg/L;D,J:palmitate 0.04 mmol/L;E,K:palmitate 0.04 mmol/L plus TNF-α 25 μg/L;F,L:palmitate 0.04 mmol/L plus IL-6 20 μg/L.图5 TNF-α和IL-6对软脂酸负荷的HMCs和HK-2细胞内脂质积聚的影响

Figure 6.TG level in HMCs and HK-2 cells after palmitate(0.04 mmol/L)treatment combined with TNF-α or IL-6.±s.n=6.*P<0.05 vs control group;#P<0.05,##P <0.01 vs palmitate group.图6 TNF-α和IL-6对软脂酸负荷的HMCs和HK-2细胞内脂质积聚的影响

Figure 7.FFA level of HMCs and HK-2 cells after palmitate(0.04 mmol/L)treatment combined with TNF-α or IL-6.±s.n=6.*P<0.05,**P<0.01 vs control group;#P <0.05 vs 0.04 mmol/L palmitate group.图7 软脂酸联合TNF-α和IL-6对HMCs和HK-2细胞内FFA水平的影响
目前,炎症对肾细胞脂肪酸转运的影响机制还不是十分清楚。本实验观察到,不管是人系膜细胞(HMCs)还是人肾小管上皮细胞(HK-2),在模拟正常人或代谢综合征早期,处于低浓度脂肪酸水平的细胞FAT/CD36 mRNA和蛋白增加均不明显。然而在低浓度脂肪酸负荷条件下,炎症因子刺激的肾细胞FAT/CD36表达比单纯低浓度脂肪酸组增加更明显。而炎症因子刺激增加的FAT/CD36也会使肾细胞摄取更多的脂肪酸。通过油红O染色和肾细胞HMCs和HK-2细胞内游离脂肪酸含量的测定进一步证实这一结果。实验结果说明:炎症因子可以进一步上调脂肪酸负荷的肾细胞FAT/CD36的表达,以及加重胞内脂质积聚。该研究为阐明炎症可能作为独立致病因子在脂质介导的肾损害中的作用机制提供了理论依据,FAT/CD36途径可作为一个切入点为新药开发及临床治疗提供线索。
[1] Ruan XZ,Varghese Z,Powis SH,et al.Dysregulation of LDL receptor under the influence of inflammatory cytokines:a new pathway for foam cell formation[J].Kidney Int,2001,60(5):1716-1725.
[2] Ruan XZ,Moorhead JF,Tao JL,et al.Mechanisms of dysregulation of low-density lipoprotein receptor expression in vascular smooth muscle cells by inflammatory cytokines[J].Arterioscler Thromb Vasc Biol,2006,26(5):1150-1155.
[3] Ma KL,Ruan XZ,Powis SH,et al.Inflammatory stress exacerbates lipid accumulation in hepatic cells and fatty livers of apolipoprotein E knockout mice[J].Hepatology,2008,48(3):770-781.
[4] 李旭升,陈国荣,胡 野,等.糖尿病大鼠巨噬细胞CD36基因表达水平[J].中国病理生理杂志,2007,23(11):2272-2273.
[5] Spencer MW,Mühlfeld AS,Segerer S,et al.Hyperglycemia and hyperlipidemia act synergistically to induce renal disease in LDL receptor-deficient BALB mice[J].Am J Nephrol,2004,24(1):20-31.
[6] Lupi R,Dotta F,Marselli L,et al.Prolonged exposure to free fatty acids has cytostatic and pro-apoptotic effects on human pancreatic islets:evidence that β-cell death is caspase mediated,partially dependent on ceramide pathway,and Bcl-2 regulated[J].Diabetes,2002,51(5):1437-1442.
[7] Shimabukuro M,Zhou YT,Levi M,et al.Fatty acid-induced β cell apoptosis:a link between obesity and diabetes[J].Proc Natl Acad Sci U S A,1998,95(5):2498-2502.
[8] Allick Q,Sprangers F,Weverling GJ.Free fatty acids increase hepatic glycogen content in obese males[J].Metabolism,2004,53(7):886-893.
[9] Chabowski A,Chatham JC,Tandon NN,et al.Fatty acid transport and FAT/CD36 are increased in red but not in white skeletal muscle of ZDF rats[J].Am J Physiol Endocrinol Metab,2006,291(3):675-682.
[10] Kuchibhotla S,Vanegas D,Kennedy DJ,et al.Absence of CD36 protects against atherosclerosis in ApoE knockout mice with no additional protection provided by absence of scavenger receptor A Ⅰ/Ⅱ[J].Cardiovasc Res,2008,78(1):185-196.
[11] Panichi V,Migliori M,De Pietro S,et al.C-reactive protein as a marker of chronic inflammation in uremic patients[J].Blood Purif,2000,18(3):183-190.
[12] 田林红,陈雪红,倪安民,等.糖尿病肾病患者血清IL-1、IL-6含量测定[J].中国病理生理杂志,2001,17(2):127,129.
[13] Ruan XZ,Moorhead JF,Varghese Z.Lipid redistribution in renal dysfunction [J].Kidney Int,2008,74(4):407-409.
[14] Ruan XZ,Varghese Z,Moorhead JF.An update on the lipid nephrotoxicity hypothesis[J].Nat Rev Nephrol,2009,5(12):713-721.
