孕酮对氧糖剥夺损伤的PC12细胞的保护作用*
2012-09-14侯志慧王国红吴春平李东亮
侯志慧, 王国红, 吴春平, 李东亮
(新乡医学院生理学与神经生物学教研室,河南新乡453003)
血液中的葡萄糖通过血脑屏障进入脑组织需要相应的运载工具,即葡萄糖转运蛋白(glucose trans-port proteins,GLUT)来完成[1]。脑组织表达 GLUT1和GLUT3,GLUT1主要在微血管内皮上表达,而神经元则主要表达GLUT3。正常情况下,脑细胞主要依赖葡萄糖的有氧氧化获得能量。缺氧缺血时,葡萄糖的有氧氧化受到抑制,脑细胞转为依靠葡萄糖的无氧糖酵解来获取能量。然而,无氧糖酵解产生ATP的效率下降,要满足脑细胞对能量的需求,就需要大量葡萄糖作为底物,葡萄糖进入脑细胞必须借助细胞膜上的GLUT3进行跨膜转运。因此GLUT3表达的多少就成为决定缺血时脑细胞对葡萄糖利用效率的首要因素,在脑缺氧缺血损伤的病理过程中起关键作用,是干预脑缺氧缺血损伤的重要靶点。探索缺氧缺血时增强神经元葡萄糖供给和摄取能力的调控因素具有重要意义。本实验室前期在缺氧缺血新生鼠和缺血-再灌注大鼠已经证实孕酮(progesterone,PROG)对缺血脑组织有保护作用[1-2],还观察到孕酮可上调缺氧缺血新生鼠脑组织GLUT1和GLUT3的表达[3]。为排除体内复杂内环境的影响,本研究采用神经生长因子(nerve growth factor,NGF)诱导分化的具有典型神经元结构和功能特性的大鼠肾上腺嗜铬细胞瘤PC12细胞,建立其氧糖剥夺(oxygen-glucose deprivation,OGD)损伤模型,模拟体内脑缺氧缺血条件,进一步在体外研究孕酮抗神经元缺氧缺血损伤的保护作用并探讨其对GLUT3的干预作用。
材料和方法
1 材料
1.1 主要试剂 2-(2-甲氧基-4-硝苯基)-3-(4-硝苯基)-5-(2,4-二磺基苯)-2H-四唑单钠盐[2-(2-methoxy-4-nitrophenyl)-3-(4-nitrophenyl)-5-(2,4-disulfophenyl)-2H-tetrazolium sodium salt,WST-8]细胞增殖及细胞毒性检测试剂盒和乳酸盐脱氢酶(lactate dehydrogenase,LDH)检测试剂盒均购自碧云天生物技术研究所;羊抗鼠GLUT3多克隆抗体购自Santa Cruz;逆转录试剂盒A3500购自Promega;Trizol试剂和NGF 2.5S购自Invitrogen;胎牛血清购自杭州四季青公司;DMEM培养基、DMEM培养基(无糖,无酚红)和孕酮均购自Sigma。
1.2 细胞系 PC12细胞购于中国科学院上海生科院细胞资源中心。
2 方法
2.1 细胞培养及实验分组 PC12细胞采用DMEM培养基,内含10%胎牛血清、1×105U/L氨苄青霉素和1×105U/L链霉素,置于37℃、5%CO2培养箱内常规培养,取对数生长期细胞进行实验。实验分为正常对照组(常规培养,不行 OGD处理)、OGD组(无糖培养基、氧浓度<1%环境中进行OGD处理30 min后,恢复常氧常糖培养24 h)和PROG+OGD组(在OGD和复氧复糖期间培养基中含10 nmol/L孕酮,余同OGD组)。培养基中均不含酚红,以避免对检测结果的干扰。
2.2 PC12细胞的诱导分化 取对数生长期的PC12细胞,弃培养液,用PBS漂洗1次,加入预热至37℃的0.25%胰酶1.5 mL,消化30 s,观察细胞间有裂纹时,吸去胰酶,终止消化,加入预热的含50 μg/L NGF 2.5S的 DMEM培养基,调整细胞密度至1×109cells/L,传代培养5 d,待PC12细胞长出较长突起,具有典型神经元特征时,取诱导分化良好的PC12细胞,按实验需要密度接种于培养板中,再诱导分化48 h,选取贴壁好,诱导分化一致的培养孔随机按上述分组。
2.3 OGD模型的建立 参照文献建立PC12细胞的OGD模型。取对数生长期PC12细胞,弃孔内培养液,用预热无糖DMEM培养基漂洗2次,随后换上预热的无糖DMEM培养基和10 nmol/L孕酮无糖工作液,移去培养板盖后将培养板放入(37.0±0.5)℃缺氧舱内,持续充入体积分数分别为95%N2+5%CO2的混合气体行缺氧处理。缺氧气体由舱底进入,舱顶排出,以10 L/min的流量置换舱内氧气,6min后(测定舱内O2浓度降至1%以下)再以1 L/min的流量进行OGD处理30 min。OGD结束后取出培养板,OGD组更换为预热的常糖DMEM培养基,PROG+OGD组更换为预热的含10 nmol/L孕酮的常糖工作液,转移到37℃、5%CO2培养箱内常氧培养24 h。
2.4 形态学观察 将培养板置于倒置相差显微镜下观察各组细胞形态变化,各组均取板孔正中视野进行观察并拍照。
2.5 WST-8比色法检测细胞活力[4]将对数生长期的PC12细胞以5×107cells/L的密度接种于96孔板中培养,待细胞基本融合后,吸弃培养液,随机进行分组。氧糖剥夺30 min并复氧复糖24 h后,每孔加入10 μL WST-8溶液。细胞培养箱内继续孵育1 h后,酶标仪测定450 nm波长处吸光度值(A),630 nm参考波长进行双波长测定。每组设4个复孔,实验重复3次。
2.6 LDH活性测定[5]收集各组细胞培养上清液,按LDH检测试剂盒说明书进行操作,1 cm光程比色杯中加入工作液1 mL,细胞培养上清液200 μL,混合均匀,37℃保温30 s,读取初始吸光度,同时开始精确计时,1、2、3 min时分别读取吸光度,确定每分钟平均吸光度变化(ΔA/min)。LDH(U/L)=(ΔA样品/min-ΔA空白/min)×F。F= 反应总体积 ×1 000/样品体积×消光系数。
2.7 RT-PCR检测GLUT1和 GLUT3 mRNA水平 收集各组细胞,采用RT-PCR法检测GLUT1和GLUT3 mRNA表达,采用Trizol试剂盒(Invitrogen)提取样品中总RNA,操作按照试剂盒说明进行,A260/A280测定RNA纯度,取2 μg逆转录成cDNA,反应样品分装保存于-20℃。以 cDNA为模板,进行GLUT1、GLUT3和β-actin(内参照)扩增。PCR反应体系如下:10×PCR 缓冲液5 μL,MgCl2(25 mmol)3 μL,dNTPs(10 mmol)1 μL,上游引物(50 pmol)1 μL,下游引物(50 pmol)1 μL,模板 DNA 1 μg,DNA聚合酶(5×106U/L)0.5 μL,灭菌双蒸水补至 50 μL。反应条件为:94℃ 2 min进行循环;94℃ 1 min,50℃ 1 min,72 ℃ 1 min,循环 30次(β-actin循环25次),再72℃ 5 min。使用PCR扩增仪(Biometra)进行扩增。PCR扩增产物 10 μL与 DNA marker DL2000一起在含溴化乙啶2.0%琼脂糖凝胶上电泳分离。电泳条带用NIH图像软件ImageJ进行灰度分析,以目的基因条带/β-actin带的灰度值表示该目的基因mRNA相对含量。所用引物由上海生物工程有限公司合成,引物序列详见表1。
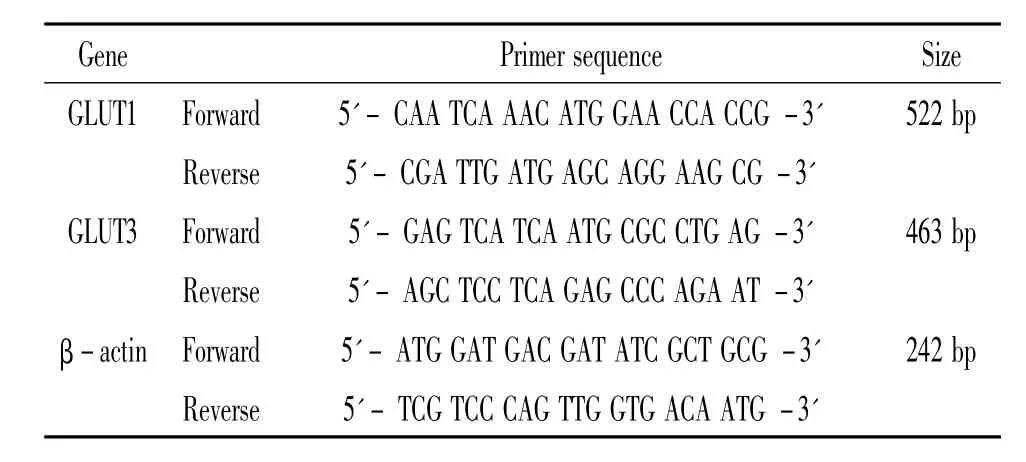
表1 引物序列Table 1.Primer sequences
2.8 Western blotting检测GLUT3蛋白表达 收集PC12细胞后,加入细胞裂解液,冰上裂解20 min,超声1 s,间隔5 s,连续5次,离心取上清,用BCA法测定蛋白质浓度。各组取变性蛋白15 μg进行SDSPAGE电泳分离蛋白质后,转至PVDF膜上,经漂洗、封闭后加入小鼠β-actin单克隆抗体(稀释度为1∶5 000)和山羊GLUT3多克隆抗体(稀释度为1∶200),4℃孵育过夜,TBST洗膜3次,每次15 min,加辣根过氧化物酶标记的Ⅱ抗室温孵育2 h,TBST洗膜3次,每次15 min,ECL显影并扫描,以 Band Scan 5.0凝胶图像处理软件进行各条带灰度分析。以β-actin为内参照,各组GLUT3与β-actin条带灰度比值表示该GLUT3相对含量。
3 统计学处理
结 果
1 PROG对氧糖剥夺PC12细胞形态的影响
正常对照组PC12细胞呈梭型,两极伸出较长突起,有的突起可发出分枝,呈典型神经元结构特征,见图1A;OGD组PC12细胞的密度降低,突起减少或消失,大部分细胞肿胀变圆,细胞有聚团现象,部分细胞裂解成碎片,见图1B;PROG+OGD组细胞胞体肿胀程度较OGD组明显减轻,大部分细胞仍呈梭形,有细而短的突起伸出,聚团现象不明显,细胞碎片的形成减少,见图1C。
2 PROG对氧糖剥夺PC12细胞活力的影响
WST-8比色法检测细胞活力,A值与活细胞数成正比。OGD组A值降低,与正常对照组比较有显著差异(P<0.01),而PROG+OGD组A值增高,显著高于OGD组(P<0.01),提示孕酮可增加氧糖剥夺的PC12细胞的存活率,见表2。
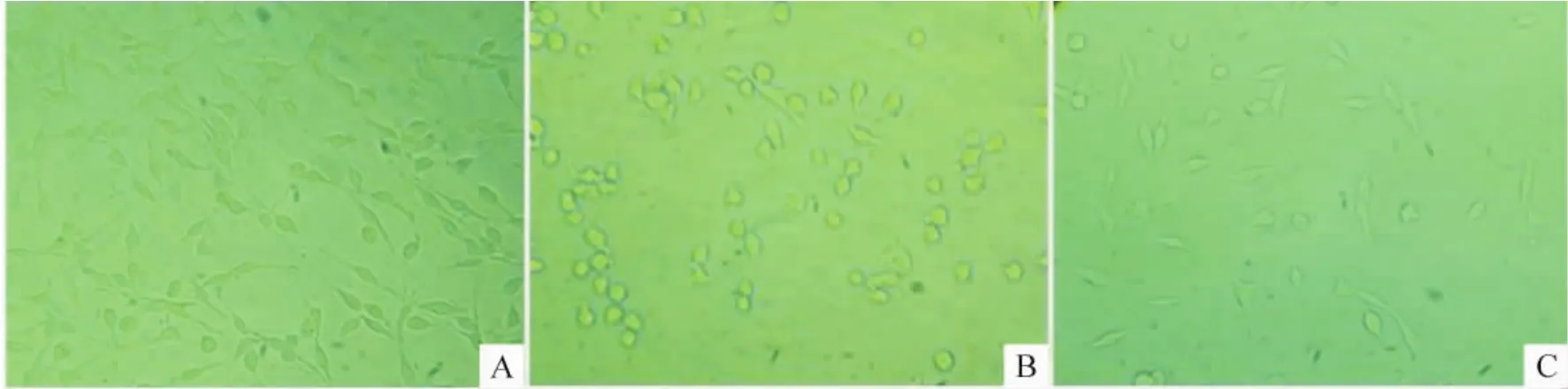
Figure 1.Effect of PROG on morphology of PC12 cells injured by OGD(×400).A:normal control group;B:OGD group(the morphology changed obviously after OGD for 30 min and restoration for 24 h);C:PROG+OGD group(the morphology was much better than that of OGD group).图1 PROG对氧糖剥夺损伤PC12细胞形态的影响
3 PROG对氧糖剥夺PC12细胞培养上清液中LDH活性的影响
LDH漏出量是衡量细胞损伤的重要指标,与细胞损伤程度成正比。LDH活性检测结果显示,OGD组培养上清液中LDH活性明显高于正常对照组(P<0.01),PROG+OGD组 LDH活性明显低于OGD组(P<0.01),见表2。这提示PROG可减轻OGD对PC12细胞的损伤。
表2 PROG对氧糖剥夺损伤PC12细胞活力和LDH活性的影响Table 2.Effects of progesterone on the cell viability and LDH activity of PC12 cells injured by OGD(±s.n=12)

表2 PROG对氧糖剥夺损伤PC12细胞活力和LDH活性的影响Table 2.Effects of progesterone on the cell viability and LDH activity of PC12 cells injured by OGD(±s.n=12)
**P <0.01 vs normal group;▲▲P <0.01 vs OGD group.
Group Absorbance(A) LDH(U/L)Normal 0.986 ±0.060 687.5 ±82.7 OGD 0.600 ±0.050** 2 364.6 ±78.6**PROG+OGD 0.766 ±0.031▲▲ 1 552.2 ±234.7▲▲
4 PROG对氧糖剥夺PC12细胞GLUT3 mRNA表达的影响
RT-PCR结果显示,GLUT1 mRNA在正常对照组、OGD组与PROG+OGD组均未检测到。正常对照组GLUT3 mRNA有基础表达;OGD组GLUT3 mRNA表达上调,显著高于正常对照组(P<0.01);PROG+OGD组GLUT3 mRNA表达量明显高于OGD组(P<0.05),见图2。
5 PROG对氧糖剥夺PC12细胞GLUT3蛋白表达的影响
Western blotting检测结果显示,正常对照组PC12细胞GLUT3有少量基础表达;OGD组PC12细胞GLUT3表达上调,明显高于正常对照组(P<0.01);而PROG+OGD组 GLUT3表达又明显高于OGD组(P<0.01),见图3。
讨 论
孕酮被称为神经活性甾体。近年来研究表明孕酮有减少脑梗死面积[6]、提高认知能力和促进大脑功能恢复等作用。孕酮可通过抗兴奋性氨基酸(excitativeamionacids,EAA)的神经毒性作用、减轻Ca2+超载导致的神经元损伤、抗氧自由基作用、抗神经元凋亡作用等多种途径而起到神经保护作用[7]。为排除体内复杂内环境的影响,进一步在体外印证孕酮抗缺氧缺血损伤的神经保护作用并进一步探讨其机制,本研究建立PC12细胞的体外氧糖剥夺模型,模拟体内缺氧缺血条件,观察孕酮对OGD损伤的PC12细胞形态、损伤程度、细胞活力及GLUT3表达的影响,结果显示:孕酮可以减轻OGD所致的PC12细胞肿胀,减少LDH漏出,从而减轻细胞损伤,并且提高细胞活力。这些结果提示在体外孕酮对OGD损伤的PC12细胞具有保护作用。这与前人及我们前期体内动物研究所得到的孕酮对缺氧缺血损伤具有保护作用的结果相一致[1-3,8]。
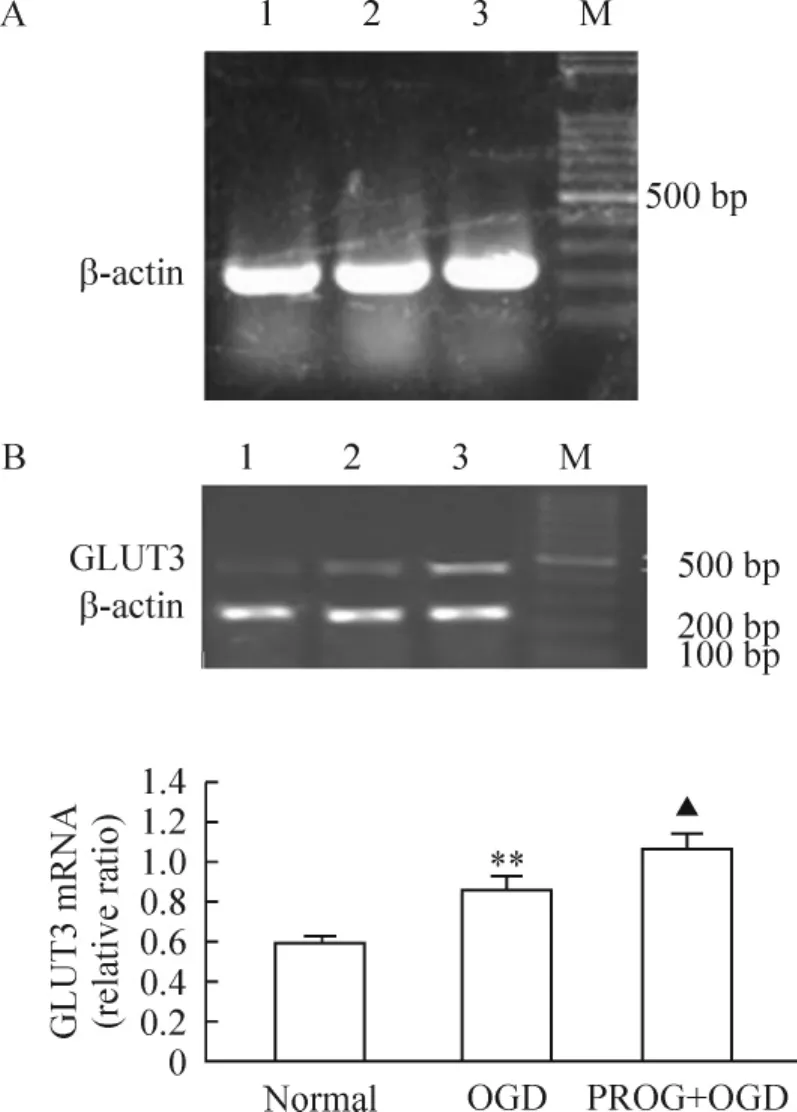
Figure 2.Effects of PROG on the expression of GLUT1(A)and GLUT3(B)mRNA in PC12 cells injured by OGD.1:normal group;2:OGD group;3:PROG+OGD group;M:marker.±s.n=3.**P<0.01 vs normal group;▲P <0.05 vs OGD group.图2 PROG对氧糖剥夺PC12细胞GLUT1和GLUT3 mRNA表达的影响
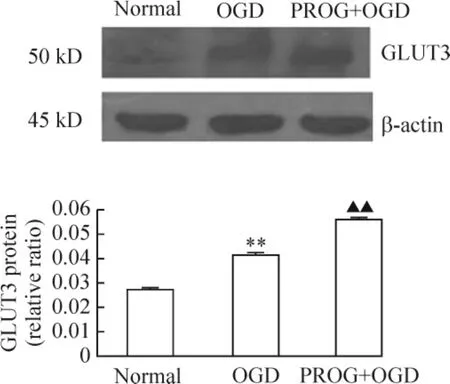
Figure 3.Effect of PROG on the expression of GLUT3 protein in PC12 cells injured by OGD.±s.n=3.**P<0.01 vs normal group;▲▲P <0.01 vs OGD group.图3 PROG对氧糖剥夺PC12细胞GLUT3蛋白表达的影响
血液中的葡萄糖通过血脑屏障进入脑组织需要借助葡萄糖转运蛋白这一运载工具来完成。GLUT3是神经元上的主要葡萄糖转运蛋白,负责将葡萄糖转运入神经元内[9-10]。在人脑中神经元的 GLUT3表达量明显高于胶质细胞和内皮细胞,本实验在PC12细胞没有检测到GLUT1 mRNA的表达,成为PC12细胞具有神经元属性的又一佐证。GLUT3对葡萄糖亲合力高,其转运效率比其它转运蛋白要高,这有利于神经元对葡萄糖的摄取,反映了脑细胞代谢旺盛的特点[11-12]。实验室前期研究工作已经表明,孕酮上调新生鼠脑缺氧缺血海马组织GLUT1、GLUT3 mRNA 及蛋白的表达[3,8]。而本实验结果显示,正常对照组PC12细胞表达少量GLUT3 mRNA和蛋白,而OGD后GLUT3 mRNA和蛋白的表达增高,PROG干预后GLUT3 mRNA和蛋白表达较OGD组又显著增加,这一结果与本室前期在体动物研究结果相吻合。该结果提示,上调GLUT3表达是神经元对抗OGD损伤的内源性保护机制之一,而孕酮可通过增强GLUT3表达进一步启动和促进该保护机制的进行从而发挥其抗OGD损伤的保护作用。
缺氧缺血时GLUT3上调可能与低氧情况下增加低氧诱导因子1(hypoxia-inducible factor 1,HIF-1)的表达有关。HIF-1是一种随着细胞内氧浓度变化而调节其靶基因表达的转录激活因子,是由α和β亚基组成的一种异二聚体。有报道在局灶性脑缺血中,梗死周围慢性缺血区域的HIF-1α表达增高[13]。HIF-1α除了介导缺氧应答外,对脑缺血后的神经损伤有保护作用,在脑缺血损伤和保护机制中起重要作用。Baranova等[14]研究结果显示,当机体遭受缺血缺氧损伤时HIF-1α表达增加,通过介导缺氧应答反应,增加其靶基因的转录,对机体有一定的保护作用。受HIF-1直接作用的靶基因有60多个,包括促红细胞生成素、血管内皮生长因子、cyclin G2、NIP3、葡萄糖转运蛋白、乳酸脱氢酶、醛缩酶A、烯醇化酶、转录蛋白、诱导型一氧化氮合酶、内皮素-1等等[15]。这些靶基因产物或能增加缺氧组织的氧供应,或能降低细胞耗氧量,或增加葡萄糖的转运等等,以维持内环境的稳定,使机体对缺氧产生耐受与适应。本研究发现GLUT3 mRNA表达在PROG组中显著增高,GLUT3蛋白水平的表达与mRNA相一致,PROG+OGD组GLUT3 mRNA、GLUT3蛋白表达不仅明显高于正常对照组,也高于OGD组。这些结果提示,孕酮可能通过上调HIF -1α靶基因GLUT3的表达提高缺氧缺血时神经元对葡萄糖的转运效率,增强神经元对缺氧缺血的耐受,产生神经保护作用。本研究为孕酮用于临床治疗脑卒中奠定了理论基础。
[1] 王小引.孕酮对新生鼠缺氧缺血性脑损伤后脑组织糖原合成酶激酶-3β的影响[J].新乡医学院学报,2008,25(6):556-558.
[2] 李东亮,赵红岗,王东霞,等.孕酮对缺血/再灌注大鼠脑皮层水肿的影响[J].中国应用生理学杂志,2001,17(04):327-329.
[3] 李东亮,韩 华.孕酮对脑缺氧缺血新生鼠海马葡萄糖转运蛋白表达的影响[J].中国应用生理学杂志,2008,24(3):353-355.
[4] Shimazawa M,Nakajimaa Y,Mashima Y,et al.Docosahexaenoic acid(DHA)has neuroprotective effects against oxidative stress in retinal ganglion cells[J].Brain Res,2009,1251:269-275.
[5] Xu HB,Li L,Liu GQ.Protection against hydrogen peroxide-induced cytotoxicity in PC12 cells by guggulsterone[J].Yao Xue Xue Bao,2008,43(12):1190-1197.
[6] Ishrat T,Sayeed I,Atif F,et al.Effects of progesterone administration on infarct volume and functional deficits following permanent focal cerebral ischemia in rats[J].Brain Res,2009,1257:94-101.
[7] Ozacmak VH,Sayan H.The effects of 17beta estradiol,17alpha estradiol and progesterone on oxidative stress biomarkers in ovariectomized female rat brain subjected to global cerebral ischemia[J].Physiol Res,2009,58(6):909-912.
[8] 李新娟,韩 华,田香勤,等.孕酮干预缺氧缺血性脑损伤新生大鼠海马葡萄糖转运蛋白1、3基因的表达[J].实用儿科临床杂志,2009,24(14):1088-1090.
[9] Yu S,Zhao T,Guo M,et al.Hypoxic preconditioning up-regulates glucose transport activity and glucose transporter(GLUT1 and GLUT3)gene expression after acute anoxic exposure in the cultured rat hippocampal neurons and astrocytes[J].Brain Res,2008,1211:22-29.
[10] 李新娟,李晓娟,姜洪波,等.牛磺酸对弥漫性脑损伤大鼠脑葡萄糖转运体表达的影响[J].中国病理生理杂志,2011,27(9):1725-1730.
[11] Wood IS,Trayhurn P.Glucose transporters(GLUT and SGLT):expanded families of sugar transport proteins[J].Br J Nutr,2003,89(1):3-9.
[12] Royer C,Lachuer J,Crouzoulon G,et al.Effects of gestational hypoxia on mRNA levels of Glut3 and Glut4 transporters,hypoxia inducible factor-1 and thyroid hormone receptors in developing rat brain[J].Brain Res,2000,856(1-2):119-128.
[13] Michalski D,Hartig W,Schneider D,et al.Use of normobaric and hyperbaric oxygen in acute focal cerebral ischemia-a preclinical and clinical review[J].Acta Neurol Scand,2011,123(2):85-97.
[14] Baranova O,Miranda LF,Pichiule P,et al.Neuronspecific inactivation of the hypoxia inducible factor 1 alpha increases brain injury in a mouse model of transient focal cerebral ischemia[J].J Neurosci,2007,27(23):6320-6332.
[15] Shi H.Hypoxia inducible factor 1 as a therapeutic target in ischemic stroke[J].Curr Med Chem,2009,16(34):4593-4600.
