甲硝唑经皮给药制剂的体外质量守恒研究
2012-09-14贾卫哺
贾卫哺,张 嫣,李 楠
(天津大学药物科学与技术学院现代药物传递及功能高效化重点实验室,天津 300072)
治疗皮肤疾病的皮肤局部给药制剂一般通过检测接受液中的药物含量来评价治疗效果[1-2],而在皮肤病灶部位的活性成分含量没有得到检测,故考察治疗皮肤病的局部给药制剂在相关皮肤部位的药物分布非常重要。临床为了增加或提高药物的疗效,经常会在处方中加入通透修饰剂[3],一般通过经皮渗透速率来考察修饰剂对药物的功效,研究皮肤各层中药物含量的变化可更加详细地了解修饰剂对活性成分在皮肤各层分布的影响。为了测定皮肤各区域的药物的有效浓度,本研究设计了一种更适宜局部给药制剂的体外质量守恒方法,即分别检测药物在皮肤表面残留、角质层、活性表皮与真皮层和接受液中的含量。本试验以甲硝唑[4-5]为模型药物,分别用无毛小鼠皮和猪皮作为透皮模型,进行体外经皮渗透试验,分别对皮肤各层进行取样,用高效液相色谱(HPLC)法分析皮肤各层中甲硝唑的含量,并对甲硝唑经皮制剂的体外质量守恒进行方法学验证,考察此方法的可行性和适用性。
1 仪器与试药
Agilent 1100型高效液相色谱仪(美国Agilent公司);KQ-250B型超声波清洗器(昆山市超声仪器有限公司);AX 200型电子天平(日本SHIMADZU公司);YB-P6型智能透皮试验仪(天津药典标准仪器厂);UV-2450型紫外分光光度计(日本SHIMADZU公司);ZH-3型涡旋混合仪(天津药典标准仪器厂);高剪切匀化仪(德国Fluko公司);TGL-16G型高速离心机(上海安亭科学仪器厂);0.22 μm微孔滤膜(天津市实验仪器设备有限公司)。甲硝唑(药用,天津中安化工);羟丙基纤维素(Klucel®MF药用,美国Hercules公司);甲醇(色谱纯,韩国Burdick&Jackson公司);磷酸二氢钾、氢氧化钠、氯化钠和正辛醇均为分析纯(天津市江天化工有限公司);实验用水(色谱纯,天津永源纯水开发公司)。无毛小鼠(天津市放射研究所动物实验中心);猪(体重50 kg,本实验室动物房提供)。
2 方法与结果
2.1 含量测定方法的建立
色谱柱:Thermo Hypersil C18反相柱(250 mm ×4.6 mm,5 μm,ODS-2);流动相:超纯水-甲醇系统(75∶25),经抽滤脱气后使用;检测波长:310 nm;流速:1 mL/min;柱温:30℃;进样量:20 μL。标准曲线为 A=62.067 C -4.883 9,r=0.999 9;线性范围为 0.15 ~75 μg/mL。
2.2 离体皮肤的制备
将无毛小鼠断颈、处死,用医用剪刀小心剥离腹部与背部的皮肤,然后角质层向下,铺平于铺有保鲜膜的试验台上,轻轻去除皮下粘连物和脂肪,检查鼠皮的完整性,不得有任何破损,用生理盐水反复冲洗,用医用剪刀剪成适当大小,最后置于密封袋中,置-20℃环境保存备用。每次使用前应检查鼠皮的完整性,确保无破损方可使用。猪皮脱毛除去皮下组织,用生理盐水反复冲洗,用医用剪刀剪成适当大小,保存方法同鼠皮。
2.3 甲硝唑处方的制备
精密称量一定量的甲硝唑细粉溶解于称量好的超纯水中,搅拌至甲硝唑完全溶解,将羟丙基纤维素加入溶液中,继续搅拌至形成均一、稳定的凝胶。甲硝唑处方:每100 g含甲硝唑0.75 g,羟丙基纤维素0.75 g。
2.4 无毛小鼠离体皮肤体外透皮试验
2.4.1 试验方法
将预处理的无毛小鼠皮肤固定于Franz扩散池上 (角质层向上,真皮层面向接受池),在给药池和接受池中分别加入pH=7.4的磷酸盐缓冲溶液,置(32±1)℃恒温水浴的智能透皮试验仪中(转速500 r/min),平衡1 h后给药。给药前将平衡时的磷酸盐缓冲溶液全部倒出,将一定量的甲硝唑处方 (给药剂量为100 mg和50 mg,有效成分为0.75 mg和0.375 mg)置皮肤上,接受池内为 16 mL 的生理盐水,分别于 1,2,4,8,12,16,20,24 h 时取样,共分4部分进行质量守恒研究。
表皮残留量(H1):用蘸满磷酸盐缓冲溶液(pH=7.4)的棉球轻轻擦拭表皮10次以上,后用透明胶带粘取皮肤表面,将棉球和透明胶带置10 mL磷酸盐缓冲溶液中提取,最后用微孔滤膜过滤后进行高效液相检测。
角质层残留量(H2):重复用透明胶带粘取皮肤表面10次以上,直至角质层完全消失[5],将所有胶带放入10 mL磷酸盐缓冲溶液中提取,最后用微孔滤膜过滤后进行高效液相检测。
活性表皮/真皮层残留量(H3):将剩余皮肤放入1.5 mL甲醇与1.5 mL磷酸盐缓冲溶液中涡旋、粉碎、超声30 min,离心10 min(6 000 r/min),取上清液,重复3次,将上清液混合,最后用微孔滤膜过滤后进行高效液相检测[6]。
接受液含量(H4):将接受液用微孔滤膜过滤后进行高效液相检测。
2.4.2 甲硝唑凝胶剂经皮吸收方法学考察
回收率试验:将甲硝唑凝胶剂按照2.4项下方法给药,给药剂量为100 mg与50 mg(甲硝唑有效剂量分别为0.75 mg与0.375 mg)。在不同的时间点分别取样、检测,分别计算出皮肤各部分中和总共回收甲硝唑的量(表皮残留+角质层残留+活性表皮/真皮层+接受液)并与给药剂量进行对比,计算回收率。高低剂量给药回收率试验结果分别见表1和表2。根据此质量守恒方法,在给药剂量为100 mg时回收率达到85%以上,给药剂量为50 mg时甲硝唑回收率达到80%以上,说明此方法用于甲硝唑体外释放研究时回收率高,检测到的甲硝唑含量不低于80%甲硝唑给药的有效剂量。同时可以检测出甲硝唑在不同的时间点时皮肤中治疗药物的有效剂量,一定程度上可反映药物的治疗效果。
表1 甲硝唑体外经鼠皮试验回收率结果(100 mg,±s,n=6)
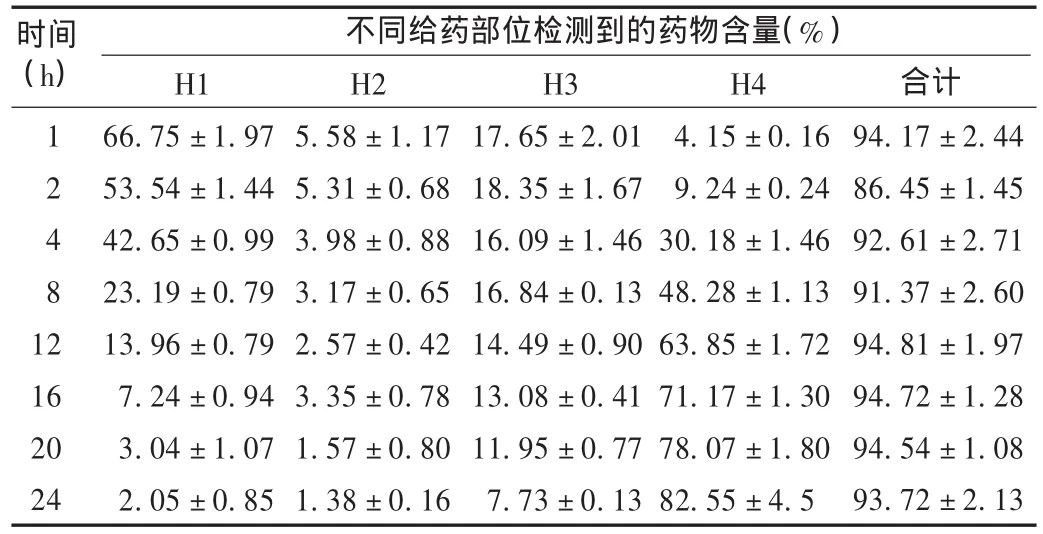
表1 甲硝唑体外经鼠皮试验回收率结果(100 mg,±s,n=6)
不同给药部位检测到的药物含量(%)时间(h)12481 2 16 20 24 H1 66.75±1.97 53.54±1.44 42.65±0.99 23.19±0.79 13.96±0.79 7.24 ±0.94 3.04 ±1.07 2.05 ±0.85 H2 5.58±1.17 5.31±0.68 3.98±0.88 3.17±0.65 2.57±0.42 3.35±0.78 1.57±0.80 1.38±0.16 H3 17.65 ±2.01 18.35 ±1.67 16.09 ±1.46 16.84 ±0.13 14.49 ±0.90 13.08 ±0.41 11.95 ±0.77 7.73±0.13 H4 4.15 ±0.16 9.24 ±0.24 30.18±1.46 48.28±1.13 63.85±1.72 71.17±1.30 78.07±1.80 82.55±4.5合计94.17 ±2.44 86.45 ±1.45 92.61 ±2.71 91.37 ±2.60 94.81 ±1.97 94.72 ±1.28 94.54 ±1.08 93.72 ±2.13
重现性考察:对甲硝唑凝胶剂经皮给药后分别在不同时间点(1,2,4,8,12,16,20,24 h)进行取样分析,每组试验重复 6 次。根据试验数据计算相对标准偏差,不同给药剂量时数据的 RSD均在15%以下,说明此经皮渗透方法的重现性良好。
2.5 猪皮体外透皮试验
2.5.1 试验方法
用猪皮验证2.4项下提供方法的普遍性,体外透皮试验操作过程中表皮残留,角质层与接受液浓度的测定同2.4项下方法,因猪皮的皮肤比较厚,所以在活性表皮/真皮层检测甲硝唑时选择将剩余皮肤置于3 mL甲醇与3 mL磷酸盐缓冲溶液中涡旋、粉碎、超声30 min,离心10 min(6 000 r/min),取上清液,重复3次,将上清液混合,最后用微孔滤膜过滤后进行高效液相检测。
表2 甲硝唑体外经鼠皮试验回收率结果(50 mg,±s,n=6)

表2 甲硝唑体外经鼠皮试验回收率结果(50 mg,±s,n=6)
时间(h)不同给药部位检测到的药物含量(%)1 2 4 8 1 2 16 20 24 H1 46.07±0.05 24.81±0.02 10.54±0.78 7.72±0.03 5.51±0.02 3.98±0.17 3.62±0.01 2.26±0.04 H2 8.00±0.02 5.03±0.01 5.81±0.03 3.11±0.02 2.97±0.01 1.23±0.01 1.36±0.08 0.01±0.00 H3 19.82±0.03 21.27±0.02 17.51±0.01 17.52±0.01 14.71±0.05 13.65±0.06 10.21±0.01 5.71±0.01 H4 14.25±0.03 34.94±0.02 46.87±0.01 57.73±0.04 63.45±0.03 69.25±0.03 77.01±0.04 87.67±0.04合计88.19±1.15 81.88±1.95 81.21±1.64 85.51±2.01 86.57±1.09 87.97±1.32 92.17±1.09 95.47±1.00
2.5.2 甲硝唑凝胶剂经猪皮吸收方法学考察
回收率试验:检测方法同2.4.2项下回收率试验方法,给药剂量为100 mg与50 mg时回收率结果均达到85%以上,分别见表3和表4。
表3 甲硝唑体外经猪皮试验回收率结果(100 mg,±s,n=6)

表3 甲硝唑体外经猪皮试验回收率结果(100 mg,±s,n=6)
时间(h)不同给药部位检测到的药物含量(%)1 2 4 81 2 16 20 24 H1 75.70±1.98 60.09±1.71 54.27±3.36 31.29±0.66 24.24±1.74 13.14±0.29 8.52±0.30 4.12±0.13 H2 2.75±0.40 5.37±0.51 5.83±0.41 4.57±0.38 3.94±0.44 4.17±0.28 3.44±0.16 3.34±0.19 H3 10.20±0.65 18.65±0.66 32.38±1.91 28.21±1.66 21.62±0.46 18.36±0.71 12.65±0.36 10.88±0.46 H4 3.17±0.12 6.24±1.25 10.30±1.94 30.91±1.31 43.61±3.67 61.85±1.42 63.52±1.06 74.93±1.68合计91.91±2.49 90.35±2.37 95.22±3.80 94.32±2.46 93.40±3.87 97.52±0.95 92.33±0.88 93.27±1.89
表4 甲硝唑体外经猪皮试验回收率结果(50 mg,±s,n=6)

表4 甲硝唑体外经猪皮试验回收率结果(50 mg,±s,n=6)
时间(h)不同给药部位检测到的药物含量(%)1 2 4 81 2 16 20 24 H1 77.81±1.30 56.90±0.85 50.25±3.97 35.43±0.58 20.78±0.37 12.68±0.41 7.69±0.44 3.78±0.36 H2 2.29±0.73 4.86±0.25 4.90±6.46 3.85±0.40 3.70±0.57 4.07±0.59 3.38±0.26 1.80±0.18 H3 10.10±0.40 18.69±1.70 32.46±1.02 24.90±0.76 21.21±0.66 17.74±0.51 12.40±0.41 11.36±1.38 H4 3.19±0.13 6.74±0.16 7.40±0.58 32.68±1.30 47.39±1.19 60.77±1.89 72.20±1.08 79.95±0.84合计93.42±1.54 87.19±2.17 95.01±5.69 96.86±2.60 96.16±2.31 95.26±2.36 95.66±0.97 96.88±2.07
重现性考察:考察过程同2.5项下重现性考察过程,每组试验数据的 RSD均在15%以下,说明此经猪皮渗透方法的重现性也良好。
3 讨论
此质量守恒方法快速、简洁,以无毛小鼠鼠皮和猪皮分别作为透皮模型时回收率均比较高,重现性均良好,说明此方法可操作性强,具有一定普遍性,适合于不同的皮肤模型,可以广泛适用于皮肤类药物的体外透皮试验。
此方法能考察药物活性成分在皮肤各部位的滞留量与滞留时间,了解药物在病灶部位的有效含量,为考察治疗效果提供依据。通过测定不同时间点的药物在皮肤4层中的含量和分布,同时也为经皮给药修饰剂等研究提供了更加详细的考察方法,考察修饰剂改变(增加或减少)药物经皮渗透速率的同时是否也改变(增加或减少)药物在皮肤病灶部位药物活性成分的含量。
[1]盛国荣.混合促透剂对肤康膜剂中水杨酸和酮康唑透皮效果的影响[J].中国药业,2005,14(4):29 -31.
[2]Ayub AC,Gomes AD,Lima MV,et al.Topical delivery of fluconazole:In vitro skin penetration and permeation using emulsions as dosage forms[J].Drug Dev Ind Pharm,2007,33(3):273 -280.
[3]Ghosh TK,Pfister WR.Transdermal and Topical Drug Delivery Systems[M].Buffalo Grove Ⅱ:Interpharm Press,1997:359.
[4]James Q,Del RD.The use of topical azlaic acid 15%gel or metronizole 0.75%gel for the treatment of rosacea:evaluation of a single-site comparative trial subset[J].Journal of the American Academy of Dermatology,2004,50(3):679.
[5]Zip CM.Innovative use of topical metronidazole[J].Dermatologic clinics,2010,28(3):525 - 534.
[6]Howes D,Guy R,Hadgraft J,et al.Methods for assessing percutaneous absorption.The report and recommendations of ECVAM Workshop 13[R].Altern Lab Anim,1996,24:81 - 106.
[7]Cross SE,Jiang R,Benson HAE,et al.Can increasing the viscosity of formulations be used to reduce the human skin penetration of the sunscreen oxybenzone[J].J Invest Dermatol,2001,117:147 - 150.
[8]Cross SE,Roberts MS.The effect of occlusion on the epidermal penetration of parabens from a commercial test ointment,acetone and ethanol vehicles[J].J Invest Dermatol,2000,115:914 - 918.
