烟叶醇化过程中烟碱降解菌的分离鉴定与特性分析
2012-09-14李天丽周亚维汤朝起瞿永生李朋富
李天丽 ,周亚维 ,汤朝起 ,瞿永生 ,李朋富*
1.南京大学生命科学院,南京市汉口路22号 210093
2.上海烟草集团有限责任公司,上海市杨浦区长阳路717号 200082
烤烟是我国种植面积最大,也是最主要的烟草类型[1]。烤烟收获、调制后要经过发酵或醇化才能应用于卷烟生产。未经过醇化处理的烟叶,由于其在燃烧过程中会产生令人不愉快的气味而不宜使用。有研究表明,烟叶醇化过程中,烟碱、蛋白质、氨基酸、高级脂肪酸等物质会发生分解和转化,形成具有香气的小分子化合物,进而明显改善烟叶的香气和吸味品质[2]。烟叶表面的许多微生物,在发酵过程中发挥了重要作用[1]。Reid等[3]发现,在发酵烟叶上存在的大量细菌,主要是芽孢杆菌属(Bacillus)。16S rDNA序列分析显示,在醇化烟叶表面鉴定出多达42种细菌,其中以芽孢杆菌属、假单胞菌属(Pseudomonas)和噬菌弧菌属(Bacteriovorax)为主[1,4]。然而,对于烟叶醇化过程中微生物活性的研究报道较少。
烟碱是存在于烟草中的主要生物碱,对人体健康具有危害性[5]。因此,降低烟草制品和烟草废弃物中的烟碱已成为一个必需解决的问题。利用微生物来降解烟碱受到人们越来越多的关注。从烟叶表面和种植烟草的土壤中,人们已分离到了很多可以降解和利用烟碱的细菌,包括假单胞菌(Pseudomonas sp.)[6-7]、节杆菌(Arthrobacter sp.)[8-9]、 肠 杆 菌(Enterobacter cloacae)[10]、无 色 杆 菌(Achromobacter nicotinophagum)[11]、 纤 维 菌(Cellulomonas sp.)[12]、争论产碱菌(Alcaligenes paradoxus)[13]、中间苍白杆菌(Ochrobactrum intermedium)[14]、芽孢杆菌(Bacillus simplex)[15]、红 球菌(Rhodococcus sp.)[16]、剑 菌(Ensifer sp.strain N7)[17]、土壤杆菌(Agrobacterium sp.)[18]、申氏杆菌(Shinella sp.)[19]、不动杆菌(Acinetobacter sp.)和鞘氨醇单胞菌(Sphingomonas sp.)[20]。然而,关于醇化过程中烟叶表面微生物对于烟碱降解能力的报道却不多见,因此,从醇化烟叶表面分离和鉴定了具有降解烟碱活性的菌群和单菌,并分析了其降解特性。
1 材料和方法
1.1 材料、仪器和培养基
2009年河南产X2F等级烟叶(醇化6个月,上海烟草集团有限责任公司提供)。烟碱(纯度 >98%,洛阳天科生物工程公司)。
仪器:变性梯度凝胶电泳(DGGE),CBS电泳装置(美国CBS公司);紫外可见分光光度计(UV-1800型,上海美谱达仪器有限公司);MJ MiniTMThermal cycler PCR仪(美国Bio-RAD公司);HP6890型气相色谱/HP5975型质谱联用仪(美国Agilent公司);高效液相色谱(美国Waters公司)。
富集培养基(RM):5.57 g Na2HPO4,2.44 g KH2PO4,1g K2SO4,0.2 g MgCl2·6H2O,10 mL微量元素溶液(0.04 g MnCl2·4H2O,0.1 g FeCl3·6H2O,0.1 g CaCl2,用蒸馏水配制成100 mL),加蒸馏水到 1000 mL。培养基灭菌 20 min后,将经过孔径0.22 μm滤膜过滤后的烟碱加入,浓度为 1 g/L。分离培养基:富集培养基+15 g/L琼脂。
1.2 烟碱降解菌群和单个降解菌的分离
称取30 g醇化烟叶浸于 300 mL已灭菌的磷酸缓冲液(PBS)中,20℃摇床200 r/min振荡 2 h后,在超净工作台中用灭菌的尼龙筛(250目)和滤膜(Whatman GF/F)过滤,滤液在 6000 r/min转速下离心15 min,将离心所得细菌接种到 100 mL灭菌的富集培养基中,160 r/min,28℃摇床培养,不断传代得到烟碱降解菌群。
菌群传代30代后,将富集培养菌液稀释涂布在分离培养基上,30℃下培养 48 h后挑取单菌落,在分离培养基上划线纯化,获得单菌。
1.3 降解菌群组成分析与单菌鉴定
采用16S rDNA片段的PCR-DGGE技术进行菌群组成分析。参照Tillett和Neilan[21]的方法进行细菌DNA的提取,采用EZ-10 Spin Column(上海生工有限公司)进行DNA纯化。16S rDNA片段的PCR扩增采用一对通用引物341F(5’-CCT ACG GGA GGC AGC AG-3’)和518r(5’-ATT ACC GCG GCT GCT GG-3’)[22],其中引物341F的5’端连接着GC发夹结构(5’-CGC CCG CCG CGC GCG CGC GGG CGG GGC GGG GGC ACG GGG GG-3’)。PCR采用Touchdown程序:94℃预变性5 min;94℃ 1 min,65~55℃(每循环降低 0.5℃)1 min,72℃ 1 min,循环 21次;94℃ 1 min,55℃1min,72℃ 1 min,循环14次;最后 72℃延伸 20 min。用 2%琼脂糖电泳检测PCR产物。DGGE聚丙烯酰胺凝胶浓度为8%,TAE缓冲液(20 mmol/L Tris,10 mmol/L乙酸 ,0.5 mmol/L EDTA,pH8.3),变 性 胶 浓 度 梯 度 为45%~ 65%(100%变性剂为7 mol/L尿素和40%去离子甲酰胺的混合物),点样量为每孔 500 ng,60℃ 75 V电泳16 h,GelRedTM染料(美国Biotium公司)染色 30 min,用全自动多功能凝胶成像分析系统(720 BR-01503,美国BIO-RAD公司)拍照。切下凝胶上的条带,放到 1.5 mL离心管中捣碎,加入去离子水 30 μL,4℃过夜使DNA溶出,离心后取上清为模板,用上述同样的引物(其中,341F不含GC夹)和程序进行PCR扩增,PCR产物由ABI 3730XL DNA测序仪(上海生工有限公司)测序,测序结果提交到EMBL,序列号为HE797795-HE797802。
参照东秀珠等[23]的方法进行单菌菌落形态及生理生化分析。分子鉴定时,单菌DNA提取和纯化方法同上,16S rDNA片段的PCR扩增引物为细菌通用引物27F(5’-AGA GTT TGA TCC TGG CTC AG-3’)和 1492r(5’-TAC GGY TAC CTT GTT ACG ACT T-3’)。将用EZ-10 Spin Column纯化后的PCR产物连接到pGEM-T载体中(美国Promega公司)并导入感受态细胞进行克隆,再以阳性克隆子为模板,利用引物为T7(5’-GGC CGC GGG AAT TCG ATT-3’)和 SP6(5’-GCG AAT TCA CTA GTG ATT-3’)进行菌落 PCR,PCR产物由 ABI 3730XL DNA测序仪测序,所得序列提交到EMBL,序列号为HE797794。将测得序列和与其同源性高的序列用多重序列比对软件CLUSTAL X 1.83进行分析,并采用Mega 4.0构建系统发育树。
1.4 不同条件下降解菌的生长与烟碱的降解
菌群和单菌的培养液(OD600nm为0.8)接种到 100 mL RM培养基,采用160 r/min摇床培养,定时取样测定细胞生长和烟碱的降解,每实验重复3次。
培养温度:接种菌液为10 mL,烟碱浓度为1 g/L,温度分别为20,25,28,30和37 ℃。
培养基起始pH:接种菌液为 5 mL,起始pH分别为5,7,9和10,烟碱浓度为 1 g/L,30 ℃下培养。
烟碱起始浓度:接种菌液为 10 mL,烟碱初始浓度分别为 1,2,3和4 g/L,30℃下培养。
1.5 烟叶发酵
2.6 g烟叶浸于150 mL 0.05 mol/L的磷酸缓冲液(pH 7),灭菌后接种 10 mL 菌液(OD600nm为0.8),对照组加 10 mL无菌水,于 30℃下 160 r/min摇床培养,定时取样测定烟碱的降解量。
1.6 静息细胞对烟碱的降解和对烟叶中烟碱的降解
取对数生长后期菌液,4℃ 8000 r/min离心 10 min,收集到的细菌用磷酸缓冲液(100 mmol/L,pH7)洗涤3次,再用相同的缓冲液悬浮细胞,使其OD600nm为5.0,5 mL菌液分别接种至 100 mL 0.05 mol/L的pH7磷酸缓冲液(含 1 g/L烟碱)和 150 mL 0.05 mol/L的pH7磷酸缓冲液(含 2.6 g醇化的烟叶)中,30℃ 160 r/min摇床培养,定时取样测定其烟碱的降解量。
1.7 检测方法
不加入烟叶的培养基中烟碱含量检测方法[16]:取培养液,4℃10000 r/min离心 10 min,上清液用一定量的0.05 mol/L HCl稀释,以 0.05 mol/L HCl作对照,检测在258 nm处光吸收值,用分光光度法测定烟碱浓度。
加入烟叶的培养基中烟碱含量检测方法[24]:培养液经离心(12000 r/min,10 min,4℃)后,上清液经0.22 μm的滤膜过滤,用高效液相色谱仪(HPLC)测定烟碱浓度。HPLC色谱柱采用大连依利特Hypersil ODS-2(4.6 mm× 250 mm,5μm),流动相为甲醇与 0.1 mol/L KH2PO4(含三乙胺 0.015 mol/L,磷酸调pH 为4),其甲醇含量梯度为:前 5 min为 5%,5~10 min上升到10%,10~20 min为10%,20~25 min下降到 5%,流速1 mL/min,检测波长 254 nm,进样量 10 μL。
1.8 烟碱降解中间产物的分析
取对数生长后期菌液,4℃ 8000 r/min离心 10 min,收集上清液,加入等体积二氯甲烷萃取2 min,室温下静置使水相与二氯甲烷分层,移出二氯甲烷,重复萃取两次,合并萃取液用无水硫酸钠除水后用旋转蒸发仪浓缩,而后用氮气吹干,最后用二氯甲烷定容到1 mL,供GC/MS分析使用。气相色谱条件:色谱柱为DB-5MS毛细管柱(30 m×0.25 mm× 0.25 μm),进样口温度为280℃,柱温箱升温程序为 60℃(保持 2 min),以10℃/min升温到300℃(保持 30 min),分流比为10∶1,载气为氦气,流速 1.0 mL/min,进样量为 1 μL。质谱条件:电离化方式为EI,离子源能量为70 eV,离子源温度为230℃,扫描质量范围为 20~650 amu,采用美国NIST谱库检索。
2 结果与分析
2.1 降解烟碱菌群和单菌的分离
在分离烟碱降解菌群时,共进行了6次重复实验,均得到了能降解烟碱的菌群,这说明在醇化烟叶的表面存在能够降解和利用烟碱的菌群。对菌群Q6继续分析,并采用分离培养基分离降解烟碱的单菌,最后只得到了一株降解菌D1。
2.2 降解菌群的组成分析与单菌鉴定
在通过富集培养分离烟碱降解菌群过程中,利用PCR-DGGE技术分析菌群的组成变化见图1。从图1中可看出,在30代后菌群组成较为稳定。对DGGE图谱上的条带进行测序分析,主要条带的BLAST比对结果见表1。

图1 富集培养过程中烟碱降解菌群组成变化的DGGE分析Fig.1 DGGE profiles of the nicotine-degrading bacterial communities of 5-40 generations during enrichment
菌株D1的菌落形态观察:菌落呈乳白色,圆形隆起,边缘光滑整齐,色泽湿润光亮,生长过程中平板不变色。根据形态特征和生理生化特征(表2),菌株D1初步鉴定为根癌土壤杆菌(Agrobacterium tumefaciens)。16S rDNA序列分析表明,菌株D1与根癌土壤杆菌最相似(同源性>98%,如图2所示)。因此,菌株D1鉴定为根癌土壤杆菌,属于α-变形菌纲,与菌群Q6的B3条带所代表的菌为同一种菌。

表1 DGGE图中各条带序列的BLAST比对结果Tab.1 BLAST results of the DGGE bands
2.3 培养条件对降解菌生长和降解烟碱能力的影响
培养温度对菌群和单菌生长及降解烟碱能力的影响如图3所示,从20℃升高到30℃,菌群和单菌的生长加快和降解烟碱能力增强,而在30℃和37℃时,菌群和单菌的生长和降解烟碱的能力均相近。与D1相比,Q6在20℃表现出更快的降解速率,在 24 h和 36 h Q6对烟碱的降解率分别为13.0%和73.4%,而单菌在相同时间只降解了2.2%和43.6%。

表2 菌株D1的生理生化特性Tab.2 Biochemical and physiological characteristics of strain D1

图2 基于16S rDNA序列的菌株D1系统发育Fig.2 Phylogenetic analysis based on 16S rDNA sequences for strain D1
初始pH对菌群和单菌生长及降解能力的影响如图4所示,当pH为7时,菌群和单菌的生长最快、对烟碱的降解能力最强,分别达到94.5%和67.2%。当pH升高或者降低均会导致菌群和单菌生长减慢、对烟碱的降解能力减弱。菌群的生长和对烟碱的降解能力比单菌更快、更强,当pH为5,9和10时菌群的优势更为明显,在 36 h时菌群对烟碱的降解率分别为94.2%,84.4%和64.3%,而单菌的降解率分别为22.7%,16.6%和5.7%。
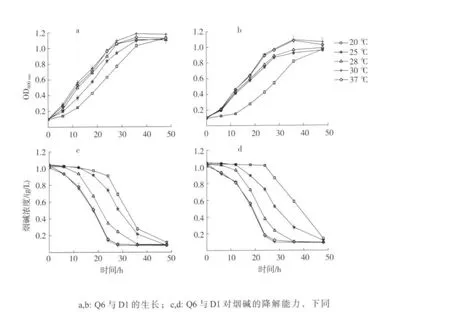
图3 温度对菌群Q6和单菌D1生长及降解烟碱能力的影响Fig.3 Effects of temperature on cell growth and nicotine degradation of bacterial community Q6 and single bacterial strain D1

图4 初始pH对菌群Q6和单菌D1生长及降解烟碱的影响Fig.4 Effects of initial pH on cell growth and nicotine degradation of bacterial community Q6 and single bacterial strain D1
烟碱起始浓度对菌群和单菌生长及降解能力的影响如图5所示,随着烟碱浓度的升高,菌群和单菌的生长和对烟碱降解均减慢,当烟碱初始浓度为 5 g/L时,菌群和单菌几乎不能再生长。当烟碱起始浓度为 2,3和 4 g/L时,菌群的生长和降解能力明显表现出比单菌更快。
2.4 烟叶发酵实验
如图6所示,菌群Q6在12 h内将烟碱降解完成,而此时单菌D1降解烟碱速率较慢,在12 h时只有72.5%的烟碱降解。
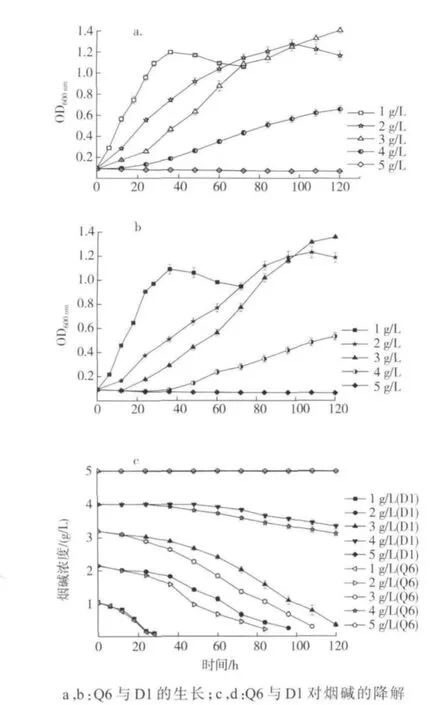
图5 初始烟碱浓度对菌群Q6和单菌D1生长及降解烟碱的影响Fig.5 Effects of initial nicotine concentration on cell growth and nicotine degradation of bacterial community Q6 and single bacterial strain D1
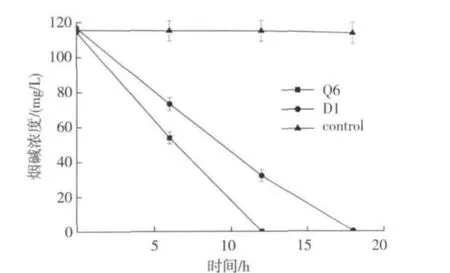
图6 菌群Q6与菌株D1对烟叶中烟碱的降解能力Fig.6 Nicotine degradation during fermentation of tobacco leaves by bacterial community Q6 and strain D1
2.5 静息细胞对烟碱的降解
如图7所示,在含烟碱的磷酸缓冲液(图7a)中,Q6和D1均能在 12 h内将 1 g/L的烟碱完全降解,Q6的降解速率比D1稍快。在加入烟叶的磷酸缓冲液(图7b)中,静息细胞在 3 h内能将浓度 112 mg/L的烟碱完全降解,菌群Q6仍表现出略快的降解速率。
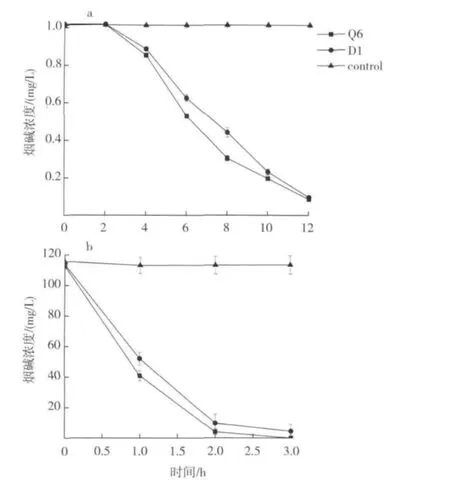
图7 菌群Q6与菌株D1的静息细胞对烟碱的降解能力Fig.7 Nicotine degraded by resting cells of bacterial community Q6 and strain D1
2.6 烟碱降解中间产物的分析
GC/MS分析显示,在菌群及单菌的培养液中均检测到烟碱烯(nicotyrine)、2,3’-联吡啶(2,3’-dipyridyl)和可替宁(cotinine),见图8。
3 结论与讨论
本试验分离到的菌群和单菌完全降解烟碱(初浓度 1 g/L)需要 28 h,而已报道的红球菌Y22降解同浓度烟碱需要 52 h[16],Ruan 等[9]分离到的节杆菌 HF-2 降解同浓度烟碱需要43 h,Hylin[25]分离的无色杆菌完全降解初浓度0.5 g/L的烟碱需要 56 h,鞘氨醇单胞菌HF-1可在 25 h完全降解初浓度1.3 g/L的烟碱[6]。这表明菌群Q6和单菌D1具有较好的烟碱降解活性。同时也发现菌种在-80℃保藏数月后仍具有同样的活性,说明菌种具有稳定的烟碱降解活性。
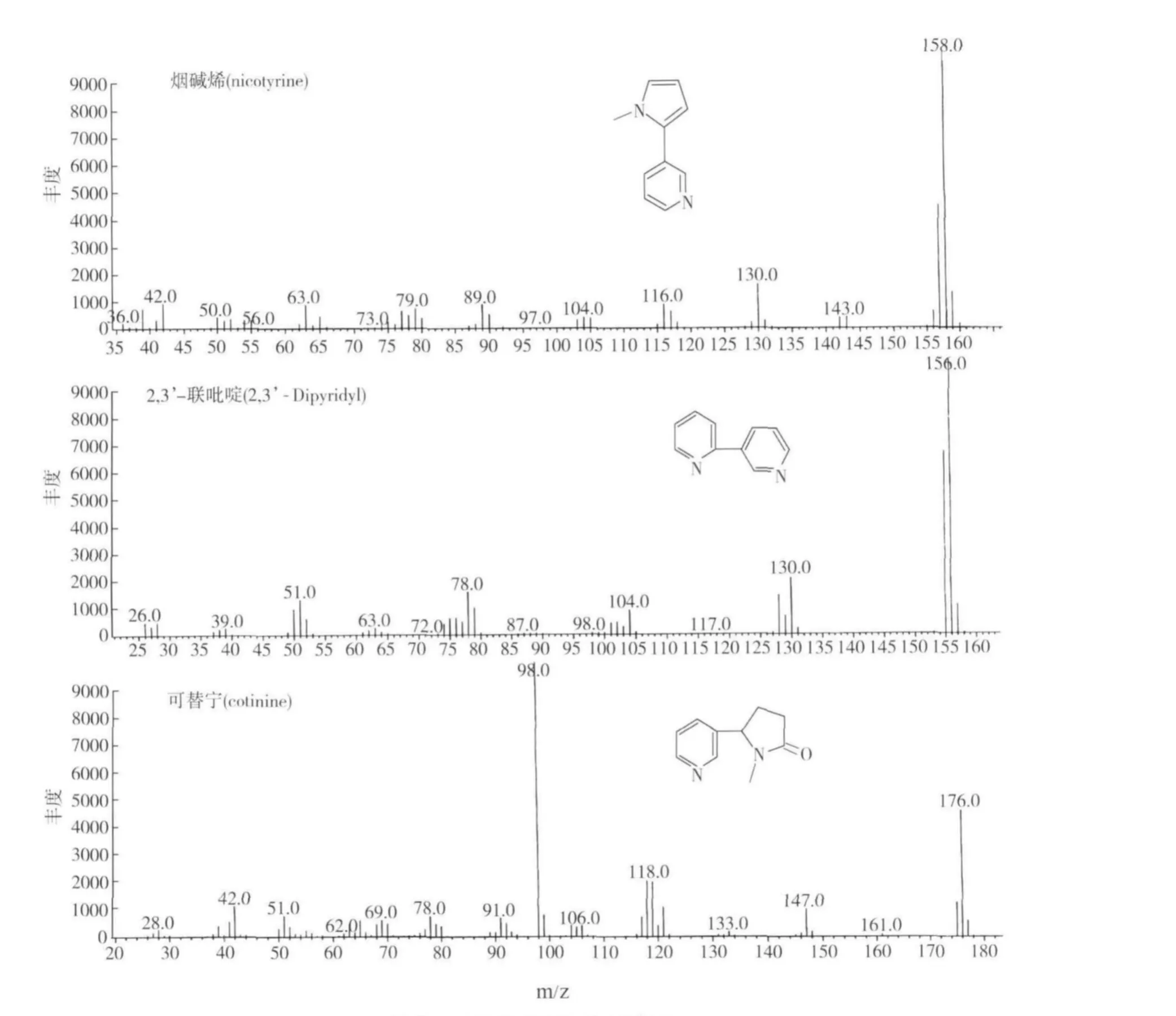
图8 烟碱代谢产物的质谱图Fig.8 Mass spectra of the nicotine’s metabolites
从DGGE分析的菌群组成来看,在富集过程中菌群中一直存在一个优势菌(条带B6)苍白杆菌,Yuan等[14]报道,苍白杆菌具有烟碱降解活性。条带B2为不动杆菌,Wang等[20]从烟草废弃物中分离到了具有烟碱降解活性的不动杆菌TW。显示条带B2和B6所对应的细菌可能也具有烟碱降解活性。Wang等[18]从种植烟草的土壤中分离到土壤杆菌S33,可在6 h内完全降解初浓度为1 g/L的烟碱,在烟碱初始浓度高于 3 g/L时,其培养液会产生由亮绿色到深棕色的颜色变化。与本试验分离到的根癌土壤杆菌D1相比,S33具有更好的降解活性。烟碱初始浓度高于3 g/L时,D1菌培养液没有出现类似于S33的颜色变化,说明D1和S33两种菌对烟碱的降解途径不同。
在低温(20℃)、偏酸或偏碱(pH=5或者pH≥ 9)及高烟碱浓度(>1 g/L)时,菌群Q6均表现出比单菌D1更强的降解活性,表明菌群Q6比单菌D1能适应更复杂的环境条件。静息细胞对烟碱具有降解能力,可直接利用培养好的细菌处理醇化烟叶或者处理含烟碱的废弃物。
烟碱的降解途径多样,本研究烟碱代谢产物分析中,检测到烟碱烯,2,3’-联吡啶和可替宁。在申氏杆菌(Shinella sp.)HZN1的烟碱降解产物中发现了烟碱烯和可替宁[19],在鞘氨醇单胞菌Nic22和鞘氨醇单胞菌ZUTSKD的烟碱降解产物中发现了2,3’-联吡啶和可替宁[7,26]。这表明本试验分离到的菌群和单菌可能与以上报道的细菌具有相似的烟碱降解途径。
本研究从醇化烟叶表面分离到了具有烟碱降解活性的菌群和单个细菌,菌群在低温(20℃)、偏酸或偏碱(pH=5或者pH≥ 9)及高烟碱浓度(>1 g/L)时,均表现出比单菌更强的降解活性。发酵试验以及加入静息细胞试验显示,菌群和单菌均能降解烟叶中的烟碱。醇化烟叶表面存在烟碱降解菌和降解菌群,在烟叶醇化过程中微生物可能会参与烟碱的降解,从而影响烟叶醇化效果,醇化过程中可以考虑利用烟碱降解菌群或单个细菌来更好地降解烟碱。另外,也可以考虑利用烟碱降解菌群和单菌来处理烟草工业生产过程中产生的含有烟碱的废弃物。因为菌群的降解效果优于单个细菌,并具有更强的环境适应能力,菌群可能具有更好的应用前景。
[1]Zhao M Q,Wang B X,Li F X,et al.Analysis of bacterial communities on aging flue-cured tobacco leaves by 16S rDNA PCR-DGGE technology[J].Appl Microbiol Biotechnol,2007,73:1435-1440.
[2]朱大恒,韩锦峰,张爱萍,等.自然醇化与人工发酵对烤烟化学成分变化的影响比较研究[J].烟草科技,1999(1):3-5.
[3]Reid J J,Haley E E.Studies on the fermentation of tobacco I:The microflora of cured and fermenting cigar-leaf tobacco[J].Pennsylvania Agricultural Experiment Station Bulletin,1933,356:1-17.
[4]Huang J W,Yang J K,Duan Y Q,et al.Bacterial diversities on unaged and aging flue-cured tobacco leaves estimated by 16S rRNA sequence analysis[J].Appl Microbiol Biotechnol,2010,88:553-562.
[5]Armstrong D W,Wang X D,Ercal N.Enantiomeric composition of nicotine in smokeless tobacco, medicinal products, and commercial reagents[J].Chirality,1998,10(7):587-591.
[6]Ruan A D,Ming H,Peng X H,et al.Isolation and characterization of Pseudomonas sp.strain HF-1,capable of degrading nicotine[J].Res Microbiol,2005,156:700-706.
[7]Chen C M,Li X M,Yang J K,et al.Isolation of nicotine-degrading bacterium Pseudomonas sp.Nic22,and its potential application in tobacco processing[J].Int Biodeter Biodegr,2008,62:226-231.
[8]Sguros P L.Microbial transformations of the tobacco alkaloids.I.Cultural and morphological characteristics of a nicotinophile[J].J Bacteriol,1955,69:28-37.
[9]Ruan A D,Min H,Zhu W.Studies on biodegradation of nicotine by Arthrobacter sp.strain HF-2[J].J Environ Sci Health B,2006,41:1159-1170v
[10]Ruiz G V.Degradacion de la nicotina porbacterias, 2:Enterobacter cloacae como degradador de nicotina[J].An INIA Ser Agric,1983,22:85-98.
[11]Hylin J W.The microbial degradation of nicotine.II.The mode of action of Achromobacter nicotinophagum[J].Arch Biochem Biophys,1959,83:528-537.
[12]Newton R P,Jewell J N,Geiss V L,et al.Tobacco with reduced nicotine content due to microbial treatment:US,4151848[P].1979-05-01.
[13]Uchida,Maeda,Masubuchi,et al.Isolation of nicotine-degrading bacteria and degradation of nicotine in shredded tobacco and tobacco extract[J].Sci Pap,1976,118:197-201.
[14]Yuan Y J,Lu Z X,Wu N L,et al.Isolation and preliminary characterization of a novel nicotine-degrading bacterium,Ochrobactrum intermedium DN2[J].Int Biodeter Biodegr,2005,56:45-50.
[15]Lei L P,Xia Z Y,Wang Y,et al.Isolation and characterization of nicotine-degrading bacterial strain L1[J].J Agri Biotech,2007,15:721-722.
[16]Gong X W,Yang J K,Duan Y Q,et al.Isolation and charac terization of Rhodococcus sp.Y22 and its potential application to tobacco processing[J].Res Microbiol,2009,160:200-204.
[17]Lei L P,Zhang W,Wei H L,et al.Characterization of a novel nicotine-degrading Ensifer sp.strain N7 isolated from tobacco rhizosphere[J].Ann Microbiol,2009,59:247-252.
[18]Wang S N,Liu Z,Xu P.Biodegradation of nicotine by a newly isolated Agrobacterium sp.strain S33[J].J Appl Microbiol,2009,107:838-847.
[19]Jiang H J,Ma Y,Qiu G J,et al.Biodegradation of nicotine by a novel strain Shinella sp.HZN1 isolated from activated sludge[J].J Environ Sci Health B,2011,46:703-708.
[20]Wang M Z,Yang G Q,Wang X,et al.Nicotine degradation by two novelbacterialisolates ofAcinetobactersp.TW and Sphingomonas sp.TY and their responses in the presence of neonicotinoid insecticides[J].World J Microbiol Biotechnol,2011,27:1633-1640.
[21]Tillett D,Neilan B A.Xanthogenate nucleic acid isolation from cultured and environmental cyanobacteria[J].J Phycol,2000,36:251-258.
[22]Muyzer G,De Waal E C,Uitterlinden A G.Profiling of complex microbial populations by denaturing gradient gel electrophoresis analysis of polymerase chain reaction-amplified genes coding for 16S rRNA[J].Appl Environ Microbiol, 1993,59:695-700.
[23]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[24]谢笑天,郑萍,朱伟明,等.高效液相色谱法测定卷烟烟气总粒相物中的烟碱[J].分析化学研究简报,2000,28(9):1085-1087.
[25]Hylin J W.Microbial degradation of nicotine:I.morphology and physiology of Achromobacter nicotinophagumn sp.[J].J Bacteriol,1958,76:36-40.
[26]Sun K D,Zhu C J,Zhong W H,et al.Isolation and characterization of a high nicotine-degrading bacterium,Pseudomonas sp.strain ZUTSKD[J].Acta Sci Circum,2008,28:1294-1301.
