弥漫性大B细胞淋巴瘤免疫球蛋白基因重排特点及规律研究
2012-09-13潘鑫艳黎贵芸杨丽琳杨举伦
潘鑫艳,王 丽,陈 玥,黎贵芸,杨丽琳,杨举伦
弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)是非霍奇金淋巴瘤(Non-Hodgkin's lymphomas,NHL)最常见的类型,占所有NHL的30% ~40%,呈中 -高度恶性。DLBCL的形态学分型由于主观性强、可重复性差,难以向临床提供有效、准确的治疗和预后信息[1]。免疫组化技术对区分DLBCL的免疫学表型有重要的价值[2],然而对于一些疑难病例,形态学和免疫组化也难以分辨。近年来随着分子生物学的发展,基因异常检测逐渐成为恶性淋巴瘤诊断的重要补充手段[3]。免疫球蛋白(Ig)基因重排是B淋巴细胞克隆的特异性标志[4-6],是目前较适合区分DLBCL免疫学表型的检测手段[7]。
2000年Alizadeh等[8]首先通过对基因表达谱结果分析,提出DLBCL可分为2型,即生发中心B细胞型(germinal center B-cell-like,GCB)和活化B细胞型(activated B-cell-like,ABC)。2004年 Hans等[9]以cDNA微阵列为参照对DLBCL进行亚分类,提出DLBCL分为GCB和非GCB(non-GCB)2种类型,二者的预后不同[10-14]。目前大多数文献只对其检测率进行探讨,本实验利用BIOMED-2克隆分析系统研究DLBCL中Ig基因重排规律,探讨GCB和non-GCB中Ig基因重排特点,以期为DLBCL的诊断及分型提供更为简捷的检测途径,同时为临床应用提供更为可靠的依据。
1 材料与方法
1.1 材料
1.1.1 组织样本:收集成都军区昆明总医院病理科2010年1月—2012年1月经10%中性福尔马林固定、石蜡包埋的46例手术切除的淋巴组织病变标本,全部标本均经2名有经验的病理医师结合形态学及免疫组化确认为DLBCL,以15例反应性增生病变作为阴性对照。
1.1.2 主要试剂:免疫组化试剂CD10、MUM1、Bcl-6购自Dako公司;QIAamp®DNA FFPE Tissue Kit购自德国QIAGEN公司;10×PCR buffer、rTaq DNA聚合酶购自TaKaRa公司;2.5 mmol/L dNTP Mixture、6×Loading buffer、50 bp Marker购自天根生化科技公司;BIOMED-2引物序列由上海生工生物工程技术服务有限公司合成。
1.2 方法
1.2.1 免疫组化方法:采用Envision法,以PBS代替一抗作为空白对照,>30%的肿瘤细胞染色阳性视为阳性病例。依据Hans等[9]方法对DLBCL进行免疫分型,GCB组:CD10(+)或CD10(-)时,Bcl-6(+),同时MUM1(-);non-GCB 组:CD10(-),若Bcl-6(+)则同时MUM1(+)。
1.2.2 石蜡样本基因组DNA提取:用75%乙醇擦拭刀片或使用新刀片以保证无交叉污染。视组织大小切8~10片,8 μm厚的石蜡切片置于1.5 ml灭菌离心管中,二甲苯脱蜡4次;无水乙醇重复3次去除二甲苯;37℃恒温器干燥组织。用DNA提取试剂盒提取石蜡组织基因组DNA,紫外分光光度计测量样品DNA的浓度、纯度,其OD260/OD280应介于1.7 ~2.0,OD260/OD230≥1.7,对样品不纯或浓度不足的样本重新提取DNA。
1.2.3 引物设计:选用了BIOMED-2引物系统中检测Ig基因克隆性重排的47条引物(表1)[15],这些引物组合后应用于检测重链(IGH)和轻链(IGκ和IGλ),其中IGH 分成5 组:IGH-A、B、C、D、E,用于检测VH-JH;IGκ分成2组,用于检测 Vκ-Jκ和 Vκκde,包括 IGκ-A、B;IGλ 用于检测 Vλ-Jλ。同时还包含了内对照S引物5条,其扩增产物片段长度分别为 100、200、300、400 和 600 bp。
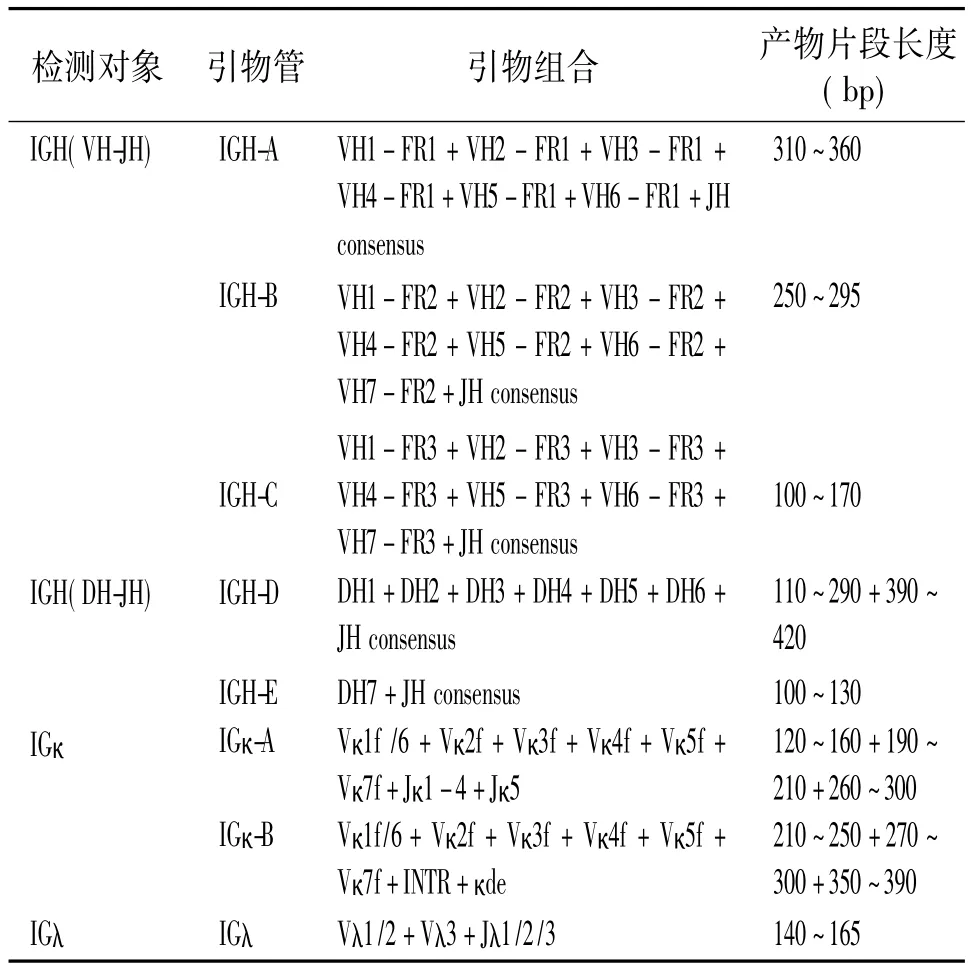
表1 BIOMED-2标准化的基因重排分析引物系统
1.2.4 PCR 扩增:采用 25 μl扩增体系:0.1 μmol/L引物,10 × PCR buffer,0.2 mmol/L dNTP Mixture,2 U rTaq DNA聚合酶。PCR反应条件为:94℃预变性,10 min;94℃,45 s;60℃,45 s;72℃,90 s;循环40次,最后72℃延伸10 min,4℃保存。
1.2.5 异源双链核酸分子分析及聚丙烯酰胺电泳检测:PCR 产物置于95℃、5 min,4℃、1 h,使其快速随机复性,形成异源双链核酸分子。取上述异源双链核酸分子7 μl进行8%聚丙烯酰胺凝胶电泳,以50 bp Marker为分子量标准对照,0.5×TBE电泳缓冲液,电压80 V、电泳10 min;而后电压110 V、电泳1.0 ~1.5 h;EB 染色 5 min,紫外凝胶成像仪下观察。
1.3 统计学处理 应用SPSS 11.0软件进行统计学处理,其中重(轻)链阳性率比较时,若该例标本中同时扩增出几种重(轻)链反应管的阳性条带,则只统计为1例;而在统计每个反应管的阳性率时,若该例标本中扩增出几种重(轻)链反应管阳性条带就统计为几例。所有数据均采用χ2检验,α=0.05为检验水准。
2 结果
2.1 免疫组化分型 采用CD10、MUM1、Bcl-6 3种抗体染色对DLBCL进行蛋白水平分子分型[9],将本实验选取的46例DLBCL划分成 GCB 12例,non-GCB 34例。
2.2 DLBCL的Ig基因重排 46例DLBCL经Ig基因重排分析显示,除1例样本因提取的基因组DNA降解严重导致实验失败外,其余的45例样本均扩增出Ig克隆性重排条带(图1),利用BIOMED-2引物系统对DLBCL的检测敏感性为97.8%(45/46);15例反应性增生病例中未出现Ig基因的克隆性重排,检测特异性为100.0%(15/15)。46例样本中IGH克隆性重排的阳性例数为42例(91.3%);IGκ克隆性重排的阳性例数为38例(82.6%),IGλ克隆性重排的阳性例数为17例(37.0%);重排条带主要集中于检测重链的IGH-A、IGH-C反应管以及检测轻链的 IGκ-A、IGκ-B 反应管(表2)。

表2 弥漫性大B细胞淋巴瘤Ig基因重排检测结果(n=46)
2.3 GCB和non-GCBIg基因重排比较 GCB和non-GCB重链IGH基因重排阳性率分别为91.6%(11/12)和 94.1%(32/34),差异无统计学意义(P>0.05)。而轻链基因重排阳性率分别为58.3%(7/12)和91.2%(31/34),差异有统计学意义(P<0.05),见表3。

表3 弥漫性大B细胞淋巴瘤GCB和non-GCBIg基因重排检测结果

图1 弥漫性大B细胞淋巴瘤部分样品Ig基因重排经聚丙烯酰胺凝胶电泳检测结果
3 讨论
DLBCL是一组临床表现、组织形态、免疫表型、生物学行为及预后等方面具有很大异质性的大B淋巴细胞来源的肿瘤,其病理诊断是病理工作中的难点。一些DLBCL的鉴别、诊断、分型仅依靠形态学和免疫组化难以实现,病理医师往往难以作出肯定的判断,甚至误诊,受体基因重排的克隆性分析技术为解决这一问题提供了一条途径。20世纪80年代末,分子生物学和分子细胞遗传特征已成为DLBCL诊断和研究中不可缺少的部分[16]。近年来,PCR技术用于检测Ig基因重排在DLBCL诊断与鉴别诊断中的作用获得了肯定[17]。
Ig基因克隆性重排主要集中在重链可变区V基因,IGH之所以成为克隆性检测的首选目标,主要原因是由于大多数B细胞肿瘤均会发生IGH基因重排。因此,多年来研究者依据IGH基因来进行克隆性检测,而在应用IGκ和IGλ方面,临床实践和研究均不多。但是理论和已经发表的一些研究成果表明,对轻链的研究在一定程度上能够提高克隆性重排检出率[18]。以往研究显示 B细胞淋巴瘤IGH基因重排的阳性检出率为50% ~85%[16,19-20]。BIOMED-2方案是2003年由欧共体7国47个研究机构研究建立的多重PCR引物系统[21],该方案引入对IGκ和IGλ两条轻链的检测后,特别是IGκ包括了 Vκ-Jκ(IGκ-A)和 κde(IGκ-B)片段的检测;而且κde重排方式也不受体细胞高突变的影响[22-23],进一步提高了对成熟B细胞性淋巴瘤的检出率(95% ~100%)[18,24-26]。因此,在对 B 细胞淋巴瘤的基因重排检测中对轻链的检测也显得尤为重要。
本研究利用BIOMED-2引物系统对46例DLBCL进行了 Ig基因重排检测,检出率达到97.8%,检测特异性为 100.0%,与文献报道一致[25]。46例DLBCL样本中 IGH克隆性重排的阳性检出率为91.3%;IGκ克隆性重排的阳性检出率为82.6%,其中IGκ-A克隆性重排的阳性检出率为56.5%,高于文献报道的 29.2%[27];IGκ-B 克隆性重排的阳性检出率为26.1%,与文献报道的25.0%一致[27]。IGλ克隆性重排的阳性检出率为37.0%。结果显示IGH克隆性重排的阳性检出率最高,IGκ次之,IGλ最低。
2008年WHO将DLBCL进行免疫学分型,分为GCB和non-GCB 2种类型[28]。这2种分子类型的DLBCL患者预后差别显著,5年生存率分别为70%和12%,non-GCB组比GCB组低,若对DLBCL患者早期诊断、根据分型予强力化疗,近半数可获得缓解[29]。因此,早期诊断、治疗对提高DLBCL患者的生存率意义重大。本研究讨论了DLBCL GCB和non-GCB中,Ig基因重链(IGH)和轻链(IGκ和IGλ)的重排规律和特点,力求找到一种更为简捷、准确的检测途径。研究结果显示,GCB和non-GCB的重链IGH基因重排差异无统计学意义,而轻链重排条带分布具有显著的特点和规律:GCB的IGκ-B克隆性重排的阳性检出率明显高于non-GCB型,IGκ-A、IGλ克隆性重排的阳性检出率明显低于non-GCB型。蒋会勇等[30]利用半巢式PCR对GCB进行了IGH基因重排相关性检测,结果显示IGH基因重排的检测可协助确定部分GCB的DLBCL。然而通过本研究发现,轻链基因的重排检测也可以协助DLBCL分型。
目前,大多数文献通过免疫组化对non-GCB和GCB预后进行研究表明,前者预后比后者差,而Ig基因重排与其预后关系的研究甚为少见[10,29,31-34]。本文发现GCB和non-GCB中轻链重排条带差异有统计学意义,该现象与其预后是否关联,尚需进一步验证。对于一些疑难病例,特别是早期和微量标本,基因诊断尤有独到之处,但当基因重排检测与病理组织学及免疫组化结果有冲突的时候,务必将3种检查结合起来综合分析[35-37]。
[1]A clinical evaluation of the International Lymphoma Study Group classification of non-Hodgkin's lymphoma.The Non-Hodgkin's Lymphoma Classification Project[J].Blood,1997,89(11):3909-3918.
[2]郑颂国,陆孝禹,张容轩,等.恶性B淋巴细胞性淋巴瘤克隆性重排检测研究[J].肿瘤,1999,19(5):285-288.
[3]陈愉,赵彤,韩西群,等.弥漫性大B细胞淋巴瘤克隆性基因重排检测研究[J].东南国防医药,2006,8(5):336-337,345.
[4]Braunschweig R,Baur A S,Delacretaz F,et al.Contribution of IgH-PCR to the evaluation of B-cell lymphoma involvement in paraffin-embedded bone marrow biopsy specimens[J].Am J Clin Pathol,2003,119(5):634-642.
[5]Theriault C,Galoin S,Valmary S,et al.PCR analysis of immunoglobulin heavy chain(IgH)and TcR-gamma chain gene rearrangements in the diagnosis of lymphoproliferative disorders:results of a study of 525 cases[J].Mod Pathol,2000,13(12):1269-1279.
[6]陈云昭,李锋,胡文浩,等.石蜡包埋B细胞性恶性淋巴瘤组织克隆性免疫球蛋白重链基因重排检测研究[J].肿瘤学杂志,2005,11(3):176-178.
[7]易基群,林桐榆,何友兼.荧光定量PCR分析弥漫大B细胞淋巴瘤免疫球蛋白重链基因重排表达[J].中国癌症杂志,2007,17(8):619-623.
[8]Alizadeh A A,Eisen M B,Davis R E,et al.Distinct types of diffuse large B-cell lymphoma identified by gene expression profiling[J].Nature,2000,403(6769):503-511.
[9]Hans C P,Weisenburger D D,Greiner T C,et al.Confirmation of the molecular classification of diffuse large B-cell lymphoma by immunohistochemistry using a tissue microarray[J].Blood,2004,103(1):275-282.
[10]彭晚娇,姚丽青,郑智勇.淋巴结外弥漫大B细胞淋巴瘤分子分型的病理学研究[J].实用癌症杂志,2010,25(1):59-61.
[11]Wright G,Tan B,Rosenwald A,et al.A gene expression-based method to diagnose clinically distinct subgroups of diffuse large B cell lymphoma[J].Proc Natl Acad Sci USA,2003,100(17):9991-9996.
[12]Rosenwald A,Wright G,Chan W C,et al.The use of molecular profiling to predict survival after chemotherapy for diffuse large-B-cell lymphoma[J].N Engl J Med,2002,346(25):1937-1947.
[13]Monti S,Savage K J,Kutok J L,et al.Molecular profiling of diffuse large B-cell lymphoma identifies robust subtypes including one characterized by host inflammatory response[J].Blood,2005,105(5):1851-1861.
[14]虞海荣,孙振柱.免疫学分型在判定弥漫性大B细胞淋巴瘤预后中的临床意义[J].新疆医科大学学报,2008,31(5):559-560,563.
[15]van Dongen J J,Langerak A W,Bruggemann M,et al.Design and standardization of PCR primers and protocols for detection of clonal immunoglobulin and T-cell receptor gene recombinations in suspect lymphoproliferations:report of the BIOMED-2 Concerted Action BMH4-CT98-3936[J].Leukemia,2003,17(12):2257-2317.
[16]许良中,邱柄森,许越香.现代恶性淋巴瘤病理学[M].上海:科学技术文献出版社,2002:150.
[17]Igarashi T,Itoh K,Kobayashi Y,et al.PhaseⅡ and pharmaco kinetics study of rituximab with eight weekly infusions in relapsed aggressive B-cell non-Hodgkins lymphoma[J].Proc Am Soc Clin Oncol,2002,21:286a.
[18]陈玥,王丽,潘鑫艳,等.Ig基因重排检测在B细胞性淋巴瘤诊断中的应用[J].诊断病理学杂志,2011,18(3):186-189.
[19]Gurbity T P,Bagdi E,Groen N A,et al.Increased sensitivity of B-cell clonality analysis in formalin-fixed and paraffin-embedded B-cell lymphoma samples using an enzyme blend with both 5'— >3'DNA polymerase and 3'—>5'exonuclease activity[J].Virchows Arch,2003,443(5):643-648.
[20]Lombardo J F,Hwang T S,Maiese R L,et al.Optimal primer selection for clonality assessment by polymerase chain reaction analysis.Ⅲ.Intermediate and high-grade B-cell neoplasms[J].Hum Pathol,1996,27(4):373-380.
[21]Sandberg Y,van Gastel Mol E J,Verhaaf B,et al.BIOMED-2 multiplex immunoglobulin/T-cell receptor polymerase chain reaction protocols can reliably replace Southern blot analysis in routine clonality diagnostics[J].J Mol Diagn,2005,7(4):495-503.
[22]van der Burg M,Tumkaya T,Boerma M,et al.Ordered recombination of immunoglobulin light chain genes occurs at the IGK locus but seems less strict at the IGL locus[J].Blood,2001,97(4):1001-1008.
[23]van Zelm M C,van der Burg M,de Ridder D,et al.Ig gene rearrangement steps are initiated in early human precursor B cell subsets and correlate with specific transcription factor expression[J].J Immunol,2005,175(9):5912-5922.
[24]王丽,陈玥,潘鑫艳,等.Ig/TCR基因重排分析联合EBER原位杂交检测在原发性胃肠道淋巴瘤诊断中的应用[J].临床与实验病理学杂志,2011,27(6):580-585.
[25]张婧,吴迎辉,孔海鹰,等.BIOMED-2聚合酶链反应Ig基因重排对成熟非霍奇金B细胞淋巴瘤诊断的价值[J].中华病理学杂志,2009,38(11):739-744.
[26]Payne K,Wright P,Grant J W,et al.BIOMED-2 PCR assays for IGK gene rearrangements are essential for B-cell clonality analysis in follicular lymphoma[J].Br J Haematol,2011,155(1):84-92.
[27]李洁.B细胞恶性肿瘤免疫球蛋白基因重排的相关研究及临床意义[C].广州:南方医科大学,2008.
[28]Swerdlow S H,Campo E,Harris N L,et al.WHO classifi-cation of tumours of haematopoietic and lymphoid tissues[EB/OL].4 th ed.Lyon:International Agency for Research on Cancer,[2008-04-02].http://apps.who.int/booko-rders/anglais/detart1.jsp? sesslan =1&codlan=1&codcol=70&codcch=04002
[29]李亮,郝云良,崔文,等.弥漫性大B细胞淋巴瘤免疫学亚型的研究[J].济宁医学院学报,2010,33(2):114-116.
[30]蒋会勇,陈愉,张三泉,等.弥漫大B细胞淋巴瘤bcl-2/IgH基因重排与GCB分子亚型的相关性[J].第四军医大学学报,2006,27(5):420-423.
[31]宋恩霖,熊小亮,艾有生,等.Ki-67在GCB及non-GCB弥漫性大B细胞淋巴瘤中的表达及意义[J].江西医药,2010,46(2):111-113.
[32]李娟,徐刚.弥漫性大B细胞淋巴瘤分型研究进展[J].实用医院临床杂志,2007,4(6):42-44.
[33]叶子茵,曹亚兵,林桐榆,等.弥漫大B细胞淋巴瘤免疫表型分型与预后的关系[J].中华病理学杂志,2007,36(10):654-659.
[34]曹永峰,魏金芝,宋诸臣,等.弥漫性大B细胞淋巴瘤116例免疫亚型研究[J].南通大学学报:医学版,2011,31(3):228-229.
[35]杨华,刘小丽,刘华庆.弥漫性大B细胞淋巴瘤临床病理分析[J].遵义医学院学报,2008,31(5):479-482.
[36]陆俐丽,林贤东,郑天荣,等.B细胞淋巴瘤IgH基因重排的检测及临床应用[J].福建医药杂志,2007,29(6):77-79.
[37]陶琨,朱雄增,徐薇苓,等.弥漫性大B细胞淋巴瘤的临床病理和免疫组织化学特征[J].中华病理学杂志,2002,31(2):112-115.
