注射用泮托拉唑钠与注射用头孢唑肟钠配伍稳定性考察
2012-09-13朱雪松钟基大王启斌
朱雪松,钟基大,王启斌,郑 芳*
注射用泮托拉唑钠与注射用头孢唑肟钠配伍稳定性考察
朱雪松1a,钟基大1b,王启斌2,郑 芳1a*
目的 考察室温[(20±1)℃]下,注射用泮托拉唑钠与注射用头孢唑肟钠在0.9%氯化钠注射液中的配伍稳定性。方法 将泮托拉唑钠与头孢唑肟钠配伍后,在0~6 h内观察配伍液的外观变化,测定pH值,采用反相高效液相色谱法-二极管阵列检测器同时测定泮托拉唑钠与头孢唑肟钠配伍后的含量变化。结果6 h内混合液外观无明显变化,pH值及含量变化明显。结论 在室温[(20±1)℃]下6 h内,注射用泮托拉唑钠与注射用头孢唑肟钠在0.9%氯化钠注射液中配伍不稳定。
高效液相色谱法-二极管阵列检测器;泮托拉唑钠;头孢唑肟钠;配伍;稳定性
Key words:HPLC-DAD;Pantoprazole;Ceftizoxime sodium;Compatibility;Stability
泮托拉唑(Pantoprazole)为苯并咪唑衍生物,是新一代的质子泵抑制剂。本品可以降低胃酸基础水平,减少餐后胃酸分泌[1]。临床一般用于治疗胃及十二指肠溃疡、胃-食道反流性疾病及卓-艾综合征,抑酸效果明显[2]。头孢唑肟钠是第三代头孢菌素类抗生素,对部分革兰阳性菌及多数革兰阴性菌都有很强的杀菌能力,临床广泛用于治疗肾盂肾炎、输尿管炎、支气管炎、慢性呼吸系统疾病的继发感染等[3]。临床上各种术后常使用头孢唑肟钠预防和治疗敏感菌导致的各种感染,同时使用泮托拉唑预防应激性溃疡;存在各种溃疡引起的急性上消化道出血时,使用头孢唑肟钠预防和治疗细菌感染,二者经常共同使用。目前,泮托拉唑钠与其他药物配伍的报道较少,且未发现有关注射用泮托拉唑钠与注射用头孢唑肟钠配伍稳定性的报道。本文参考有关文献[4-5],从外观、pH值和含量变化的角度考察室温、不避光条件下,注射用泮托拉唑钠与注射用头孢唑肟钠在0.9%氯化钠注射液中的配伍稳定性。
1 仪器与试剂
1.1 仪器 戴安Ultimate3000高效液相色谱仪(Ultimate3000泵,Ultimate3000二极管阵列检测器,四元低压混合系统,chromeleon工作站);HS-2060超声仪;pHs-3C型酸度计(上海蓝凯仪器仪表有限公司);岛津AEU-210电子天平。
1.2 药品与试剂 泮托拉唑对照品(中国药品生物制品检定所,批号:100575-200602),注射用泮托拉唑钠(韦迪,扬子江药业集团有限公司,40 mg/瓶,批号:10092002),头孢唑肟对照品(中国药品生物制品检定所,批号:130504-200702),注射用头孢唑肟钠(深圳致君制药有限公司,批号: C20101106,规格:0.5 g/支),0.9%氯化钠注射液(四川科伦制药有限公司,2.25 g∶250 mL,批号: A101218F1);乙腈为色谱纯,水为新制注射用水,其他试剂均为分析纯。
2 方法与结果
2.1 溶液配制 ①对照品溶液:分别精密称取泮托拉唑与头孢唑肟对照品适量,用流动相组分缓冲液稀释,配制成浓度分别为 0.084、1.980 mg/mL的泮托拉唑、头孢唑肟对照品储备液;将上述两种对照品储备液用注射用水分别稀释10倍,得各自对照品溶液。②配伍溶液:取注射用泮托拉唑钠1瓶(40 mg/瓶)与头孢唑肟钠2瓶(0.5 g/瓶),溶于100 mL 0.9%氯化钠注射液中,摇匀,即得。③样品溶液:取注射用泮托拉唑钠1瓶(40 mg/瓶)溶于100 mL 0.9%氯化钠注射液中,摇匀,即得泮托拉唑样品溶液;头孢唑肟钠2瓶(0.5 g/瓶),溶于100 mL 0.9%氯化钠注射液中,摇匀,即得头孢唑肟样品溶液。
2.2 测定波长的选择 取“2.1”项下泮托拉唑、头孢唑肟对照品溶液,在“2.3.1”项色谱条件下,分别进样,由二极管阵列检测器在200~400 nm波长范围内的扫描图谱得知,泮托拉唑在293 nm有次最大吸收,而在此波长处,头孢唑肟也有很大吸收,因此,选择293 nm作为该检测波长。
2.3 含量测定方法
2.3.1 色谱条件 色谱柱:Agilent HC-C18(150 mm×4.6 mm,5 μm);流动相:乙腈-缓冲液(磷酸二氢钾4.8 g与磷酸氢二钾0.8 g混合,用水稀释至1 000 mL制成缓冲液,其中缓冲盐类均为分析纯),流动相采用梯度洗脱(见表1);流速: 1.0 mL/min;柱温:25℃;进样量:20 μL;检测波长:293 nm。

表1 梯度洗脱程序
2.3.2 系统适应性试验 在“2.3.1”项色谱条件下,分别进样缓冲液(空白溶液)、“2.1”项下对照品溶液、以缓冲液稀释了50倍的配伍溶液。记录色谱图(见图1)。理论塔板数按泮托拉唑和头孢唑肟峰计均不低于10 000,各峰之间的分离度不低于3.0,二主峰DAD匹配值均不低于999.95,说明二主峰均为纯峰,分离良好。

图1 高效液相色谱图
2.3.3 标准曲线的建立 精密量取“2.1”项下泮托拉唑对照品储备液 0.5、1.0、2.0、3.0、4.0、5.0 mL至10 mL容量瓶中,用缓冲液稀释至刻度,摇匀。在“2.3.1”项色谱条件下进样分析。以峰面积(Y)为纵坐标、质量浓度(X)为横坐标绘制标准曲线,得泮托拉唑回归方程:Y泮=660.12 X泮+ 0.179 5,r=0.999 7(n=6),线性范围:4.2~42.0 μg/mL。同上法精密量取“2.1”项下头孢唑肟对照品储备液0.5、1.0、2.0、3.0、4.0、5.0 mL至10 mL容量瓶中,用缓冲液稀释至刻度,摇匀。在“2.3.1”项色谱条件下进样分析。以峰面积(Y)为纵坐标、质量浓度(X)为横坐标绘制标准曲线,得头孢唑肟回归方程:Y头=301.6 X头+2.495,r= 0.999 4(n=6),线性范围:99.0~990.0 μg/mL。
2.3.4 精密度试验 在“2.3.1”项色谱条件下,分别进样“2.1”项下泮托拉唑和头孢唑肟对照品溶液20 μL;重复进样6次。测得泮托拉唑峰面积RSD=0.47%(n=6),头孢唑肟峰面积RSD= 0.45%(n=6)。
2.3.5 重复性试验 取同一批样品,按“2.1”项下样品溶液配制方法各平行制备泮托拉唑、头孢唑肟样品溶液各6份,用缓冲液稀释50倍后,分别进样,记录峰面积,测得泮托拉唑峰面积RSD为0.98%(n=6),头孢唑肟峰面积RSD为0.89% (n=6)。
2.3.6 加样回收率试验 精密吸取“2.1”项下已知含量的泮托拉唑样品溶液1.0 mL,分置9个50 mL量瓶中,分别精密加入泮托拉唑对照品储备液4.0、5.0、6.0 mL各3份,分置上述量瓶中,用缓冲液稀释至刻度,摇匀;同法操作头孢唑肟样品溶液。再以“2.3.1”项下方法测定峰面积,代入回归方程计算质量浓度(X),并计算回收率,结果见表2。
2.4 配伍稳定性试验
2.4.1 外观、pH值变化 取“2.1”项下配伍溶液适量,于室温、不避光条件下,分别于0、1、2、4、6、8 h用纳氏比色管观察颜色变化并测定pH值,结果配伍液无肉眼可见的变化发生,颜色均无色澄明。见表3。
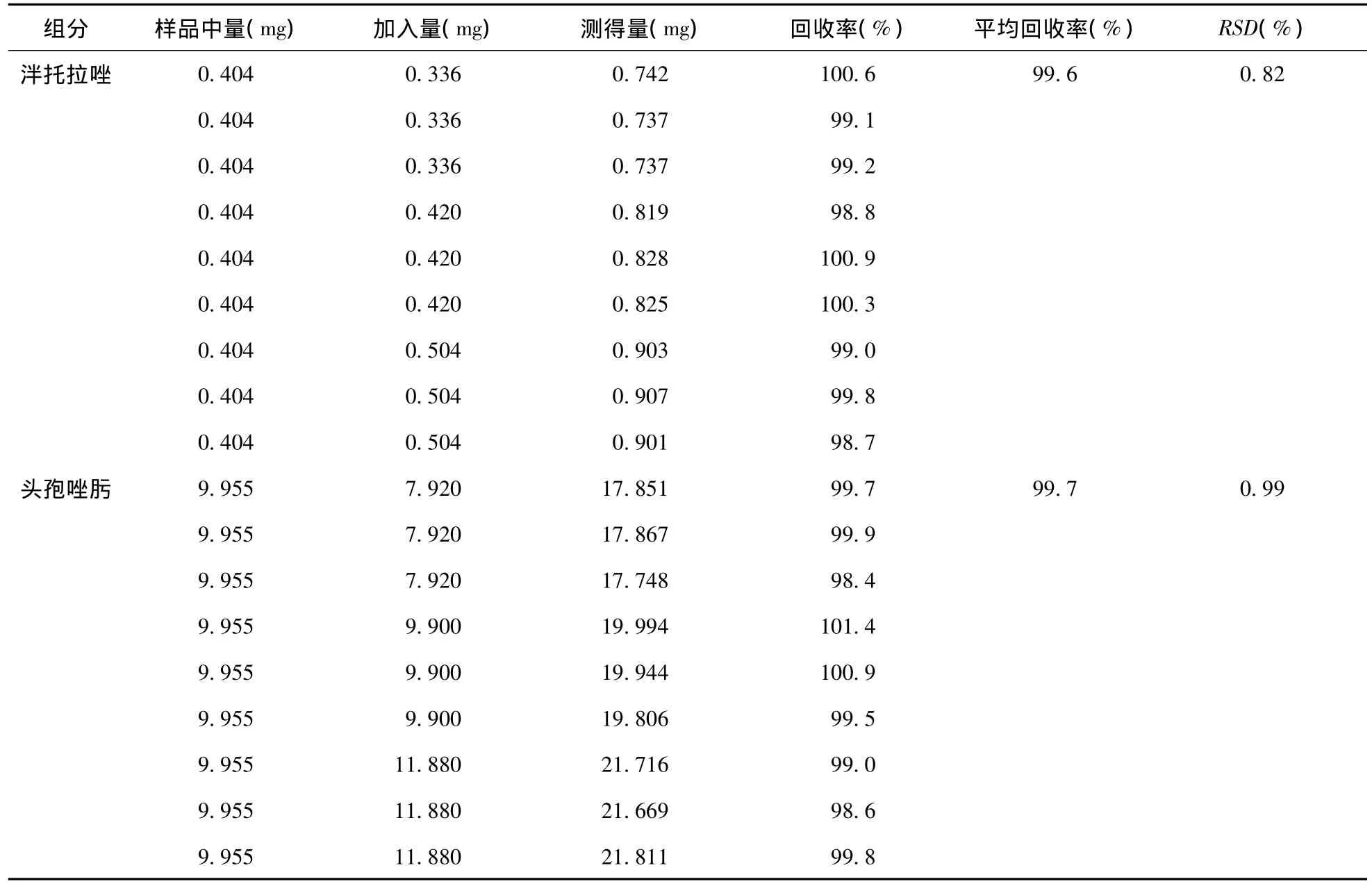
表2 加样回收率试验结果(n=9)
2.4.2 相对百分含量变化 取“2.1”项下配伍溶液适量,于室温、不避光条件下,分别于0、1、2、4、6、8 h取样适量,用缓冲液稀释50倍后立即进样,以“2.3.1”项下色谱条件测定峰面积,以配伍0 h含量为100%计算药物含量变化。见表3。

表3 配伍液中泮托拉唑与头孢唑肟的含量及pH值测定(%)
3 配伍稳定性试验结果
在室温下8 h内,注射用泮托拉唑钠与注射用头孢唑肟钠在0.9%氯化钠注射液中配伍,配伍液无肉眼可见的变化发生,颜色均无色澄明,但配伍液的pH值及泮托拉唑的含量发生了较大的变化。从临床安全用药的角度,建议二者不宜配伍使用。
4 讨论
由表3可见,配伍液的pH值随着时间推移逐步下降,配伍液中头孢唑肟的含量未发生变化,而泮托拉唑的含量随着时间推移逐步下降,与pH值下降同步。因此,推测该配伍溶液不稳定是由于泮托拉唑降解。注射用泮托拉唑钠为强碱性化合物,碱性条件下制剂才稳定,泮托拉唑注射液的pH值一般为9.0。笔者单独测得注射用泮托拉唑钠的pH值及含量均稳定。因此,泮托拉唑在有头孢唑肟钠存在的情况下易发生降解,亦可以证明头孢唑肟钠能够加快泮托拉唑钠的降解。由于该配伍溶液pH值在0 h时为8.81,8 h时为8.1,说明泮托拉唑钠的降解可以使溶液的pH值下降。
由于在室温下8 h内,注射用泮托拉唑钠与注射用头孢唑肟钠在0.9%氯化钠注射液中配伍,配伍液无肉眼可见的变化发生,颜色均无色澄明,说明降解产物是无色的,但降解产物具体结构仍需要进一步研究。
[1] 李静.质子泵抑制剂-泮托拉唑[J].中国药学杂志,2001,36 (10):310-311.
[2] 陈新谦,金有豫,汤光.新编药物学[M].第16版.北京:人民卫生出版社,2007:468.
[3] 于和,陈双璐,林澜,等.HPLC法测定注射用头孢唑肟钠中主药的含量[J].中国药房,2007,18(25):1981-1982.
[4] 寿张轩,金雩.注射用卡络磺钠与泮托拉唑钠在果糖注射液中的稳定性[J].中国医院药学杂志,2007,27(3):396-397.
[5] 张相彩,吕小琴.注射用泮托拉唑钠与3种常用注射液的配伍稳定性考察[J].中国药师,2009,12(3):331-333.
Compatability of pantoprazole sodium for injection and ceftizoxime sodium for in-for osteoporosis
ZHU Xue-song1a,ZHONG Ji-da1b,WANG Qi-bin2,ZHENG Fang1a*(1.a.Department of Pharmacy,b.Department of Infectious Disease,Dongfeng General Hospital,Hubei University of Medicine,Shiyan 442008,China; 2.Department of Pharmacy,Taihe Hospital,Hubei University of Medicine,Shiyan 442008,China)
Objective To study the stability of pantoprazole sodium for injection mixed with ceftizoxime sodium for injection in 0.9%sodium chloride injection at home temperature[(20±1)℃].Methods The contents of pantoprazole and ceftizoxime sodium were determined simultaneously by HPLC-DAD,and the appearance,pH value were observed within 6 h.Results No significant change was observed in appearance,but the contents and pH value changed markedly within 6 h.Conclusion Pantoprazole sodium for injection and ceftizoxime sodium for injection cannot be mixed in 0.9%sodium chloride injection at home temperature[(20±1)℃]within 6 h.
2012-01-12
1.湖北医药学院附属东风医院a.药学部,b.感染科,湖北十堰442008;2.湖北医药学院附属太和医院药学部,湖北十堰442008
*通讯作者
