应用聚偏氟乙烯-丝氨酸进行血液灌流治疗脓毒症的实验研究
2012-09-13周焕玉张媛媛
李 宁 周焕玉 张媛媛 周 岩 徐 放
河北大学附属医院重症医学科,河北保定 071000
内毒素血症是造成脓毒症的一个重要原因,血液中的内毒素(lipopolysaccharides,LPS)促使补体活化和肿瘤坏死因子 α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)等多种促炎介质释放,后者导致严重的外周血管阻力降低,低血压和微循环障碍最终发展为组织缺血缺氧、休克和多器官功能衰竭[1]。笔者前期的动物实验证实,应用聚偏氟乙烯-丝氨酸(PVDF-Ser)进行血液灌流,可有效清除脓毒症猪的血浆LPS,降低TNF-α和白细胞介素-6(interleukin-6,IL-6),最终降低72 h死亡率[2]。本研究旨在进一步证实其对感染性休克的血流动力学影响。
1 材料与方法
1.1 实验材料
1.1.1 实验动物及分组 大长种家猪16只,雄性,体重(22.3±3.5)kg,由河北大学动物实验中心提供。依据随机数字表分为两组:PVDF-Ser组(E 组)8 只,LPS 给药完成后 1 h,应用PVDF-Ser吸附膜进行血液灌流2 h,血流速50 mL/min;对照组(C组)8只,应用空白灌流器(容积与PVDF-Ser相同)进行血液灌流2 h。
1.1.2 实验试剂 内毒素 (LPS from Escherichia coli 0111:B4,L2630)由SIGMA公司提供,鲎试剂由福建省厦门市鲎试剂实验厂提供,检测 IL-1β、白细胞介素-8(interleukin-8,IL-8)、白细胞介素-10(interleukin-10,IL-10)和高迁移率组蛋白-1(high-mobility group box-1 protein,HMGB-1)的 ELISA试剂盒由Bluegene公司提供。
1.1.3 实验设备 蠕动泵由河北省保定市兰格恒流泵有限公司提供(型号BT01-100),Servo300 型呼吸机由瑞典SIMENS公司提供,PiCCO由德国PULSION公司提供。
1.1.4 PVDF-Ser吸附膜 由浙江大学工学院合成提供(专利号200910100567.5),容积80 mL,有效吸附面积为4 830 cm2。
1.2 实验步骤
1.2.1 麻醉:首先给予氯胺酮5mg/kg+咪达唑仑0.5mg/kg肌肉注射,然后咪达唑仑 6 mg/(kg·h)+芬太尼 60 μg/(kg·h)静脉泵入维持。
1.2.2 所有动物均行经口气管插管,机械通气[容量控制模式:潮气量6 mL/kg,频率25次/min,吸入氧浓度 100%,呼气末正压 0 cm H2O(1 cm H2O=0.098 kPa)]。
1.2.3 两侧颈外静脉穿刺置管用于血液灌流;右侧颈内静脉置入单腔深静脉导管,连接温度感知探头;左侧股动脉置入PiCCO动脉温度压力导管;左侧股静脉置入双腔深静脉导管,用于注射LPS、输注液体和采集血样。
1.2.4 复制内毒素致感染性休克模型:LPS持续静脉泵入4 h,剂量 1 μg/(kg·h)[3]。 开始注射 LPS 后,输注 0.9%的氯化钠溶液 30 mL/(kg·h)。
1.3 血液标本采集、保存和检测
分别于注射LPS前和完成注射后即刻、1、2、3、4 h采集血样,依次记为T0~T5。标本立即在4℃的条件下离心3 000 g×10 min, 取血浆在-80℃条件保存。 测定 LPS、IL-1β、IL-8、IL-10 和 HMGB-1。
1.4 血流动力学指标的采集
分别于T0~T5测定有创平均动脉压 (mean arterial pressure,MAP)、中心静脉压(central venous pressure,CVP)、每搏输出量指数(stroke volume index,SVI)、心排指数(cardiac index,CI)、体循环阻力指数(systemic vascular resistance index,SVRI)和全心舒张末期容量指数 (global enddiastolic volume index,GEDVI)。
1.5 统计学方法
全部数据分析应用SPSS 13.0统计软件处理。计量资料以均数±标准差(±s)表示,组间基线数据的比较采用两独立样本的t检验,实验中LPS、细胞因子和血流动力学参数的变化采用重复测量数据的方差分析。以P<0.05 为差异有统计学意义。
2 结果
2.1 内毒素及细胞因子水平
组间基线数据比较均无差异(P>0.05)。注射LPS后,内毒素均明显升高,组间比较无差异(P=0.089);此后,内毒素水平均呈下降趋势,但开始血液灌流后E组显著低于C组。IL-1β、IL-8、IL-10 和HMGB-1 在注射LPS后均显著增高,C组的升高趋势持续到LPS注射结束后2 h,此后变为缓慢下降;而E组在开始血液灌流后即明显降低,显著低于C组,IL-10 在结束灌流后1 h已接近实验前水平(P=0.132)。见表1。
2.2 血流动力学参数
两组基线数据比较差异无统计学意义(P>0.05)。给予LPS 后,两组动物出现 MAP、CVP、SVI、SVRI和 GEDVI下降,CI则先升高后降低,符合感染性休克的典型改变。与C组相比,E 组行血液灌流后,MAP、SVI、CI、SVRI和 GEDVI均有显著改善,这种效应持续到灌流结束后1 h。而CVP仅在血液灌流 2 h 后略有升高[(3±1) mm Hg vs (2±1) mm Hg,P=0.017](1mmHg=0.133kPa)。与灌流前比较,E组中除CI在灌流2 h后回升、CVP无改善外,其他参数均在开始灌流1 h后即呈升高表现;而C组的多项指标呈进行性恶化趋势。见表2。
3 讨论
LPS作为革兰阴性细菌的外层细胞壁的重要组成部分,当菌体繁殖或死亡后,其以游离形式或与菌体表层蛋白结合的形式释放。与血浆LPS结合蛋白 (LPS-binding protein,LBP)形成复合物,到达粒单核细胞膜CD14分子(membrane CD14,mCD14)或与可溶性 CD14 分子(soluble CD14,sCD14)结合,sCD14/LPS复合物则进一步结合到CD14-的血管内皮细胞、上皮细胞。在跨膜蛋白Toll-like receptor家族(TLR),尤其是TLR4的作用下,依次募集调节分子MyD88 和IL-1 受体相关激酶实现LPS信号从mCD14 到胞质的转导。然后通过核因子κB途径或氨基末端激酶/应激活化蛋白激酶途径造成细胞活化,大量炎症基因表达,多种促炎和抗炎因子合成释放,从而导致严重而失控的全身性炎症反应,进一步发展为感染性休克、多器官功能障碍综合征[4-5]。正是基于内毒素作为脓毒症、感染性休克发生进展的始动和关键环节的认识,近年来大量研究证实,应用多黏菌素B等多种内毒素吸附剂进行血液灌流,可以有效清除血浆内毒素,控制炎症介质水平,从而改善血流动力学紊乱和组织灌注,减轻氧化应激和呼吸氧合异常,最终降低脓毒症病死率[6-8]。笔者前期的动物实验证实应用PVDF-Ser进行血液灌流,可以有效吸附脓毒症猪的血浆LPS,进而降低TNF-α和IL-6 水平,减轻肺、肝、肠等器官损伤,最终降低实验组死亡率[2]。
血浆吸附、血液滤过等多种血液净化措施用于治疗脓毒症和MODS的机制研究不断深入,其中“峰值浓度学说”认为发生脓毒症时机体免疫反应处于完全混乱的状态,促炎和抗炎介质的峰值浓度可同时或先后出现,血液净化是非选择性清除这两类炎症介质,降低促炎介质的峰值浓度,减少其对内皮细胞和血流动力学的影响;降低抗炎介质的峰值浓度,保持了细胞对内毒素血症反应性,恢复了机体的免疫能力[9]。Shimizu等[6]和Takwmi等[10]的临床研究动物实验结果均证实了如上观点。本次实验发现PVDF-Ser吸附膜在清除血浆LPS的基础上,不仅有效控制IL-1β、IL-8的异常升高,亦可降低抗炎因子IL-10的血浆水平,从而重建机体的免疫稳态,提高 MAP、SVI、SVRI和 GEDVI,进一步验证了以上假说和解释了PVDF-Ser改善血流动力学紊乱的机制。
表1 血浆内毒素和细胞因子变化(±s)
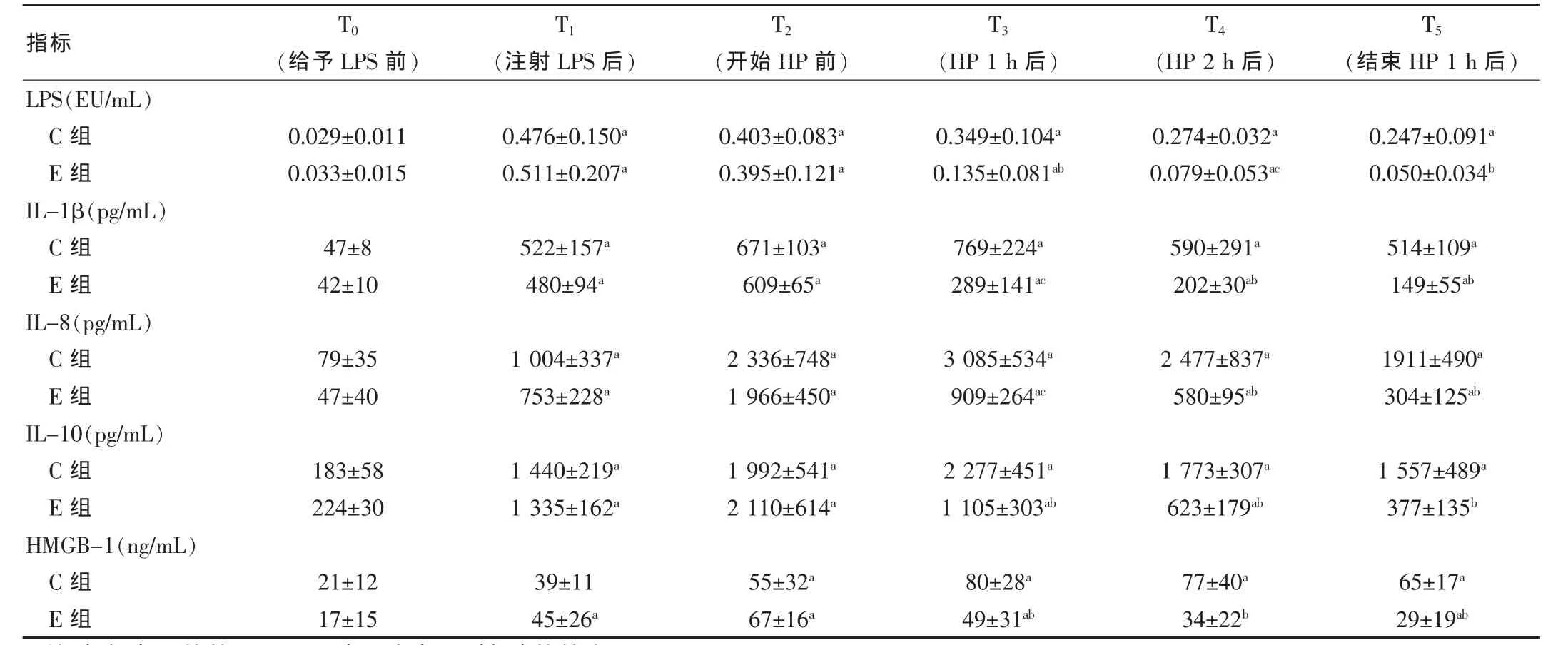
表1 血浆内毒素和细胞因子变化(±s)
注:与组内T0 比较,aP<0.05;与C组相同时间点比较,bP<0.05,cP<0.01
指标 T0(给予LPS前)T1T2T3T4T5(注射LPS后) (开始HP前) (HP 1 h后) (HP 2 h后) (结束HP 1 h后)LPS(EU/mL)C组E组IL-1β(pg/mL)C组E组IL-8(pg/mL)C组E组IL-10(pg/mL)C组E组HMGB-1(ng/mL)C组E组0.029±0.011 0.033±0.0150.476±0.150a 0.511±0.207a 0.403±0.083a 0.395±0.121a 0.349±0.104a 0.135±0.081ab 0.274±0.032a 0.079±0.053ac 0.247±0.091a 0.050±0.034b 47±8 42±10 522±157a 480±94a 671±103a 609±65a 769±224a 289±141ac 590±291a 202±30ab 514±109a 149±55ab 79±3547±40 1 004±337a 753±228a 2 336±748a 1 966±450a 3 085±534a 909±264ac 2 477±837a 580±95ab 1911±490a 304±125ab 183±58 224±30 1 440±219a 1 335±162a 1 992±541a 2 110±614a 2 277±451a 1 105±303ab 1 773±307a 623±179ab 1 557±489a 377±135b 21±12 17±1539±11 45±26a 55±32a 67±16a 80±28a 49±31ab 77±40a 34±22b 65±17a 29±19ab
表2 血流动力学参数变化(±s)
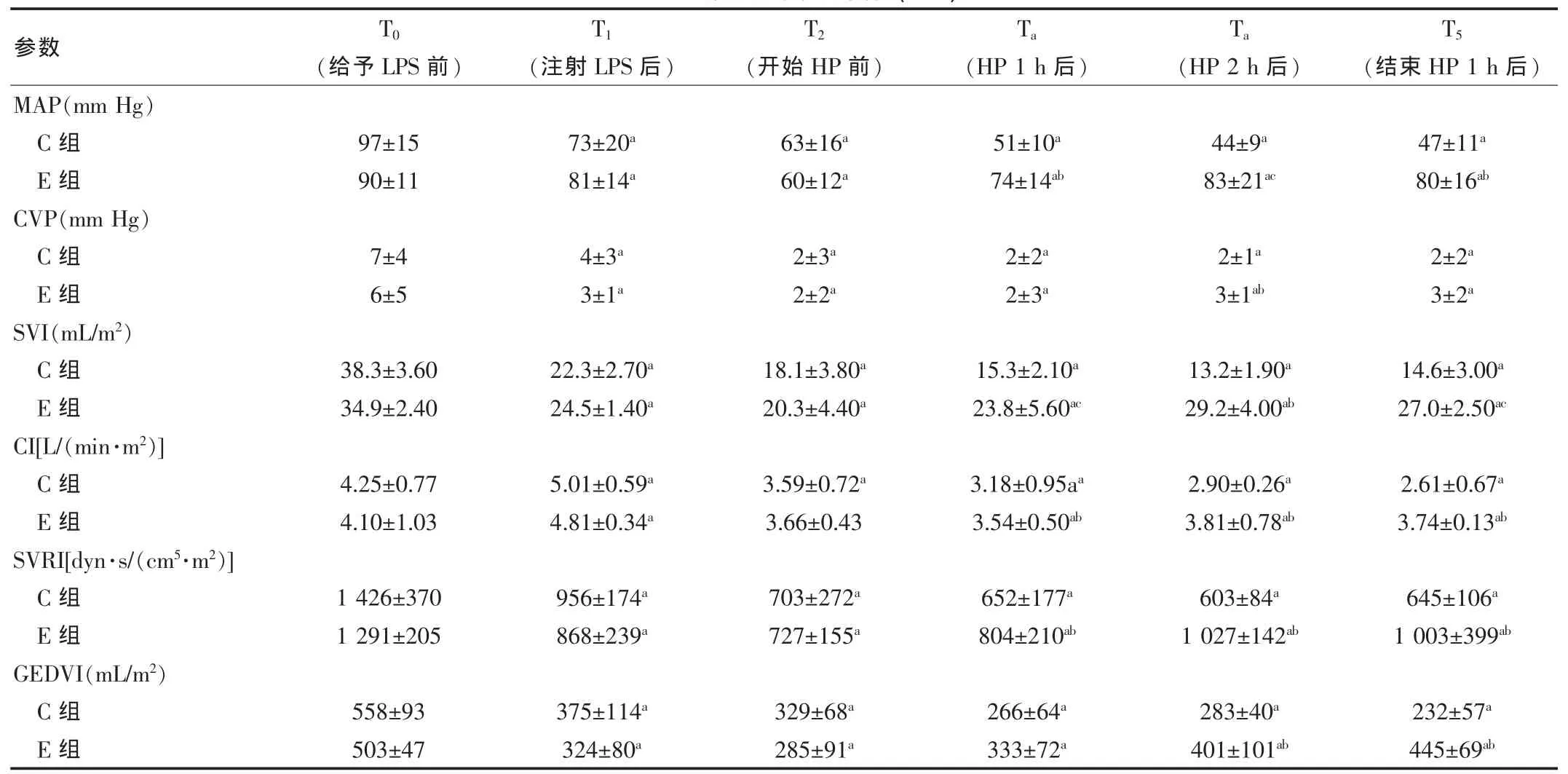
表2 血流动力学参数变化(±s)
注:与组内T0 比较,aP<0.05;与C组相同时间点比较,bP<0.05,cP<0.01
参数 T0(给予LPS前)T1T2Ta Ta T5(注射LPS后) (开始HP前) (HP 1 h后) (HP 2 h后) (结束HP 1 h后)MAP(mm Hg)C组E组CVP(mm Hg)C组E组SVI(mL/m2 )C组E组CI[L/(min·m2 )]C组E组SVRI[dyn·s/(cm5 ·m2 )]C组E组GEDVI(mL/m2 )C组E组97±1590±11 73±20a 81±14a 63±16a 60±12a 51±10a 74±14ab 44±9a 83±21ac 47±11a 80±16ab 7±4 6±54±3a 3±1a 2±3a 2±2a 2±2a 2±3a 2±1a 3±1ab 2±2a 3±2a 38.3±3.60 34.9±2.40 22.3±2.70a 24.5±1.40a 18.1±3.80a 20.3±4.40a 15.3±2.10a 23.8±5.60ac 13.2±1.90a 29.2±4.00ab 14.6±3.00a 27.0±2.50ac 4.25±0.77 4.10±1.03 5.01±0.59a 4.81±0.34a 3.59±0.72a 3.66±0.43 3.18±0.95aa 3.54±0.50ab 2.90±0.26a 3.81±0.78ab 2.61±0.67a 3.74±0.13ab 1 426±370 1 291±205956±174a 868±239a 703±272a 727±155a 652±177a 804±210ab 603±84a 1 027±142ab 645±106a 1 003±399ab 558±93 503±47 375±114a 324±80a 329±68a 285±91a 266±64a 333±72a 283±40a 401±101ab 232±57a 445±69ab
现已证实,HMGB-1 在内毒素血症和严重脓毒症的病生理过程中扮演晚发炎症介质的重要角色,大量释放可激活炎症反应、活化单核细胞和诱导内皮细胞的黏附分子[11]。Yuichiro等[12]对20例感染性休克患者应用多黏菌素B进行血液灌流,发现与死亡组相比,存活组的HMGB-1 显著改善,提示可能通过降低HMGB-1的途径,纠正感染性休克的循环衰竭。笔者的研究显示,血液灌流2 h后,E组HMGB-1 较灌流前显著降低[(34±22)ng/mL vs(67±16)ng/mL,P=0.007],同时也明显低于 C 组水平 [(34±22)ng/mL vs (77±40)ng/mL,P=0.024]。表明PVDF-Ser可能通过清除血浆HMGB-1 控制炎症反应和改善血流动力学紊乱。
近来,大量动物实验和临床研究报道了多种内毒素和炎症介质吸附治疗在脓毒症、感染性休克和MODS中的积极影响,提示未来它可能成为脓毒症的重要治疗手段[13]。笔者的实验进一步证实了PVDF-Ser通过清除HMGB-1 和非选择性清除促炎、抗炎介质的机制,在调节失控的严重炎症反应和纠正血流动力学紊乱方面的有效作用,不失为脓毒症和感染性休克血液灌流的有益尝试。
[1] Ismail Cinel.Molecular biology of inflammation and sepsis:A primer[J].Crit Care Med,2009,37(1):291-304.
[2] 李宁,徐秋萍,黄曼,等.应用聚偏氟乙烯-丝氨酸吸附膜血液灌流治疗猪脓毒血症的实验研究[J].中国急救医学,2010,6:524-527.
[3] Miklós Lipcsey,Anders Larsson,Mats BE,et al.Inflammatory,coagulatoryandcirculatoryresponsestologarithmicincreasesinthe endotoxindose in the anaesthetised pig[J].Journal of Endotoxin Research,2006,12(2):99-112.
[4] Didier H,Thierry R.Initial responses to endotoxins and Gram-negative bacteria[J].Clinica Chimica Acta,2002,323:59-72.
[5] Kensuke M.Innate recognition of lipopolysaccharide by Toll-like receptor 4–MD-2 Innate recognition of lipopolysaccharide by Toll-like receptor 4–MD-2[J].TRENDS in Microbiology,2004,12(4):186-192.
[6] Shimizu T,Hanasawa K,Sato K,et al.Direct hemoperfusion with polymyxin-B-immobilized fiber columns improves septic hypotension and reduces inflammatory mediators in septic patients with colorectal perforation[J].Langenbecks Arch Surg,2009,394(2):303-311.
[7] Kushi H,Miki T,Sakagami Y,et al.Early hemoperfusion with a polymyxin b column improves gastric intramucosal pH in sepsis[J].Ther Apher Dial,2008,12(4):278-284.
[8] Taniguchi T,Kurita A,Yamamoto K,et al.Comparison of a cytokine adsorbing column and an endotoxin absorbing column for the treatment of experimental endotoxemia[J].Transfus Apher Sci,2009,40(1):55-59.
[9] Ciro T,Rinaldo B,Paola I,et al.Endotoxin and cytokine removal in sepsis[J].Therapeutic Apheresis,2002,6(2):109-115.
[10] Takumi T,Fumiyasu H,Yasuhiro T,et al.A novel adsorbent of circulating bacterial toxins and cytokines:The effect of direct hemoperfusion with CTR column for the treatment of experimental endotoxemia[J].Crit Care Med,2006,34(3):800-806.
[11] Wang H,Bloom O,Zhang M,et al.HMGB-1 as a late mediator of endotoxin lethality in mice[J].Science,1999,285:248-251.
[12] Yuichiro S,Kunihiro M,Hisashi M,et al.Relationship between effect of polymyxin b-immobilized fiber and high-mobility group box-1 protein in septic shock patients[J].ASAIO Journal,2007,53:324-328.
[13] Taniguchi T.Cytokine adsorbing columns[J].Contrib Nephrol,2010,166:134-141.
