短暂脑缺血对大鼠海马脑区锥体神经元外向整流氯通道功能的影响
2012-09-13李建国刘乃红陈建鸣
李建国,刘乃红,陈建鸣
海马CA1区的锥体神经元对于缺血损伤特别敏感,并且在短暂前脑缺血后呈现迟发性神经元凋亡,而CA3和齿状回神经细胞不受此影响。目前对这种选择性细胞死亡的机制仍不清楚[1]。研究表明,细胞凋亡参与了脑缺血后神经元的死亡过程[2],而且钾通道和氯通道等离子通道参与细胞的凋亡过程[3,4]。
目前,除了三类已知基因表达的氯离子通道,如配体门控氯通道(甘氨酸受体和GABA受体)、ClC氯通道(ClC1~ClC7,ClC-K1和ClC-K2)和囊性纤维变性调节因子氯通道(CFTR),细胞膜上还分布着一种功能表达的氯通道,即外向整流氯离子通道(outwardly rectifying chloride channels)。这是一种中等电导大小,具有外向整流特性的氯通道。虽然其分子结构仍然不清楚,但是大量的研究发现,外向整流氯离子通道参与了细胞的凋亡性死亡过程[4],细胞死亡的程度能够被氯通道阻断剂所减缓[5]。因此,认为外向整流氯离子通道可能参与了海马CA1区锥体神经元在缺血后出现的迟发性死亡过程。为探讨这种可能性,本实验运用全细胞膜片钳技术观察了短暂前脑缺血后,大鼠海马CA1和CA3区锥体神经元外向整流氯离子通道活性的变化情况。
1 材料与方法
1.1 脑片的制备与神经元的急性分离 按以往报道的方法急性分离神经元[6]。实验采用成年雄性 Wistar大鼠(180g~250 g)。麻醉后(水合氯醛40mg/100g)快速断头并取出大脑,在振动切片机上切成厚度400μm的脑片。把切好的脑片放置于通以95%O2和5%CO2混合气的EBSS液中孵育1h~4h,然后分离出海马脑区并放入用100%O2饱和的HBSS液中用链白蛋白酶(protease XIV,1.2mg/mL~1.5mg/mL)消化35 min~40min,放到低钙羟乙基磺酸钠缓冲液中吹打,制备成细胞悬液备用,实验选用形态为锥形或梭形、有基树突和顶树突的锥体神经元进行全细胞记录。
1.2 全细胞电流记录与数据分析 实验采用全细胞电压钳制技术,电极电阻为3.5MΩ~5MΩ。全细胞电流通过膜片钳放大器 (Axopatch 200B)由 A/D转换系统(Digidata 1320)以5 kHz频率采集,1kHz低通滤波。实验是在钳制电压-40mV的基础上采用斜坡电压脉冲程序(从-80mV去极化到+80 mV,100mV/s),采集频率为0.1Hz,室温下记录。数据采集、分析使用pClamp 10.0软件。羟乙基磺酸钠缓冲液成分为:羟乙基磺酸钠140mmol/L,KCl 2mmol/L,MgCl24mmol/L,CaCl20.1mmol/L,葡萄糖23mmol/L,HEPES 15mmol/L,用1nmol/L NaOH将pH值调定为7.35;浴槽液成分为:NMDG-Cl 140mmol/L,MgCl22mmol/L,Hepes 10mmol/L,葡萄糖10mmol/L,4-AP 2mmol/L,EGTA-Na21mmol/L,用1nmol/LNMDG-OH将pH值调定为7.3;电极内液成分为:NMDG-Cl 25mmol/L,NMDG 115mmol/L,天冬氨酸100,MgCl22mmol/L,EGTA 10mmol/L,Hepes 10mmol/L,EGTA- Na2ATP 5 mmol/L,用1nmol/L NMDG-OH将pH值调定为7.3。
1.3 脑缺血模型的制备 成年大鼠,分为CA1锥体神经元对照组及缺血再灌注后6h和24h实验组。采用血管夹闭方法进行短暂前脑缺血(15min)[7]。大鼠以水合氯醛麻醉 (ip,4 0 mg/100g),颈部切口,分离双侧颈总动脉。将大鼠固定于定位仪后,高温电凝双侧椎动脉,禁食过夜。以这种方法制备的大鼠没有明显的脑损害,行为正常。第2天,用动脉夹夹闭清醒的大鼠双侧颈总动脉15min,以造成短暂前脑缺血模型。大鼠在60 s内昏迷,翻正反射消失,痛反射消失,双侧瞳孔放大。脑缺血15min后解除动脉夹,恢复脑血流。具有这些症状的大鼠分别存活6h或24h后进行以下的细胞分离。部分脑片经甲醛溶液固定,克紫染色后光镜观察。缺血再灌注后出现惊厥等异常表现的大鼠予以排除,实验中保持37℃的大鼠体温。
2 结 果
2.1 急性分离大鼠海马神经元上外向整流氯离子通道的特性实验采用全细胞膜片钳技术,钳制电压为-40mV。给予斜坡电压程序(-80mV~80mV)后,可以在细胞上记录到一个双向电流。此电流具有外向整流特性,在-80mV时的全细胞电流为(9.11±1.2)pA/pF,在80mV时的全细胞电流为(64.2±6.9)pA/pF。翻转电位为-36.25mV,接近于本试验中Cl-的平衡膜电位(-40mV)。氯离子通道阻断剂DIDS能够阻断此通道电流活动。在浴槽液中加入1mmol/L DIDS能够可逆性阻断外向整流氯离子通道。在+80mV膜电位下,通道电流从(64.2±6.9)pA/pF下降到(11.43±13.76)pA/pF(P<0.01)。详见图1。
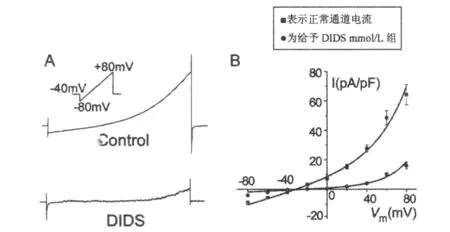
图1 大鼠海马锥体神经元上记录到的外向整流氯通道全细胞电流图
2.2 短暂脑缺血后大鼠海马CA1区锥体神经元外向整流氯通道的功能改变 短暂前脑缺血能够使海马CA1区锥体神经元广泛死亡,脑缺血7d后,CA1区锥体神经元基本全部死亡,而CA3区和齿状回细胞基本正常。
短暂脑缺血后大鼠海马CA1区锥体神经元外向整流氯通道电流持续性增强。缺血后6h和24h的全细胞电流从正常的(9.11±1.2)pA/pF(-80mV)和(64.2±6.9)pA/pF(80mV)分别增强为:(15.80±1.70)pA/pF、(17.70±1.93)pA/pF(-80mV)和(120.16±12.30)pA/pF、(129.82±11.83)pA/pF(+80mV)(P<0.05),与对照组相比明显增强。
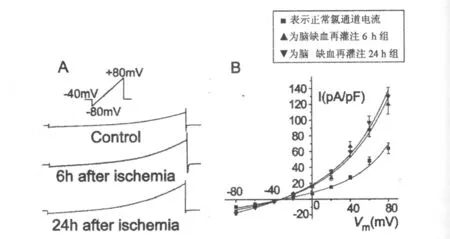
图2 短暂脑缺血后大鼠海马CA1区锥体神经元外向整流氯通道电流图
2.3 脑缺血前后海马CA3区锥体神经元外向整流氯通道特性的比较 证明外向整流氯通道活动增强是否为脑缺血后易损海马神经元的独特现象,或者仅仅为缺血后神经元的共同反应,这对于阐明外向整流氯通道在缺血性脑损伤中的作用十分重要。因此,我们进一步比较了脑缺血前后的CA3区锥体神经元外向整流氯通道的功能变化。采用同样全细胞电压钳记录技术,在CA3区锥体神经元记录到外向整流氯通道电流。
脑缺血前后的全细胞电流图,其电流值无明显差异。缺血前和缺血后24h的全细胞电流值分别为(11.4±1.47)pA/pF、(7.97±0.90)pA/pF(-80mV)和(60.14±7.13)pA/pF、(65.66±7.68)pA/pF(+80mV)(P>0.05),与对照组相比无明显变化。

图3 短暂脑缺血后大鼠海马CA3区锥体神经元外向整流氯通道电流图
3 讨 论
本研究发现,脑缺血后大鼠海马CA1区锥体神经元外向整流氯通道的功能活动持续性增强,然而CA3区细胞氯通道电流无明显改变,这同以前报道的脑缺血再灌注后海马锥体神经元的细胞膜特性变化相符[8]。以往研究观察到脑缺血后大鼠海马锥体神经元同样出现选择性兴奋性改变,CA1神经元动作电位阈值增加而CA3细胞无变化。因为氯通道开放能够导致神经元超级化,所以脑缺血后氯通道活动增强导致的细胞超极化可能是CA1区神经元细胞膜兴奋性和自发放电频率降低的机制之一。
蛋白激酶能够调节外向整流氯通道的活动。酪氨酸激酶p125能够激活小肠上皮细胞膜上的外向整流氯离子通道,酪氨酸激酶p56也可以激活淋巴细胞膜上的外向整流氯通道,在胞浆侧加入酪氨酸激酶抑制剂可以抑制多种细胞上的外向整流氯通道电流[9,10]。酪氨酸激酶可被细胞肿胀和Fas受体信号激活。短暂脑缺血后,CA1锥体神经元中Fas受体蛋白及其配体大量表达。因此,推测脑缺血后外向整流氯通道活动增强可能是由于Fas信号通路激活了酪氨酸激酶所致[11]。这与酪氨酸激酶抑制剂能够保护脑缺血后CA1区锥体神经元死亡相符合[12]。
不同部位的神经元对缺血损伤的敏感度不同,15min前脑缺血能够引起CA1区锥体神经元广泛死亡,然而基本不影响CA3和齿状回细胞。本实验发现CA1和CA3区神经元外向整流氯通道对脑缺血伤害性刺激的反应不同,CA1细胞上氯通道电流增强,而在CA3的细胞无显著变化。因此,认为脑缺血后CA1细胞外向整流氯通道活动持续性增强不但使神经元兴奋性进行性降低,而且参与了缺血性神经元损伤,大量研究[13,14]发现氯通道参与多种细胞的凋亡过程也支持我们提出的这一假说。
外向整流氯通道能够通过转运HCO3-直接降低细胞内pH值,也能够通过易化Cl-/HCO3-交换体分泌碳酸氢盐来间接降低细胞内pH值。细胞内酸化后激活酸性核酸内切酶,进而参与细胞凋亡的过程[15,16]。因此,脑缺血后海马CA1锥体神经元外向整流氯通道活动持续性增强可能通过降低细胞内pH值促进神经元凋亡。
外向整流氯通道引起的细胞容积改变是细胞凋亡的另一重要机制。研究发现,钾离子和氯离子经氯通道和钾通道外流是细胞出现凋亡性容积减少的一个重要因素。而凋亡性容积减少是驱动细胞死亡重要因素,给予通道阻断剂能够抑制凋亡性容积减少和细胞凋亡[5]。脑缺血后外向整流氯通道被过渡激活后,通过减少细胞容积诱导海马CA1锥体神经元凋亡过程的发生。另外,Cl-外流本身亦可通过DNA内切酶活化诱导细胞凋亡。
本实验发现,脑缺血后CA1神经元外向整流氯通道活动持续性增强,而CA3神经细胞的氯通道无显著变化,这可能是CA1区椎体神经元对脑缺血易损的一个重要机制。
[1]Kirino T,Tamura A,Sano K.Delayed neuronal death in the rat hippocampus following transient forebrain ischemia[J].Acta Neuropathol,1984,64(2):139-147.
[2]Love S.Apoptosis and brain ischaemia[J].Prog Neuropsychopharmacol Biol Psychiatry,2003,27(2):267-282.
[3]Inoue H,Ohtaki H,Nakamachi T,etal.Anion channel blockers attenuate delayed neuronal cell death induced by transient forebrain ischemia[J].J Neurosci Res,2007,85(7):1427-1435.
[4]Szabo I,Zoratti M,Gulbins E.Contribution of voltage-gated potassium channels to the regulation of apoptosis[J].FEBS Lett,2010,584(10):2049-2056.
[5]Maeno E,Ishizaki Y,Kanaseki T,etal.Normotonic cell shrinkage because of disordered volume regulation is an early prerequisite to apoptosis[J].Proc Natl Acad Sci USA,2000,97(17):9487-9492.
[6]Li XM,Li JG,Yang JM,etal.An improved method for acute isolation of neurons from the hippocampus of adult rats suitable for patch-clamping study[J].Acta Physiologica Sinica,2004,56(1):112-117.
[7]Pulsinelli WA,Brierley JB,Plum F.Temporal profile of neuronal damage in a model of transient forebrain ischemia[J].Ann Neurol,1982,11(5):491-498.
[8]Gao TM,Pulsinelli WA,Xu ZC.Changes in membrane properties of CA1pyramidal neurons after transient forebrain ischemia in vivo[J].Neuroscience,1999,90(3):771-780.
[9]Crepel V,Panenka W,Kelly ME,etal.Mitogen-activated protein and tyrosine kinases in the activation of astrocyte volume-activated chloride current[J].J Neurosci,1998,18(4):1196-1206.
[10]Szabo I,Lepple-Wienhues A,Kaba KN,etal.Tyrosine kinasedependent activation of a chloride channel in CD95-induced apoptosis in T lymphocytes[J].Proc Natl Acad Sci USA,1998,95(11):6169-6174.
[11]Jin K,Graham SH,Mao X,etal.Fas(CD95)may mediate delayed cell death in hippocampal CA1sector after global cerebral ischemia[J].J Cereb Blood Flow Metab,2001,21(12):1411-1421.
[12]Toledo-Pereyra LH,Lopez-Neblina F,Toledo AH.Protein kinases in organ ischemia and reperfusion[J].J Invest Surg,2008,21(4):215-226.
[13]Bortner CD,Cidlowski JA.The role of apoptotic volume decrease and ionic homeostasis in the activation and repression of apoptosis[J].Pflugers Arch,2004,448(3):313-318.
[14]Wei L,Xiao AY,Jin C,etal.Effects of chloride and potassium channel blockers on apoptotic cell shrinkage and apoptosis in cortical neurons[J].Pflugers Arch,2004,448(3):325-334.
[15]Goossens JF,Henichart JP,Dassonneville L,etal.Relation between intracellular acidification and camptothecin-induced apoptosis in leukemia cells[J].Eur J Pharm Sci,2000,10(2):125-131.
[16]Che XF,Zheng CL,Akiyama S,etal.2-Aminophenoxazine-3-one and 2-amino-4,4alpha-dihydro-4alpha,7-dimethyl-3H-phenoxazine-3-one cause cellular apoptosis by reducing higher intracellular pH in cancer cells[J].Proc Jpn Acad Ser B Phys Biol Sci,2011,87(4):199-213.
