乳清蛋白酶解物的抗氧化活性研究
2012-09-12许女西艳双杨莉榕
许女,西艳双,杨莉榕
(山西农业大学食品科学与工程学院,山西太谷030801)
乳清蛋白酶解物的抗氧化活性研究
许女,西艳双,杨莉榕
(山西农业大学食品科学与工程学院,山西太谷030801)
研究在不同的酶种类、[E/S]、酶解时间下,乳清蛋白酶解物的抗氧化活性。结果表明,在胃蛋白酶37℃,[E/S]为0.15%,水解温度水解时间2 h;胰蛋白酶[E/S]为0.4%,水解温度50℃,水解时间2 h的条件下,乳清蛋白的酶解物有较强的抗氧化活性。
乳清蛋白;酶解物;抗氧化活性
Abstract:The effect of different types of enzymes,[E/S],hydrolysis time on antioxidant activity of whey protein hydrolysate were studied in this paper.The results showed that the optimum two enzyme hydrolysis conditions respectively was:pepsin[E/S]0.15%,37℃,hydrolysis time 2 h;trypsin[E/S]0.4%,50℃,hydrolysis time 2 h,while the whey protein hydrolysate has a good antioxidant activity.
Key words:whey protein;hydrolysate;antioxidant activity
乳清蛋白主要来源于干酪生产的副产物乳清,是乳沉淀酪蛋白后分离出来的蛋白质,富含多种必需氨基酸,β-乳球蛋白(β-LG)、α-乳白蛋白(α-LA)、牛血清蛋白(BSA)、免疫球蛋白、乳铁蛋白(LF)、糖巨肽(CGMP)、乳过氧化物酶等多种活性成分,是国际上公认的人体最优质蛋白质补充剂之一[1-2]。国外对乳清蛋白酶解活性肽的研究已经有20多年的历史,目前已广泛兴起对具有免疫调节、降血压、降血糖、降胆固醇、抗氧化、抗菌和抗病毒等生物活性的乳源活性肽产品的研究开发[3]。国内对乳清蛋白源生物活性肽的研究尚处于起步阶段,尤其缺乏对乳清蛋白源抗氧化肽的研究。随着中国乳品行业的发展,乳清蛋白的产量将会越来越多。尽管目前发现的乳清蛋白源生物活性肽段种类还比较少,并且许多生物活性肽的作用机理尚未完全阐明,但随着研究水平的逐步深入,有目的地释放乳清蛋白中潜在生物活性肽片段,对提高乳清蛋白产品的附加值,拓展乳功能性食品及新药开发领域,增进乳的开发与利用价值,有一定的理论指导意义,对人类健康事业的发展具有较大的促进作用。
本文以乳清蛋白为原料,通过控制胰蛋白酶和胃蛋白酶的水解条件,制备出具有抗氧化活性的乳清蛋白酶解物(Whey Protein Hydrolysates,WPHs),为乳清蛋白进一步开发利用和抗氧化肽产品的深入研究提供科学参考。
1 材料与方法
1.1 主要材料试剂
乳清蛋白(WP):新西兰Tatua Corporate Profile公司;胃蛋白酶、胰蛋白酶:美国Amersco公司;茚三酮:天津市北辰方正试剂厂;二苯代苦味酰基自由基DPPH:Sigma公司。
1.2 主要仪器设备
F22E型可见分光光度计:上海精密科学仪器有限公司;J-25型高速冷冻离心机:美国BECKMAN公司;HHS-21-4型数显恒温水浴锅:上海博讯实业有限公司医疗设备厂;0.01级便携式酸度计pHB-1:广东省医疗器械厂;JDG-0.2型真空冷冻干燥机:兰州科近真空技术有限公司;MDF-U4086S型超低温冷冻冰箱:日本SANYO公司。
1.3 试验方法
1.3.1 不同的酶种类对乳清蛋白酶解物抗氧化活性的影响
称取乳清蛋白10 g溶于250 mL蒸馏水中,分别加入胃蛋白酶和胰蛋白酶启动反应。水解过程中维持最适酶反应温度和pH并不断搅拌(胃蛋白酶,[E/S]为0.2%,37℃,pH 2.0;胰蛋白酶,[E/S]为 0.8%,50℃,pH 7.0,分别在 0、30、60、90、120、150、180 min 取样,调 pH为 7.0,煮沸灭酶 10 min,冷却后,4℃,4000 r/min离心20 min,取部分上清液进行蛋白水解度的测定,其余上清液冻干后,于-20℃保存,用于抗氧化活性分析。
1.3.2 不同的[E/S]对乳清蛋白酶解物抗氧化活性的影响
分别选取胃蛋白酶的[E/S]为0.05%、0.15%、0.3%、0.45%,胰蛋白酶的[E/S]为0.1%、0.4%、1%、1.6%,按照1.3.1乳清蛋白的酶解工艺对乳清蛋白进行酶解,测定其酶解物的抗氧化活性。
1.3.3 乳清蛋白水解度(DH)的测定
1.3.3.1 甘氨酸标准曲线的制作[4]
称取0.1000g干燥过的甘氨酸溶解后定容至100mL,取出2.0 mL定容至100 mL得20 μg/mL的溶液。取此液再分别稀释成含量为2 μg/mL~20 μg/mL的溶液用于标准曲线绘制。取2.00 mL测定用稀释液于试管中加入1.00mL茚三酮显色剂,混匀后沸水浴中加热15min,同时作空白试验,然后冷水冷却,加入5.0 mL 40%乙醇溶液(体积分数)混匀,放置15 min后,以空白管调零于570 nm处测定A值。
茚三酮显色剂:0.5 g茚三酮、0.3 g果糖、10 g磷酸氢二钠,6 g磷酸二氢钾定容100 mL。
1.3.3.2 乳清蛋白水解液水解度的测定[4-5]
取乳清蛋白水解液0.50mL定容至50mL,取0.50mL稀释液于试管中并加入1.50 mL蒸馏水、1.00 mL显色剂,混匀后置沸水浴中加热15 min,同时作空白试验然后冷水冷却,加入5.0 mL 40%乙醇溶液(v/v)混匀,放置15 min后,以空白管调零于570 nm处测定A值。
利用标准曲线计算水解蛋白液中-NH2的含量(μmol/mL)。
水解度用下面公式计算:

式中:htot为每克原料蛋白质的肽键毫摩尔数,查得乳清蛋白htot=8.8(mmol/g);6.25*N为水解底物蛋白质含(g/L),本实验乳清蛋白为11.66。
1.3.4 乳清蛋白酶解物抗氧化活性的测定
1.3.4.1 总还原能力的测定[6]
参考Oyaizu的方法并略作改动。称取乳清蛋白水解物冻干样品样品50mg,抗坏血酸5mg分别溶于1mL蒸馏水中,加入 2.5 mL,0.2 mol/L PBS(pH 6.6)和 2.5 mL 1%的铁氰化钾溶液于试管中混匀,混合物在50℃水浴中反应20 min后,迅速冷却并加入2.5 mL 10%的TCA,混匀后4000 r/min离心10 min,取上清液3 mL,在上清液中加入0.6 mL 0.1%的三氯化铁溶液混匀,再加入3 mL蒸馏水摇匀,以蒸馏水调零,在700 nm处测定吸光度。吸光度值越高,说明反应混合物的还原性越强。
1.3.4.2 DPPH自由基清除能力
采用罗兹-哥特里法(Rose-Gottile)][7-8]进行测定。
称取50 mg样品和5 mg抗坏血酸分别溶于2 mL水中,分别加入2 mL 0.2 mmol/L的DPPH无水乙醇溶液,混匀。室温下避光放置30 min后,于517 nm处测定吸光值,吸光值越小,表明自由基清除能力越强。
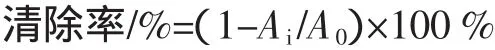
式中:A0为2 mL0.2 mmol/L的DPPH无水乙醇溶液+2 mL的样品溶剂,空白对照;Ai为2 mL无水乙醇+2 mL的样品。
2 结果与讨论
2.1 甘氨酸标准曲线的绘制
本试验采用水和茚三酮法测定水解蛋自质的水解度,如图1为不同浓度甘氨酸溶液下对应的吸光度值。

2.2 不同的酶种类对乳清蛋白酶解物的抗氧化活性的影响
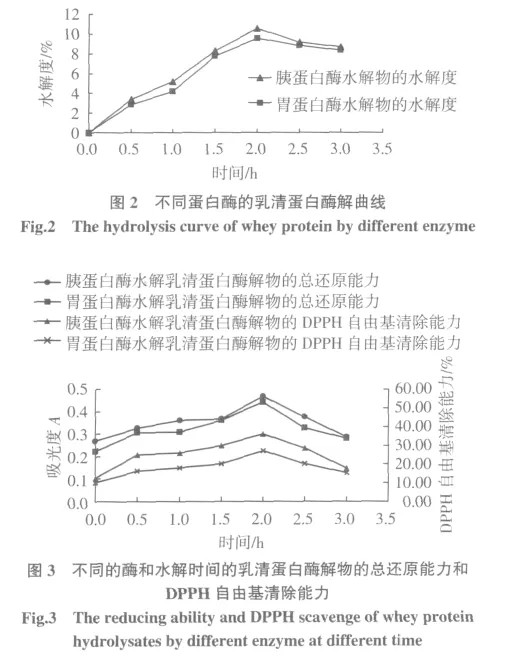
按照1.3.1乳清蛋白的酶解工艺,将冻干的酶解物配制成50 mg/mL的样品,测定其还原能力、DPPH自由基清除率。结果如图2,图3。
酶解物的抗氧化活性与某些特征氨基酸序列存在着一定相关性,但目前还没有阐明其具体的构效关系。在一定范围内,随着水解度的增加,水解液中小分子片段越来越多,因此,可以通过控制水解度,来获得具有生物活性的目标片段。不同的酶对乳清蛋白中所含的各种蛋白的底物特异性及作用位点不同,因此获得的酶解产物的肽链结构和长度也不同,但其活性却有可能相同。通常期望得到的具有特定功能的活性肽往往是分子量较小的短肽。用水解度衡量水解的程度,随水解度的增大得到的短肽相对较多。若单纯追求高水解度指标,必然会导致产生较多的游离氨基酸,因此,在检测乳清蛋白酶解物水解度的同时,应主要检测酶解物的抗氧化活性。
由图2可知胃蛋白酶和胰蛋白酶酶解乳清蛋白的水解度,在2 h内都随时间的延长而不断增大,2 h后胰蛋白酶和胃蛋白酶水解乳清蛋白的水解度都略微下降,说明此时大多数的乳清蛋白已经被酶水解成许多小肽段和游离氨基酸,随后一些游离氨基酸和小肽又发生了结合作用,使水解度产生降低的现象[4]。
由图3可知,在2 h以内,两种酶的乳清蛋白水解物的总还原能力和DPPH自由基清除都随着水解时间的延长而增强,2 h时达到峰值,其中胰蛋白酶水解物的还原能力A值为0.498,DPPH自由基清除率为35.31%,高于胃蛋白酶水解物的还原能力(A值为0.464,DPPH自由基清26.68%)。
2.3 不同的[E/S]对乳清蛋白酶解物的抗氧化活性的影响
按照1.3.2的试验方法,将冻干的酶解物配制成50 mg/mL的样品,测定其总还原能力,研究不同的加酶量对乳清蛋白酶解物的抗氧化活性的影响,实验结果如图4、图5。
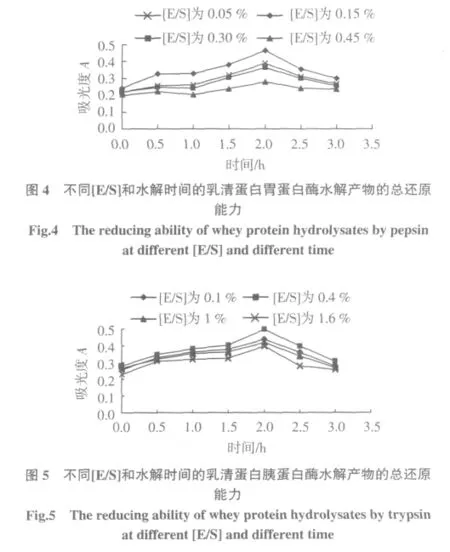
由图4和图5可以看出,在2 h内,乳清蛋白的胃蛋白酶水解物和胰蛋白酶水解物的还原能力都随时间的延长而增强,2 h时都达到峰值,2 h后随着水解时间的延长,还原能力逐渐降低。另外,酶的添加量有一个最适的值,在底物浓度一定的时候,理论上讲酶分子越多,则酶与底物之间的作用越频繁,但随着酶用量的增加,酶的数量就趋于过剩,单位时间内一部分酶分子不与底物结合,造成水解度增加缓慢,另外,由于酶本身也是一种蛋白质,也会发生酶解,如果加入量太大了则会干扰酶解物的组成和活性[9]。最终确定胃蛋白酶和胰蛋白酶水解乳清蛋白制备抗氧化产物的最适[E/S]分别为,[E/S]为0.15%和0.40%。
3 结论
本文研究了在不同的酶种类、[E/S]、酶解时间下,乳清蛋白酶解物的抗氧化活性。结果表明,在2 h内,乳清蛋白的胃蛋白酶水解物和胰蛋白酶水解物的总还原能力和DPPH自由基清除能力,都随时间的延长而增强,2 h时都达到峰值,2 h后随着水解时间的延长,还原能力逐渐降低;另外[E/S]也有一个最适的值。最终确定,利用胃蛋白酶和胰蛋白酶分别水解乳清蛋白制备抗氧化产物的最佳条件为:底物及乳清蛋白液的浓度为 4%,胰蛋白酶[E/S]为 0.4%,50℃,pH 7.0,水解时间 2 h;胃蛋白酶[E/S]为 0.15%,37 ℃,pH 2.0,水解时间2 h。
[1]Pihlanto A.Antioxidative peptides derived from milk proteins[J].International dairy journal,2006,16(11):1306-1314
[2]王磊,成雪,毛学英.乳清蛋白及其活性多肽的生物学功能研究进展[J].中国农业科技导报,2010,12(5):30-35
[3]蒋与刚,庞伟.乳清蛋白的生物学作用研究进展[J].中国食物与营养,2008(10):49-51
[4]徐思源.乳清蛋白降压肽的制备及其功能研究[D].哈尔滨:东北林业大学,2007:10-11
[5]姚婷婷.乳源抗菌肽的研究[D].杭州:浙江工业大学,2006:23-24
[6]Oyaizu M.Studies on products of browning reaction:antioxidative activities ofproducts ofbrowning reaction prepared from glucosamine[J].Jpn J Nutr,1986,44(6):307-315
[7]Chen H M,Muramoto K,Yamauchi.Antioxidative properties of histidine-containing peptides designed from peptide fragments found in the digest of a soybean protein[J].J agric Food Chem,1998,46(1):49-53
[8]刘志东,郭本恒,曲映红,等.酪蛋白酶解物的抗氧化活性研究.天然产物研究与开发,2008,20(1):19-23
[9]刘志东.乳抗氧化肽的分离、纯化及生物活性研究[D].上海:上海海洋大学,2008:33-34
Antioxidant Activity of the Hydrolysates of Whey Protein
XU Nü,XI Yan-shuang,YANG Li-rong
(Food Science and Engineering College,Shanxi Agricultural University,Taigu 030801,Shanxi,China)
2012-02-29
山西农业大学科技创新基金(2010009)
许女(1979—),女(汉),讲师,博士,主要从事乳酸菌及功能性乳制品的研究。
