溶解氧控制对枯草芽孢杆菌发酵生产腺苷的影响
2012-09-12刘剑徐达
刘剑,徐达
(广东肇庆星湖生物科技股份有限公司,广东肇庆,526060)
溶解氧控制对枯草芽孢杆菌发酵生产腺苷的影响
刘剑,徐达
(广东肇庆星湖生物科技股份有限公司,广东肇庆,526060)
在50 L的生物反应器中,通过控制溶解氧水平为5%、10%、20%、30%四个水平考察枯草芽孢杆菌发酵生产腺苷的影响,发现该菌株生长的溶解氧浓度在10%~20%。并通过发酵过程中菌株的生长情况、菌体摄氧率和发酵产苷进行相关分析。结果表明,在发酵过程中DO水平控制在10%~20%时腺苷积累量高,发酵液中DO水平为5%和30%均不利于发酵液中的腺苷积累。通过对发酵终点丙酮酸的检测,发现枯草芽孢杆菌在低溶氧状态下比高溶氧状态下积累更多的丙酮酸。在此基础上,提出两阶段DO控制策略,最终腺苷积累量达到20.1 g/L。
枯草芽孢杆菌,发酵,腺苷,溶解氧
腺苷(Adenosine)又称腺嘌呤核苷,具有促进冠状动脉扩张及心肌代谢的机能,扩张血管,增加冠血量的药理作用,可用于治疗冠状血管障碍、狭心症、动脉硬化症及高血压症等疾病,具有广泛的药用价值。此外,腺苷是合成阿糖腺苷、腺苷酸(AMP)、三磷酸腺苷(ATP)的主要原料,是一种重要的医药原料[1-2]。从1968年小西真八[3]利用枯草杆菌的异亮氨酸缺陷型发酵法生产鸟苷后,发酵法是生产腺苷主要的方法,常用的菌种是枯草芽孢杆菌。枯草芽孢杆菌属于好氧微生物,对氧的需求量较高,但其在不同溶氧条件下仍具有不同的生理特性,因此溶氧浓度作为有氧控制的一个关键因素,直接影响腺苷的生产水平[4]。通常而言,在生产嘌呤核苷产物时需要大风量,以保证发酵液中高的溶氧(DO)和低的CO2分布,但是,细胞生长和代谢产物的合成都存在一个最适DO值,较低的DO值会限制细胞生长和代谢物合成,较高的DO也可能对细胞生长和代谢产物的合成产生不利作用。因此,通过控制发酵液中的DO水平,同时监测分析发酵进气、排气中的O2、CO2含量,可以发现发酵过程中菌体生长代谢的变化情况[5-8]。根据张嗣良教授的多尺度微生物过程优化理论[9]的发酵过程参数相关分析原理,通过控制50 L的生物反应器中发酵液DO值在5%、10%、20%、30%四个不同水平,研究了不同溶解氧水平对菌体代谢活力及腺苷发酵产苷的影响,为腺苷工业生产提供理论参考。
1 材料和方法
1.1 菌种
枯草芽孢杆菌(Bacillus subtilis)M-090,遗传标记为:黄嘌呤缺陷型(Xan-),8-氮杂鸟嘌呤抗性,星湖生物科技股份有限公司腺苷生产菌株。
1.2 培养基
1.2.1 种子培养基(g/L)
葡萄糖10,酵母膏10,蛋白胨5,玉米浆5,尿素2,NaCl 2.5;pH 7.0~7.2。
1.2.2 发酵培养基(g/L)
葡萄糖120,酵母膏10,酵母粉8,玉米浆5,K2HPO42,MgSO44,(NH4)2SO420,Ca2CO320(分消);pH 7.0~7.2。
1.3 培养方法
1.3.1 菌种活化
取斜面保藏菌种划线接种于活化斜面,30℃恒温静置培养20~24 h。
1.3.2 种子培养
250 mL锥形瓶中培养基装量20 mL,34℃,100 r/min,培养12 h。
1.3.350 L发酵罐发酵培养
发酵液装量35 L,接种量8%,37℃,通气搅拌培养。定时测定和记录腺苷含量、DO值、OUR等参数。
1.4 分析方法
1.4.1 腺苷定量测定方法
Waters HPLC,Agilent Zorbax SB-Aq column(150 mm×4.6 mm,5 μm)。
1.4.2 溶氧测定
Mettler Toledod在线溶氧检测系统。
1.4.3 尾气中O2、CO2含量测定
分别用顺磁氧分析仪(Magnos 4G,德国H&B公司生产)与不分光红外仪(Uras 3G,德国H&B公司生产)在线测定。
1.4.4 菌体浓度的测定
吸取样品0.2 mL,用2 mol/L HCl溶液稀释20倍,摇匀后测定600 nm下的吸光度。
1.4.5 丙酮酸的测定
Waters HPLC,Agilent Zorbax SB-Aq column(150 mm×4.6 mm,5 μm)流动相0.001 mol/L H3PO4,流速0.6 mL/min,柱温35℃,检测波长210 nm。所有试剂均为色谱纯。
2 结果与分析
2.1 腺苷发酵过程的临界氧浓度
在发酵过程中,随着菌体代谢的加剧,OUR逐渐上升,造成DO不断下降,当DO与OUR反向变化时,表明工程水平的供氧对发酵不是限制因素。从腺苷发酵过程OUR和DO变化曲线图(图1)可以看出,发酵进行到8 h,DO跌至10%左右,此时OUR形成第1个峰值后转而下降,DO与OUR出现顺峰现象,表明此时DO已低于满足菌体呼吸要求的最低浓度,菌体代谢受到抑制[10]。从曲线初步判断氧浓度在20%以下在一定程度上影响了菌体细胞的呼吸(OUR),因此我们把当DO降到20%以下时的DO值作为腺苷发酵过程中的临界氧浓度。
2.2 不同溶氧水平对腺苷发酵过程的影响

图1 发酵过程OUR和DO变化曲线图
发酵过程中菌体的生长受到不同的DO控制水平的影响如图2(a)所示,DO控制在10%和20%的菌体浓度在29左右,而DO控制5%的菌体浓度比DO控制在10%和20%的菌体浓度降低15%左右,说明在限制氧浓度下,菌体生长明显受到抑制。发酵DO控制在30%菌体浓度在36 h略高于DO控制在10%和20%的菌体浓度,而36 h后菌体浓度比DO控制在10%和20%的菌体浓度高出10%左右。不同的DO控制水平对腺苷积累量的影响如图2(b),在限制氧浓度下(DO在5%左右),发酵28 h后,腺苷产物积累量基本不增加,仅为10.83 g/L。DO控制在10%和20%腺苷产率分别达18.25 g/L和19.07 g/L。发酵DO控制在30%,虽然前期产物积累较快,但后期增长缓慢,最终产物量为16.87 g/L。实验结果表明,DO控制适当水平(在10%~20%),发酵过程的产物积累呈稳定增加的趋势,发酵液中产苷水平最高。而溶氧水平控制太低,则影响菌体生长,菌体活力下降,代谢缓慢,产量下降。而溶氧控制过高导致前期菌体快速生长,菌体容易衰老,导致产物积累量减少。
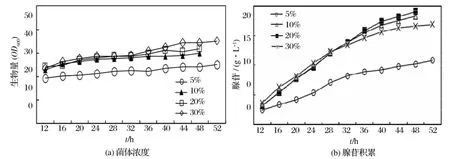
图2 不同的DO控制条件下菌体浓度和腺苷积累量
2.3 不同溶氧水平控制下腺苷发酵过程摄氧率表现
如图3所示,在发酵过程中分别控制DO在5%、10%、20%、30%等4个不同的水平检测菌体的摄氧率。DO在5%时,菌体的摄氧率30~40 mmol/(L·h),在发酵中后期(30 h后),菌体的摄氧率呈下降趋势,50 h之后菌体的摄氧率已低于20 mmol/(L·h);DO在10%~20%,产物积累期的菌体的摄氧率比较平稳,基本处于30~40 mmol/(L·h);而DO在30%时,发酵前期菌体的摄氧率较高,略高于40 mmol/(L·h),但在发酵中后期摄氧率下降幅度加大,与DO在5%时出现的情况类似。50 h之后,菌体的摄氧率已低于20 mmol/(L·h)。通过对4个溶氧控制之下,腺苷发酵过程摄氧率的比较发现,5%DO在36 h后,30%DO在42 h后菌体的摄氧率均低于30 mmol/(L·h);而DO在10%和DO在20%时,54 h后摄氧率才低于30 mmol/(L·h)水平。由此可见,DO水平控制在10%~20%时,有利于菌体维持生长活力,有利于产物积累;DO过低(5%左右)会抑制菌体活力,DO过高(30%左右),发酵前期呼吸代谢旺盛,但发酵后期菌体容易衰老,活力不足,DO过低和过高均对产物积累造成影响。
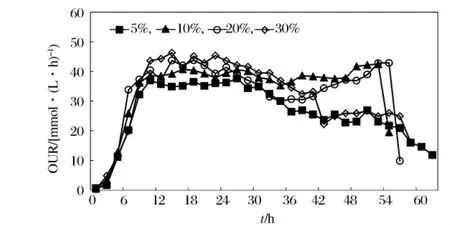
图3 不同DO条件下菌体摄氧量
2.4 不同溶氧水平控制下发酵终点的丙酮酸积累水平
通过检测不同溶氧条件下的丙酮酸积累水平,如图4所示,结果反映了在低溶氧控制下(10%~20%)丙酮酸水平比30%溶氧控制下的丙酮酸水平要高,而5%丙酮酸水平较低的原因是菌体生长受到了抑制。这个结果和Wen-Bang Yu等[10]研究结果相吻合,他们从转录组学的角度指出,枯草芽孢杆菌在低溶氧条件下能上调碳代谢途径上的基因表达,如葡萄糖代谢、丙酮酸代谢等,从而提高碳代谢的利用率,提高腺苷产量。
2.5 发酵过程控制DO对腺苷产量的影响
为了提高整个培养过程中腺苷产率,提出两阶段控制的策略。在发酵前期(0 h~24 h),控制DO水平在30%~40%;发酵24 h后控制DO在10%~20%。通过在发酵过程不同阶段控制不同的DO水平,来得到提高腺苷产量的目的。图5显示了在50 L发酵罐中采用两阶段DO控制策略,整个发酵过程中菌体的摄氧率变化曲线以及腺苷积累曲线,最终腺苷积累量为20.1 g/L。
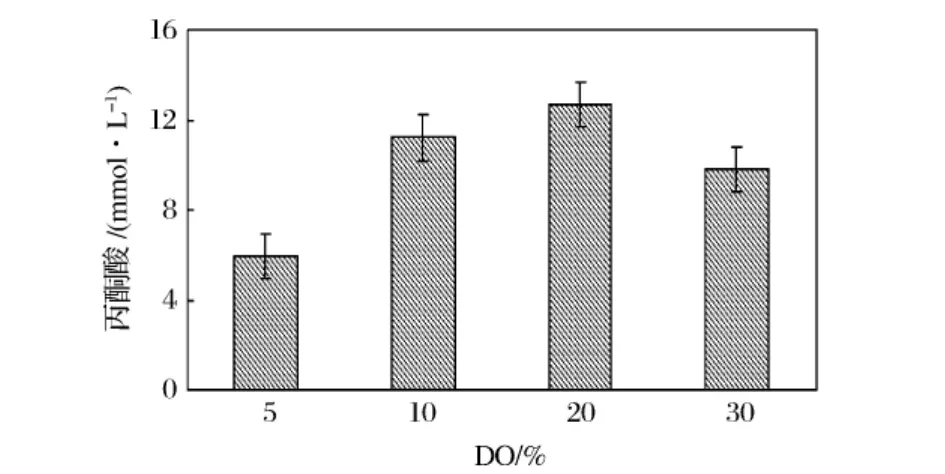
图4 不同溶氧条件下的丙酮酸积累水平(n=3,SD)
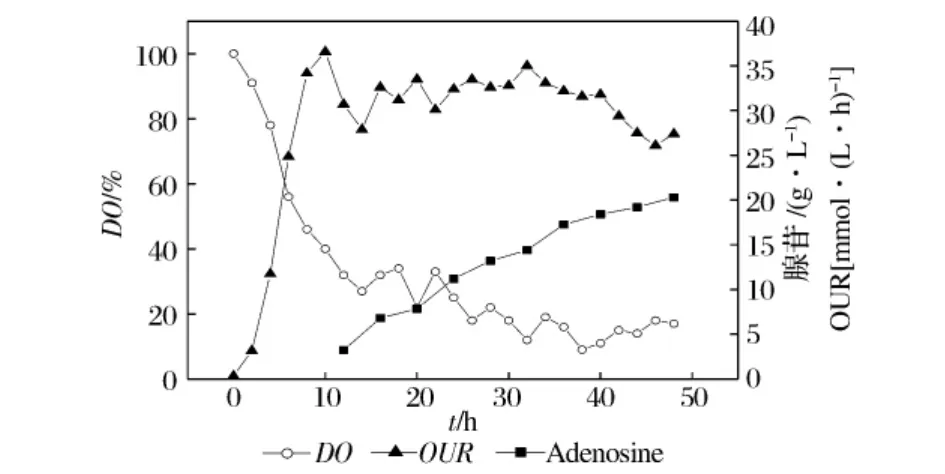
图5 发酵过程DO变化与腺苷积累关系
发酵前期控制较高的DO水平,由于菌体代谢活力的增加,初始产物的积累得到相应的提高;发酵中后期DO控制在10%~20%,菌体摄氧率(OUR)平稳,产物代谢途径正常,腺苷产物的积累稳步增长。
3 结论
对微生物发酵来说,溶解氧是发酵过程中需要考虑的重要因素,氧的不足会造成代谢异常,产量降低,而溶氧过高虽满足了菌体生长的需求,但未必能控制菌株经济利用,达到提高产量的目的[11-13]。本文通过控制不同溶氧水平对腺苷生产菌——枯草芽孢杆菌的研究,表明控制发酵的溶解氧浓度在10%~20%之间,能控制菌体生长,菌体的摄氧率平稳处于30~40mmol/(L·h),从而使发酵过程的产物积累呈稳定增加的趋势,达到较高的水平。通过检测不同溶氧条件下的丙酮酸积累水平,也印证了枯草芽孢杆菌在低溶氧条件下能提高碳代谢的利用率,从而提高腺苷产量。文章通过两个阶段控制的策略,在发酵前期(0h~24h),控制DO水平在30%~40%,发酵24 h后控制DO在10%~20%,最终腺苷积累量达到20.1g/L。枯草芽孢杆菌是一种应用非常广泛的工业微生物,本文的研究可为枯草芽孢杆菌发酵生产其它品种起到参考作用。
[1]柏建新,张一平,朱晓宏,等.微生物发酵生产腺苷的研究[J].食品与发酵工业,2001,27(3):16-20.
[2]张克旭,陈宁,张蓓,等.代谢控制发酵[M].北京:中国轻工业出版社,1998.
[3]Konishi S,Kubota K,Aoki R,et al.Studies on the production of purine hucleotides[J].Amino Aoid and Nucleic Acid,1968,18(15):22-24.
[4]Kole MM,Draper I,Gerson DF.Protease production by Bacillus subtilis in oxygen-controlled,glucose fed-batch fermentations[J].Appl Microbiol Biotechnol,1988,28:404-408.
[5]林开建,郑庆建.溶解氧浓度对多粘菌素发酵影响的研究[J].化学工程与设备,2007(1):47-49.
[6]葛飞,黄寅,桂琳.溶解氧对细脚拟青霉小试发酵过程及胞内核苷积累的影响[J].食品工业科技,2010,31(7):180~186.
[7]张建勇,王晓港,王水莲,等.溶氧对重组毕赤酵母高密度发酵生产腺苷蛋氨酸的影响[J].齐鲁药事,2007,26(7):428-430.
[8]Papagianni M.Effects of dissolved oxygen and pH levels on weissellin A production by Weissella paramesenteroides DX in fermentation[J].Bioprocess Biosyst Eng,2012,DOI 10.1007.
[9]张嗣良,储炬.多尺度微生物过程优化[M].北京:化学工业出版社,2003:94.
[10]Yu Wen-Bang,Gao Shu-Hong,Yin Chun-Yun,et al.Comparative transcriptome analysis of Bacillus subtilis responding to dissolved oxygen in adenosine fermentation[J].PLoS ONE,2011,6(5):e20092.DOI 10.1371.
[11]王恒伟,陈长华,付水林,等.腺苷发酵液中有机酸的代谢规律[J].华东理工大学学报,2004,30(2):223-226.
[12]Calik P,Calik G,Ozdamar TH.Oxygen transfer effects in serine alkaline protease fermentation by Bacillus licheniformis:use of citric acid as the carbon source[J].Enzyme and Microbial Technology,1997,23(7-8):451-461.
[13]Li Y,Hugenholtz J,Chen J et,al.Enhancement of pyruvate production by Torulopsis glabrata using a two-stage oxygen supply control strategy[J].Chemistry and Materials Science,2002,60:101-106.
ABSTRACTThe effect of oxygen supply on adenosine production of Bacillus subtilis was studied using 50L fermentor with the air saturation at 5%,10%,20%and 30%.We found that the concentration of the critical dissolved oxygen in the industrial strains was 10%~20%.The relationship among strain growths,oxygen uptake rate in the process and dissolved oxygen(DO)tension on adenosine accumulation was analyzed.The results showed that during the adenosine fermentation of Bacillus subtilis,it was better to control DO at 10%~20%than at 5%and 30%.We found that the concentration of pyruvate at the final time of fermentation was higher under low oxygen condition than that under high oxygen condition.Based on the results,a strategy of two stages for DO manipulation was proposed.With this strategy,the adenosine accumulated in 50L fermentor ultimately reached 20.1g/L.
Key wordsBacillus subtilis,fermentation,adenosine,dissolved oxygen
Effects of Dissolved Oxygen Control on Adenosine
Production of Bacillus subtilis in Fermentation
Liu Jian,Xu Da
(Star Lake Bioscience Co.Inc,Zhaoqing 526060,China)
学士,工程师。
2012-04-11,改回日期:2012-05-24
