H5亚型AIV HA抗原表位重组蛋白McAbs的制备及应用
2012-09-11庞耀珊谢芝勋邓显文谢志勤谢丽基刘加波
庞耀珊,谢芝勋,邓显文,谢志勤,谢丽基,刘加波,范 晴
(广西壮族自治区兽医研究所/广西畜禽疫苗新技术重点实验室,广西南宁 530001)
禽流感病毒(Avian inf l uenza virus, AIV)属于A型流感病毒,能广泛感染包括鸟类和哺乳动物在内多种动物发生严重疾病综合症[1-11]。至今为止,已发现了16个血凝素(HA)和9个神经氨酸酶(NA)亚型[12-13]。不同亚型之间禽流感病毒的致病性是不同的。其中,H5亚型为高致病性亚型,历史上多起与H5亚型相关的禽流感疫情爆发,除了造成禽类大规模死亡外,对人畜也造成了不同程度的威胁。特别是近年来在亚洲地区爆发的H5N1亚型禽流感,在肆虐该地区养禽业的同时,也引发了多起人畜感染发病、甚至死亡的事件 ,凸现了该病的重要公共卫生意义[2-6]。AIV是一种极易传播的病原,感染禽类的流动及其与其它动物密切接触是禽流感传播的一个重要因素[14-17]。研究开发有效的诊断试剂和诊断技术对该病的有效防控具有重要意义[18-22]。
研究表明,HA蛋白是AIV最主要的表面抗原糖蛋白,与病毒的抗原性和致病性直接相关[23-24],在AIV的病原学诊断和血清学诊断中扮演着重要角色[19-22,25]。
在AIV单克隆抗体制备技术中,免疫抗原主要包括以下3大类:纯化病毒、病毒亚单位及重组表达蛋白[25-31]。纯化病毒和病毒亚单位作为抗原制备单克隆抗体时,需要涉及病毒培养、灭活和纯化等过程。特别是H5亚型AIV是一种高致病性亚型,具有潜在的生物安全危害,需要在授权的特定实验室并在特殊条件下才能生产,抗原来源受到严格控制,在一定程度上限制了该病诊断技术研究的进程。为此,十分有必要探索一条安全可靠的抗原制备及诊断试剂开发途径,为相关诊断技术的研究开发奠定基础。
抗原表位又称抗原决定簇(antigenic determinant,AD),是抗原物质中激活淋巴细胞,引起机体免疫应答反应的主要结构,它决定着抗原的特异性。为了解决H5亚型AIV抗原及其单克隆抗体生产难题,本研究拟利用H5N1亚型禽流感病毒的HA抗原表位重组表达蛋白为免疫抗原,通过杂交、筛选,获取针对该抗原表位的单克隆抗体杂交瘤细胞株,并对该细胞株所生产的单克隆抗体的主要特性及其可用性进行初步研究。为H5亚型AIV抗原制备及单克隆抗体制备探索的一条安全可靠的途径,打破该病检测技术研究开发的瓶颈,对H5亚型禽流感的防控有重要意义。
1 材料与方法
1.1 试验材料与试验条件
1.1.1 重组表达质粒阳性重组菌 H5亚型禽流感病毒HA抗原表位重组表达质粒阳性重组菌Rosetta-gami B (DE3)/pET-32a(+)-HA,本实验室构建并保存,该重组菌诱导表达的目的蛋白大小为48.1kD。
1.1.2 试验动物与细胞 12只8~10周龄健康BALB/c鼠,购自广西医科大学实验动物中心;骨髓瘤细胞株SP2/0,由美国宾夕法尼亚州州立大学动物诊断中心Dr. Lu惠赠,本实验室保存。
1.1.3 主要药品试剂 福氏完全佐剂及不完全佐剂、改良RPMI-1640培养基及DMEM培养基、胎牛血清(FBS),GIBCO公司产品;氨基蝶呤(Aminopterin)、次黄嘌呤(Hypoxanthine)、胸腺嘧啶核苷(Thymidine)、PEG-1000,Sigma公司产品,分别配制成含氨基蝶呤4×10-5mol/L的A储存液、含次黄嘌呤1×10-2mol/L和含胸腺嘧啶核苷1.6×10-3mol/L的HT储存液、50%PEG储存液,-20℃保存。羊抗鼠免疫球蛋白亚类分型试剂盒(SBA Cloningtyping System/HRP),购自SouthernBiotech公司;HRP标记羊抗鼠IgG及羊抗鸡IgG,购自KPL公司。H5N1标准阳性血清和SPF阴性鸡血清,购自哈尔滨维科生物技术开发公司。BCA蛋白浓度测定试剂盒,购自上海碧云天生物技术有限公司。
他爸脸色精彩极了,我妈的表情更精彩,巴掌再次拍拍落在我身上,我捂着屁股乱叫,一人做事一人当,你们懂个屁。
1.1.4 试验仪器 KHB ST-360酶标仪,上海科华实验系统有限公司产品。
1.2 设计思路 利用本实验室前期构建的H5亚型AIV HA抗原表位重组表达质粒阳性重组菌Rosettagami B (DE3)/pET-32a(+)-HA在体外进行诱导培养,获得重组蛋白包涵体。利用重组蛋白上组氨酸标签对包涵体蛋白进行纯化。纯化蛋白与福氏佐剂混合制备成抗原,免疫8~10周龄健康BALB/c鼠。多次免疫后,取小鼠的脾细胞与SP2/0骨髓瘤细胞融合,获得杂交瘤细胞株。以纯化重组表达蛋白为抗原建立间接ELISA,并用该方法对杂交瘤细胞株进行多次筛选,得到分泌相应单克隆抗体的细胞株。利用有限稀释法对单克隆细胞株进行亚克隆,获得纯化的单克隆细胞株。扩大培养阳性的单克隆细胞株,腹腔注射小鼠3只生产腹水。分别测定单克隆抗体的效价及其基本特性,最后通过免疫阻断试验评估该单克隆抗体的实际应用价值。
1.3 试验方法
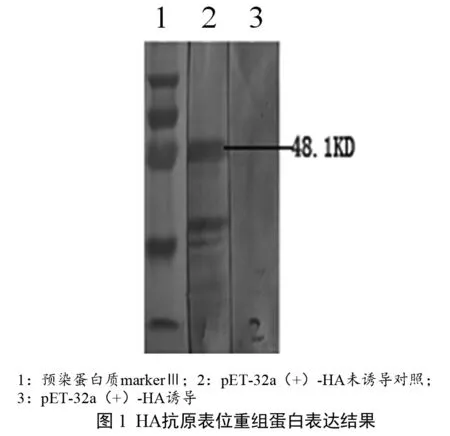
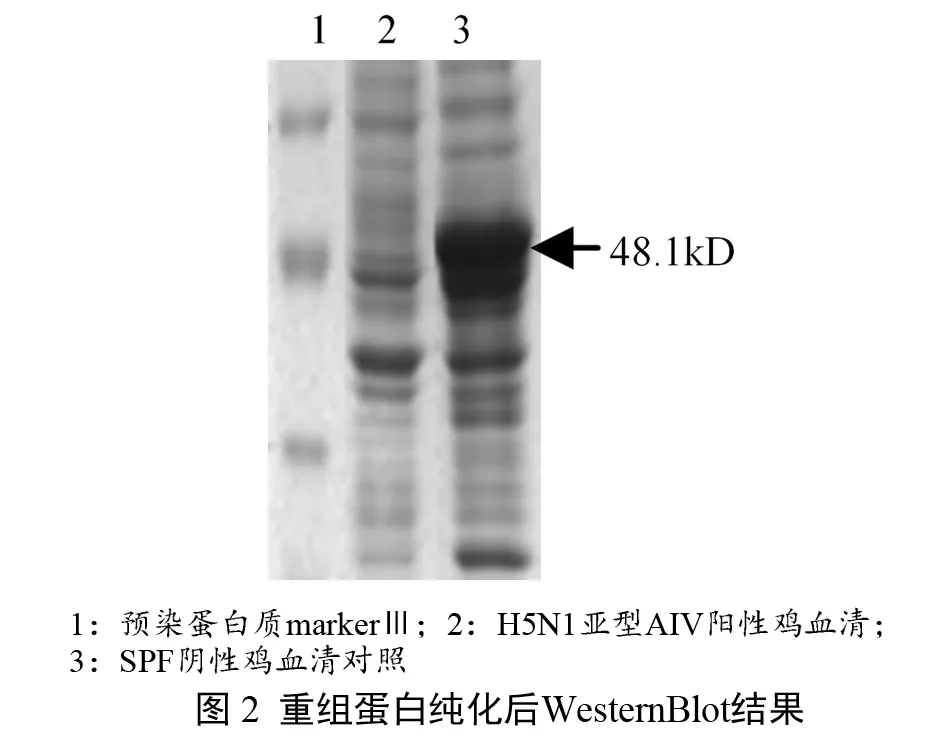
1.3.1 HA抗原表位重组蛋白的制备及纯化 将含有H5亚型禽流感病毒HA抗原表位重组表达质粒阳性重组菌Rosetta-gami B(DE3)/pET-32a(+)-HA接种到5 mL含50 μg/mL氨苄青霉素的LB液体培养基,37 ℃培养过夜,再按10%的接种量接种到500 mL含50 μg/mL氨苄青霉素的LB液体培养基中,37 ℃、150 r/min振摇培养至对数生长期,用紫外分光光度计测定菌液的OD600吸光值,当吸光值达到0.5~0.8之间的任何一个值时,加入终浓度为1 mmol/L的异丙基-β-D-硫代吡喃半乳糖苷(IPTG)诱导剂,继续在37 ℃、150 r/min振摇培养过夜,获得细菌悬液,2500×g离心10 min,收集菌体沉淀。用10 mL的PBS溶液重悬,取5μL菌体悬液按常规方法进行SDS-PAGE电泳,检测表达结果(目的重组蛋白大小约48.1 kD);其余悬液加入终浓度为100 μg/mL的溶菌酶,在冰上进行超声波裂解,10000×g离心5 min收集包涵体沉淀。利用QIAexpress Ni-NTA Fast Sart His标签重组蛋白纯化试剂盒,按说明对His标签重组蛋白进行纯化,纯化产物置-70 ℃保存备用。取5 μL纯化产物按常规方法进行SDS-PAGE电泳和WesternBlot,并用H5N1标准阳性鸡血清和SPF阴性鸡血清进行验证。
1.3.2 单克隆抗体检测方法的建立 用BCA蛋白浓度测定试剂盒测定纯化蛋白的浓度,参考秦春香[32]方法,根据ELISA技术原理,利用方阵试验,将重组蛋白稀释成不同浓度包被ELISA板,测定小鼠阳性血清的OD450吸光值。
1.3.3 杂交瘤细胞株的建立
1.3.3.1 小鼠免疫 加入福氏完全佐剂制备成200 μg/mL的免疫抗原,参考文献[25,31]方法,皮下分点注射8-10周龄健康BALB/c鼠,0.5 mL/只。以后每隔14天,用福氏不完全佐剂制备的抗原再免疫2次。细胞融合前3天通过腹腔注射加强免疫一次。
1.3.3.2 细胞融合及筛选 参考文献[31],无菌剖杀小鼠,制备脾细胞悬液,利用PEG融合试剂将脾细胞与小鼠骨髓瘤细胞SP2/0进行融合。融合10天后,收集杂交瘤细胞上清液,以SP2/0细胞上清液和免疫小鼠阳性血清分别作阴性和阳性对照,用所建立的HA抗原表位重组蛋白ELISA检测方法杂交瘤细胞上清液进行鉴定。利用有限稀释法对阳性克隆进行多次传代纯化,直到得到稳定的阳性杂交瘤细胞株,液氮保存。
1.4 单克隆抗体的制备 将得到的杂交瘤细胞株扩大培养,制备成5×106个/mL细胞悬液。参考文献[31]方法,先提前1天对9只8~10周龄健康BALB/c小鼠腹腔注射福氏不完全佐剂,剂量为0.1 mL/鼠,1天后再通过小鼠腹腔注射上述新鲜制备的杂交瘤细胞悬液1 mL/鼠。注射后每天观察小鼠腹腔变化,待小鼠腹部明显膨大后,剖腹采集腹水,10000×g离心3 min,收集上清,用间接ELISA方法测定腹水的单克隆抗体效价,-70 ℃保存备用。
1.5 单克隆抗体特性鉴定
1.5.1 Ig亚类鉴定 收集阳性杂交瘤细胞上清液,利用羊抗鼠免疫球蛋白亚类分型试剂盒(SBA Cloningtyping System/HRP),按试剂盒说明对阳性杂交瘤细胞所分泌的单克隆抗体Ig类型和轻链类型进行分型鉴定。
1.5.2 杂交瘤细胞稳定性测定 冻存的杂交瘤细胞在液氮中冻存3个月和6个月后进行复苏,分别连续传5代,收集细胞上清液,用本研究所建立的间接ELISA检测方法进行测定。
1.5.3 单克隆抗体特异性测定 腹水单克隆抗体稀释2000倍后分别与固定于硝酸纤维素膜上的H5、H7、H9亚型禽流感病毒阳性抗原、新城疫病毒(NDV)阳性抗原、传染性支气管炎病毒(IBV)阳性抗原、产蛋下降综合症病毒(EDS)阳性抗原按常规方法进行WesternBlot免疫印迹试验,同时以SP2/0细胞上清、未免疫小鼠阴性血清、SPF鸡血清作阴性对照,阳性鼠血清和H5N1阳性鸡血清作阳性对照,检测单克隆抗体的特异性。
1.6 免疫阻断试验 用辣根过氧化酶(HRP)标记腹水单克隆抗体,将H5N1亚型禽流感病毒阳性鸡血清稀释100倍后,加入到1.5方法中建立的HA抗原表位重组表达蛋白包被的ELISA板中,37 ℃作用1 h,再加入1×104倍稀释的HRP标记的腹水单克隆抗体,37 ℃作用30 min,显色后用酶标仪测定样品的OD450吸光值。试验同时用SPF鸡血清代替H5N1亚型禽流感病毒阳性鸡血清作阴性对照。每份样品重复测试3次。根据公式X+3STD计算出阳性判定值,公式中的X为阴性对照样品OD450的平均值,STD为阴性对照样品方差。当待检样品的OD450平均值≤阳性判定值时,判定待检样品阻断阳性,反之为阴性。
2 结果
2.1 HA抗原表位重组蛋白的制备及纯化结果 含有H5亚型禽流感病毒HA抗原表位重组表达质粒阳性重组菌Rosetta-gami B(DE3)/pET-32a(+)-HA经IPTG诱导后,SDS-PAGE检测结果如图1所示,在48.1 kD处出现丰度较高的重组表达蛋白,重组蛋白包涵体经his标签纯化后能与H5N1标准阳性鸡血清起特异性反应,与SPF阴性鸡血清无反应,见图2 WesternBlot免疫印迹结果。
2.2 单克隆抗体检测方法的建立结果 以不同浓度的纯化重组蛋白为抗原包被ELISA板,通过方阵试验测试,建立了以15 μg/mL蛋白浓度为包被抗原的H5亚型禽流感病毒HA抗原表位单克隆抗体的间接ELISA检测方法。
2.3 杂交瘤细胞株的建立结果 多次免疫的BALB/c鼠脾细胞与SP2/0骨髓瘤细胞融合后,经间接ELISA检测筛选,获得1株能稳定分泌单克隆抗体的杂交瘤细胞株。杂交瘤细胞株多次克隆纯化后,命名为W2-2。
2.4 单克隆抗体的制备结果 W2-2细胞株腹腔注射小鼠后,小鼠于第10天左右腹部明显膨大,平均每只小鼠采集到约8 mL腹水。经测定,离心处理后的腹水上清单克隆抗体的ELISA效价达1:5×104。
2.5 单克隆抗体特性鉴定结果
2.5.1 Ig亚类鉴定结果 经鉴定,杂交瘤细胞株所分泌的单克隆抗体亚类为IgM、轻链类型为IgK亚类。
2.5.2 杂交瘤细胞稳定性测定结果 在液氮中冻存了3个月和6个月后的杂交瘤细胞复苏后,经本研究所建立的间接ELISA检测方法测定,其传代细胞仍能稳定分泌特定单克隆抗体。
2.5.3 单克隆抗体特异性测定结果 腹水单克隆抗体稀释2000倍后与不同禽病抗原WesternBlot免疫印迹结果如表1及图3所示。从表1中结果可见,本研究所制备的单克隆抗体只与H5亚型禽流感病毒阳性抗原起反应,与供试的其它禽病阳性抗原无反应,结果与小鼠阳性血清及鸡H5N1血清试验结果一致;SP2/0细胞上清、未免疫小鼠阴性血清、SPF鸡血清与供试的上述各种抗原均无反应。

表1 单克隆抗体特异性鉴定结果

2.6 免疫阻断试验结果 结果如表2所示,SPF阴性血清100倍稀释后,3次重复试验的OD450平均值为0.252,STD值为0.033,根据公式X+3STD计算出其阳性判定值为0.352。H5N1禽流感病毒阳性鸡血清100倍稀释后所测得的3次重复试验结果平均值为0.152,小于阳性判定值0.352,判定为阻断试验阳性。
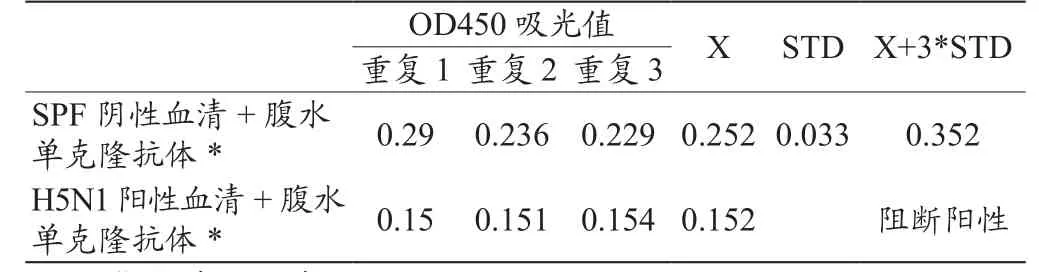
表2 免疫阻断试验结果
3 讨论
单克隆抗体是由B淋巴细胞与骨髓瘤细胞融合后形成的杂交瘤单克隆细胞分泌合成的针对一种特定抗原决定簇的抗体,具有来源方便、稳定性高、均一性好、浓度高等优点,可用作病原或血清学检验诊断试剂[25-31]。
H5N1禽流感病毒基因组由8个RNA节段组成,共编码11种病毒蛋白,抗原成分复杂,所包含的抗原决定簇数量庞大。利用提纯病毒免疫小鼠时,可能会得到针对各种抗原成份的单克隆抗体,给单克隆抗体的筛选带来一定困难[28-30]。
本研究利用重组表达蛋白为抗原制备单克隆抗体,抗原来源方便,纯化方法简单,与纯化病毒制备方法相比,更易于得到特定抗体种类单一的杂交瘤细胞株[30]。如图2 WesternBlot免疫印迹结果和杂交瘤细胞株的建立结果所示,重组表达蛋白可以作为ELISA包被抗原直接对单克隆抗体进行筛选,简化了单克隆抗体的筛选工作。
本研究所建立的单克隆抗体杂交瘤细胞株,在液氮中保存3个月和6个月后再复苏,经多次传代仍能稳定分泌针对H5亚型AIV HA抗原表位蛋白的单克隆抗体,其ELISA效价高达1:5×104。WesternBlot免疫印迹试验结果表明,本研究制备的单克隆抗体具有高度特异性。B淋巴细胞产生的抗体,根据其化学结构和抗原的不同可以分为IgG、IgM、IgA、IgE和IgD 5种类型。资料表明[33-34],IgM具有参与凝集反应和补体结合反应的特性。本研究所制备的单克隆抗体为具有IgK轻链的IgM亚类,提示这些单克隆抗体同样具有凝集反应和补体结合反应活性,可以作为检测试剂应用于下一步相关检测技术中。本研究的免疫阻断试验结果也初步验证了这一推断。
4 结论
本研究成功探索出一套利用H5亚型AIV HA抗原表位重组表达蛋白制备单克隆抗体的方法,该方法与纯化病毒制备方法相比,更加简便、高效,打破了H5亚型AIV检测技术研究的局限性。
致谢:感谢美国宾夕法尼亚州州立大学动物诊断中心的Dr. Lu Hua-guang赠送的骨髓瘤细胞株SP2/0;感谢南宁市蓝光生物技术有限公司的谢体三博士对本研究提供支持和帮助。
[1]Alexander D J. A review of avian influenza in different bird species[J]. Vet Microbiol, 2000, 74(1/2): 3-13.
[2]Aditama TY, Samaan G, Kusriastuti R,et al.Risk factors for cluster outbreaks of avian influenza A H5N1 infection,Indonesia[J]. Clinical Infectious Diseases,2011,53(12): 1237-1244.
[3]Fasina F O, Rivas A L, Bisschop S P, et al. Identification of risk factors associated with highly pathogenic avian inf l uenza H5N1 virus infection in poultry farms, in Nigeria during the epidemic of 2006-2007[J]. Pre Vet Med, 2011,98(2/3):204-208.
[4]Phuong do Q, Dung N T, Jörgensen P H, et al. Virulence of H5N1 inf l uenza virus in Cattle Egrets (Bubulcus ibis)[J].Journal of Wildlife Diseases, 2011, 47(2):314-320.
[5]Zhang J, Lei F. Analysis of human infectious avian inf l uenza virus: hemagglutinin genetic characteristics in Asia and Africa from 2004 to 2009[J]. Integrative Zoology,2010,5(3):264-271.
[6]Sirinonthanawech N, Uiprasertkul M, Suptawiwat O,et al.Viral load of the highly pathogenic avian inf l uenza H5N1 virus in infected human tissues[J]. J Med Virol, 2011, 83(8):1418-1423.
[7]Chmielewski R, Swayne D E. Avian inf l uenza: public health and food safety concerns[J]. Annual Review of Food Science and Technology,2011,2: 37-57.
[8]Bui V N, Xininigen O H, Karibe K, et al.H4N8 subtype avian influenza virus isolated from shorebirds contains a unique PB1 gene and causes severe respiratory disease in mice[J]. Virol, 2012,423(1): 77-88.
[9]Choi J G, Kang H M, Kim M C, et al. Genetic relationship of H3 subtype avian inf l uenza viruses isolated from domestic ducks and wild birds in Korea and their pathogenic potential in chickens and ducks[J]. Vet Microbiol, 2012, 155(2/4): 147-157.
[10]Kang H M, Kim M C, Choi J G, et al. Genetic analyses of avian inf l uenza viruses in Mongolia, 2007 to 2009, and their relationships with Korean isolates from domestic poultry and wild birds[J]. Poultry Science,2011,90(10): 2229-2242.
[11]Nam J H, Kim E H, Song D, et al. Emergence of mammalian species-infectious and -pathogenic avian influenza H6N5 virus with no evidence of adaptation[J]. J Virol, 2011, 85(24): 13271-13277.
[12]Fouchier R A, Munster V, Wallensten A,et al.Characterization of a novel influenza A virus hemagglutinin subtype (H16) obtained from black-headed gulls[J]. J Virol,2005,79(5):2814-2822.
[13]Zhao G, Pan J, Gu X, et al. Isolation and phylogenetic analysis of avian-origin European H1N1 swine inf l uenza viruses in Jiangsu, China[J]. Virus Genes, 2012,44(2): 295-300.
[14]Sakoda Y, Ito H, Uchida Y, et al. Reintroduction of H5N1 highly pathogenic avian inf l uenza virus by migratory water birds,causing poultry outbreaks in the 2010-2011 winter season in Japan[J]. J Gen Virol, 2012, 93(3): 541-550.
[15]Takakuwa H, Yamashiro T, Le M Q,et al. Molecular epidemiology of avian inf l uenza viruses circulating among healthy poultry flocks in farms in northern Vietnam[J]. Prev Vet Med,2012, 103(2/3): 192-200.
[16]Spekreijse D,Bouma A,Koch G,et al. Airborne transmission of a highly pathogenic avian inf l uenza virus strain H5N1 between groups of chickens quantified in an experimental setting[J]. Vet Microbiol, 2011, 152(1/2):88-95.
[17]Penny MA, Saurina J, Keller I, et al.Transmission dynamics of highly pathogenic avian inf l uenza at Lake Constance (Europe)during the outbreak of winter 2005-2006[J]. EcoHealth, 2010,7(3):275-282.
[18]Slomka M J, To T L, Tong H H, et al.Evaluation of lateral fl ow devices for identif i cation of infected poultry by testing swab and feather specimens during H5N1 highly pathogenic avian inf l uenza outbreaks in Vietnam[J]. Inf l uenza and Other Respiratory Viruses, 2011, DOI: 10.1111/j.1750-2659.2011.00317.x.
[19]庞耀珊,谢芝勋,邓显文,等. 多重反转录聚合酶链反应检测H5亚型禽流感病毒方法的建立[J]. 中国人兽共患病杂志,2005,21(9):762-764.
[20]Xie Z, Pang Y S, Liu J, et al. A multiplex RT-PCR for detection of type A inf l uenza virus and differentiation of avian H5,H7, and H9 hemagglutinin subtypes[J]. Molecular and Cellular Probes, 2006, 20(3/4):245-249.
[21]Peng Y, Xie Z X, Liu J B, et al. Visual detection of H3 subtype avian influenza viruses by reverse transcription loopmediated isothermal amplif i cation assay[J]. Virol J, 2011, 8(1):337-347.
[22]Masalova O V, Klimova R R, Chichev E V,et al.Development of monoclonal antibodies to highly pathogenic avian inf l uenza H5N1 virus and their application to diagnostics,prophylaxis, and therapy[J]. Acta Virologica, 2011, 55(1):3-14.
[23]Skehel J J, Wiley D C. Receptor binding and membrane fusion in virus entry: the influenza hemagglutinin[J]. Annual Review of Biochemistry, 2000, 69: 531-569.
[24]Suguitan A L Jr, Matsuoka Y, Lau Y F, et al. The multibasic cleavage site of the hemagglutinin of highly pathogenic A/Vietnam/1203/2004 (H5N1) avian influenza virus acts as a virulence factor in a host-specif i c manner in mammals[J]. J Virol,2012, 86(5): 2706-2714.
[25]Ohkura T, Kikuchi Y, Kono N,et al. Epitope mapping of neutralizing monoclonal antibody in avian influenza A H5N1 virus hemagglutinin[J]. Biochemicaland Biophysical Research Communications, 2012, 418(1):38-43.
[26]Stropkovská A, Mucha V, Fislová T,et al.Broadly crossreactive monoclonal antibodies against HA2 glycopeptide of Inf l uenza A virus hemagglutinin of H3 subtype reduce replication of influenza A viruses of human and avian origin[J]. Acta Virologica, 2009,53(1):15-20.
[27]Wang X, Castro A E, Castro M D,et al. Production and evaluation criteria of specific monoclonal antibodies to the hemagglutinin of the H7N2 subtype of avian influenza virus[J].Journal of Veterinary Diagnostic Investigation, 2000, 12(6):503-509.
[28]Huang H, Dan H, Zhou Y, et al. Different neutralization efficiency of neutralizing monoclonal antibodies against avian influenza H5N1 virus to virus strains from different hosts[J].Molecular Immunology, 2007,44(5):1052-1055.
[29]Chen Y, Qin K, Wu W L, et al. Broad cross-protection against H5N1 avian influenza virus infection by means of monoclonal antibodies that map to conserved viral epitopes[J]. The Journal of Infectious Diseases, 2009,199(1):49-58.
[30]黄庆华,张果平,胡北侠,等.禽流感病毒单克隆抗体的研制[J].家畜生态学报,2010,31(5):99-102.
[31]崔佳莹,李 印,于 扬,等. H5N1亚型禽流感病毒血凝素蛋白单克隆抗体的制备及鉴定[J]. 中国预防兽医学报,2011,33(6)476-478.
[32]Xie Z X,Qin C X,Xie L J,et al. Recombinant protein-based ELISA for detection and differentiation of antibodies against avian reovirus in vaccinated and non-vaccinated chickens[J]. J Virol Methods, 2010,165(1):108-111.
[33]Arya S,Chen F,Spycher S,et al. Mapping of amino acid residues in the C mu 3 domain of mouse IgM important in macromolecular assembly and complement-dependent cytolysis[J].J Immunol, 1994, 152(3):1206-1212.
[34]Wright J F, Shulman M J, Isenman D E, et al. C1 binding by mouse IgM. The effect of abnormal glycosylation at position 402 resulting from a serine to asparagine exchange at residue 406 of the mu-chain[J]. Biol Chem, 1990,265(18):10506-10513.
